花龄期棉花虫害的电子鼻检测
周 博,代雨婷,李 超,王 俊
花龄期棉花虫害的电子鼻检测
周 博1,代雨婷2,李 超1,王 俊2※
(1. 盐城工学院机械工程学院,盐城 224051;2. 浙江大学生物系统工程与食品科学学院,杭州 310029)
棉花害虫具有隐蔽性、迁飞性和突发性特点,并且影响因素众多,棉花虫害准确地诊断是农业领域的难点问题。该研究以受到棉铃虫侵害的花铃期棉花为研究对象,采用电子鼻对不同处理的棉花挥发物进行检测。研究表明,主成分分析(Principal Component Analysis, PCA)和聚类分析结果显示健康棉花释放的挥发物具有明显的昼夜节律性,健康棉花与虫害棉花差异性显著。径向基函数神经网络(Radial Basis Function Neural Network, RBFNN)对8个不同时间的4组虫害棉花处理进行分析,测试集判别总的正确率为73.4%,健康棉花对照组测试集判别正确率100%,误判样本出现在3个虫害处理之间。当不考虑时间因素建立虫害棉花统一的预测模型,RBFNN模型对健康棉花对照组的预测正确率均达到了100%,分析结果可以作为花铃期棉花是否遭受棉铃虫侵害的依据,说明电子鼻可以作为棉花虫害发生的有效监测手段,在农作物虫害监测领域具有潜在的应用价值。
电子鼻;神经网络;预测;棉花;棉铃虫;模式识别
0 引 言
棉花是中国最重要的经济作物之一,其产量和消费量居世界首位。但是虫害对棉花生产造成巨大危害,据统计中国棉花每年因虫害造成的产量损失达15%~20%,严重危害年份可达50%。虫害快速准确地诊断是制定正确防范措施、减少农药用量、降低虫害发生率、保证农业增产的重要前提。在棉花虫害的防治体系中,虫害诊断至今为薄弱环节,传统的虫害诊断主要依靠经验来确定棉花的害虫种类和受害程度,由于农民个体素质的差异以及人为主观因素的影响,诊断结果往往不准确,从而延误了害虫的除治,导致棉花减产严重[1]。所以,需要对新的棉花虫害诊断技术进行研究。
近年来国内外学者采用声特征技术[2]、雷达技术[3]、图像识别技术[4]、近红外光谱技术[5]和遥感技术[6]等现代机器检测技术对农作物虫害进行了研究,但是由于农作物生长条件复杂,虫害的发生、发展与气候因素、地理因素和农作物品种之间有着密切的关系,其同时受到多种因素的影响,具有不确定、模糊、随机性特征,是一个复杂的非线性系统,所以农作物虫害的诊断至今仍是农作物监测领域的难点问题。而棉花害虫种类众多,并且为害特点是大多蛀食蕾、花、铃,具有很大的隐蔽性、迁飞性和突发性,所以相对其他农作物来说棉花虫害的检测也更为困难。
电子鼻是一种新颖的仿生物嗅觉检测仪器,由于其检测不需要复杂的样本前处理过程,与传统化学分析方法相比电子鼻具有分析成本低、响应时间快、适用于现场实时检测等优点[7]。目前已出现有关电子鼻检测农作物虫害的报道,Laothawornkitkul等[8]使用主成分分析(Principal Component Analysis, PCA)、线性判别分析(Linear Discriminant Analysis, LDA)对受病虫害的黄瓜、辣椒、番茄苗进行了区分;Lan等[9]采用PCA对扑捉的棉盲椿象进行分类。为了提高电子鼻检测的准确率,多种神经网络模型被用于病虫害的研究,Zhou等[10]采用反向传播神经网络(Back Propagation Neural Network, BPNN)诊断水稻褐飞虱虫害情况;Ghaffari等[11]采用支持向量机(Support Vector Machine, SVM)配合径向基函数(Radial Basis Function, RBF)对健康和受到虫害的黄瓜、辣椒、番茄苗进行区分,准确率达到90%以上;程绍明等[12]采用遗传算法(Genetic Algorithm, GA)和BPNN对对感染早疫病病害的番茄苗进行了预测。电子鼻检测可以获得农作物虫害不同类别的定性结果,但是农作物挥发物的定量信息通常采用气相色谱质谱法(Gas Chromatography-Mass Spectrometry, GC-MS)来检测,代雨婷等[13]采用GC-MS检测了棉花虫害挥发物,棉花挥发物主要包括芳香族化合物、萜烯类、烷烃、酸类、酯类和醇类,健康棉花和受虫害棉花组的1,4-二甲基苯和2-甲基萘等芳香族化合物以及-蒎烯、-石竹烯和花侧柏烯等萜烯类化合物存在显著差异,GC-MS结果能够印证电子鼻检测结果。以上研究表明电子鼻可以通过检测农作物挥发物,获得虫害综合信息,结合适当的模式识别算法在农作物虫害诊断方面具有很大的应用前景。
本研究采用电子鼻检测虫害诱导棉花产生的特异性挥发物(Herbivore-Induced Plant Volatiles, HIPVs),采用PCA、聚类分析、径向基函数神经网络(Radial Basis Function Neural Network, RBFNN)对电子鼻传感器响应数据进行处理,研究电子鼻检测花龄期棉花虫害的可行性,为解决农作物田间虫害诊断难题提供理论和技术支持。
1 材料与方法
1.1 试验材料
试验棉花:棉花种子由浙江大学农学院提供,棉花品种为冀棉14号,种子经过人工精心粒选,于5月上旬播种,播种前要晒种3~4 d,种子播于装有泥土和营养土质量比为1∶1的花盆中24 cm(直径)×19 cm(盆高)每盆一株,棉花栽培于室外自然条件,定期进行水、肥管理,与7月中旬进行打顶处理,打顶后的株高控制在65~72 cm,棉花种植约12周至棉花长出棉铃时用于试验。
试验昆虫:棉花虫害试验昆虫采用3龄的棉铃虫,棉铃虫成虫购于淘宝科云生物。棉铃虫在试验前正常饲养,饲养条件始终保持在温度(27±1)℃,湿度为80%~90%,光周期为14 h/10 h(光照/黑暗),适当光强。饲养环境要经常通风,以保持空气新鲜、清洁,同时对温度、湿度的变化保持密切关注,并及时调整,使其有利于棉铃虫的正常生长、发育和繁殖。在进行虫害试验时,各项操作都应无菌进行,棉铃虫用具都经过灭菌或消毒后再使用,在无菌条件下接虫,避免对试验准确度产生影响。
1.2 棉花挥发物的电子鼻检测
研究棉花生长期受到虫害后挥发物的变化,首先要了解棉花自然生长释放挥发物的变化规律,所以试验考虑时间和害虫数量2个变化因素对棉花挥发物的影响,试验时间持续48 h,害虫数量按每盆棉花苗接棉铃虫0、1、2、3条来设计。
根据害虫数量不同将棉花样本分为4个试验处理,按每盆棉花苗接虫0、1、2、3条数目不同标记为0-P、1-P、2-P、3-P,其中0-P是健康棉花作为对照组。挑选高度、长势一致的花铃期棉花苗用于试验,每组试验处理20盆,共80盆,试验条件保持温度为(28±3)℃、湿度为60%~80%的环境下进行。害虫选择3龄棉铃虫120条,饥饿24 h,将棉铃虫用工具按照虫数放至棉花的棉铃处,之后采用纱网将其罩住,在电子鼻试验前将花盆用保鲜袋套住,保鲜袋底部扎紧。电子鼻棉花挥发物检测采用静态顶空法,在每次电子鼻检测时间节点前约30 min将棉花苗用保鲜袋罩住并静置到电子鼻检测,电子鼻在试验前应该提前1 h预热。正式试验于8:00开始,健康棉花0-P进行电子鼻试验,每盆棉花苗测试一次,记为0 h。同时对1-P、2-P、3-P进行接虫处理,待棉铃虫取食6 h进行电子鼻检测试验,其后每间隔6 h进行重复试验,持续48 h总计进行8次重复试验,分别记为6、12、18、24、30、36、42和48 h。
电子鼻是德国AIRSENSE公司的PEN3便携式电子鼻。电子鼻传感器响应信号是传感器接触到棉花挥发物后的电导率与传感器经过标准活性碳过滤气体的电导率的比值,电子鼻挥发物响应是一组无量纲数据。棉花挥发物检测时根据响应曲线达到稳定的时间确定采样时间设置为90 s,清洗时间设置为60 s,采用清洁氮气作为清洗气体。
1.3 模式识别
1.3.1主成分分析(PCA)和区分度分析
PCA是电子鼻研究中最常用的数据处理方法,通过PCA可以提取电子鼻多维数据最有价值的信息,找出数据变化的主方向和次方向,并能通过图像直观反映数据的变化趋势。本研究采用AIRSENSE电子鼻配套的软件进行PCA分析,同时导出经PCA分析得到各处理的数据区分度值。
1.3.2 聚类分析
以电子鼻不同时间棉花虫害样本数据出发,自动进行分类。现在的统计聚类分析方法有很多,包括系统聚类、-均值聚类、动态聚类法、有序样品聚类、模糊聚类等。本研究采用SPSS软件的系统聚类法对不同虫害数量棉花处理(0-P、1-P、2-P、3-P)进行聚类,对不同虫害数量棉花处理电子鼻响应信号进行PCA分析,提取前5个主成分的平均值作为聚类分析数据。
1.3.3 径向基函数神经网络(RBFNN)
RBFNN的拓扑结构是一种3层前向网络,包括输入层、隐层、输出层。其具有自学习、自组织、自适应功能,对非线性连续函数具有一致逼近性,具有最佳逼近及克服局部极小值问题的性能,学习速度快,可以并行高速地处理数据。本研究采用MATLAB2016b软件对不同虫害数量棉花处理进行RBFNN分析,采用电子鼻传感器响应信号85 s 的稳定值作为RBFNN的输入,以4组不同虫害数量作为输出,则输入层单元数为10,输出层单元数为4,核函数为高斯函数,径向基层的分布密度采用默认值1。
2 结果和讨论
2.1 虫害棉花处理的电子鼻信号主成分分析(PCA)
由于棉花生长过程中释放的挥发物会随着昼夜节律而发生变化,所以对4组不同害虫数量棉花样本进行持续48 h的电子鼻检测,每次检测间隔6 h,4组不同虫害处理棉花样本电子鼻检测的主成分分析如图1所示。
图1a为未遭受虫害的健康棉花,是与虫害棉花处理的对照组,其中第一主成分的分析值为82.7%,第二主成分的分析值为15.3%,二者之和已达85%以上,表明PCA第一主成分、第二主成分的结果可以代表电子鼻响应信号对棉花挥发物的区分情况。由图1a可知,在持续48 h的8个不同检测时间段的棉花样本均有重叠的现象,在整个48 h时间段棉花样本在二维PCA图中分布并没有规律明显的变化趋势,但可以观察出24和48 h的棉花样本重叠严重,6和30 h的棉花样本重叠严重,18和42 h的棉花样本重叠严重。表1为健康棉花0-P处理对9个不同检测时间的区分度值,其中区分度值代表2个不同分类间的差异性,值越小代表2个分类间的差异性越小,反之值越大代表2个分类间的相似性越小差异性越大。由表1可知,0与24、48 h的区分度值很小,6与30 h的区分度值很小,18与12、42 h的区分度值很小。24和48 h棉花样本的PCA分析显示严重重叠并且区分度值很小,说明24和48 h棉花样品释放的挥发物相近,同时也可以看出6和30 h的挥发物相近,18和42 h的挥发物相近。
健康棉花对照组的PCA和区分度分析结果表明,在持续48 h电子鼻检测时间内每天的同一时段健康棉花释放的挥发物很相近,说明健康棉花释放的挥发物具有明显的节律性。目前有研究表明植物可以通过合成次生代谢化合物与周围环境进行相互作用,这些化合物具有较小的分子量、较高的蒸汽压,能够自由的穿过细胞膜释放到大气或者土壤中[14]。植物挥发物的释放并不是连续的过程,而是遵循一个与明暗循环有关的生理周期[15]。但是多年来,对采集的植物挥发性化合物进行分析一直采用GC-MS,由于GC-MS仪器移动性差,样品分析耗时较长,无法实现田间植物挥发物实时监测,本研究采用电子鼻对棉花挥发物进行快速检测,采用适当的数据处理方法可以得到与许多植物挥发物方面研究者相似的结论。
图1b、1c、1d分别是虫害棉花1-P、2-P和3-P处理的8个不同时间的PCA图,1-P处理的第一和第二主成分的分析值为88.31%和7.52%,2-P处理的第一和第二主成分的分析值为76.43%和14.99%,3-P处理的第一和第二主成分的分析值为86.1%和9.69%,3个虫害处理的前2个主成分值之和均在91%以上,说明PCA分析结果可以代表电子鼻响应信号对虫害棉花挥发物的区分情况。从虫害棉花样本的分布来看,在持续48 h的8个不同检测时间段的虫害棉花样本均出现大量重叠,但大致可以看出虫害棉花样本具有沿第一和第二主成分变化的规律,对比图1a的健康棉花对照组,3个虫害棉花处理的分布规律明显与健康棉花对照组不同,这可能是由于虫害导致棉花产生特异性挥发物在分类中起主要作用。表2是虫害棉花1-P处理的8个不同检测时间的区分度值对照表,由于3个虫害棉花处理类似,所以仅以1-P虫害棉花处理的区分度值进行分析。从表2中可以看出每个检测时间必然与其中一个相邻的检测时间区分度值很小,如6和12 h的区分度值为0.04,18和12 h的区分度值为0.13,24和30 h的区分度值为0.19,36和42 h的区分度值为0.35,42和48 h的区分度值为0.04。这表明棉花受到虫害以后挥发物的释放是一个持续的过程,但也存在相邻的检测时间区分度值变大的情况,如30和36 h的区分度值为0.80,这种情况或许可以从以前学者植物虫害的研究成果来解释,植物遭受虫害后会产生特异性挥发物,但是挥发物的持续释放也有一个昼夜循环节律,所以从PCA的结果来看,其分布规律和区分度值既表现出连续性特征又表现出间续的差异性特征。
植物虫害许多的研究结果都表明,当植物受到害虫为害时,植物的营养器官释放大量的挥发物进行防御,其种类和数量比取食前显著增多。Pare等[16]于1997年研究发现棉花挥发物主要由叶片所释放,棉花受棉铃虫幼虫轻度危害后,地上部分挥发物的释放速率明显增加,且与健康的棉花差异显著。虫害诱导释放的植物挥发物受多种因素的影响,与害虫龄期,害虫口器类型,害虫活动时间等有关,并且挥发物的释放机理非常复杂,但可以发现虫害诱导的植物挥发物具有明显的白天释放量高而晚上释放量低的昼夜释放节律性,大多数植物被害虫为害后白天释放的挥发物高于晚间释放的挥发物,比如棉花、杨树[17-18]。而且虫害诱导植物挥发物的释放滞后于害虫的取食,这是因为参与虫害诱导挥发物合成的基因需要害虫取食诱导才能表达[19-20]。由于虫害诱导棉花产生的挥发物机理非常复杂,使用棉花虫害电子鼻检测数据的PCA结果只能近似的反映虫害对棉花挥发物释放的影响,所以需要对棉花虫害电子鼻数据进行进一步分析。
2.2 虫害棉花处理的聚类分析
由于不同时间4组棉花样本的PCA结果只能部分反映棉花挥发物变化的规律,虫害使棉花产生特异性挥发物仅从PCA结果还不能完全解释清楚,所以在未知分类的情况下对4组不同测试时间棉花进行聚类分析,图2为4组虫害试验棉花6、12、18、24、30、36、42、48 h的聚类分析图,其结果显示采用系统聚类法不同时间的4组棉花最终均分成2类,其中健康棉花对照组(0-P)分为一类,而虫害棉花1-P、2-P和3-P处理分为一类,聚类结果表明健康棉花与虫害棉花差异性明显,可以进一步解释虫害对棉花产生特异性挥发物的影响,当棉花被害虫取食后,挥发物的组成成分发生明显变化,并且释放量大量增加,与健康棉花的挥发物差异性显著[21]。
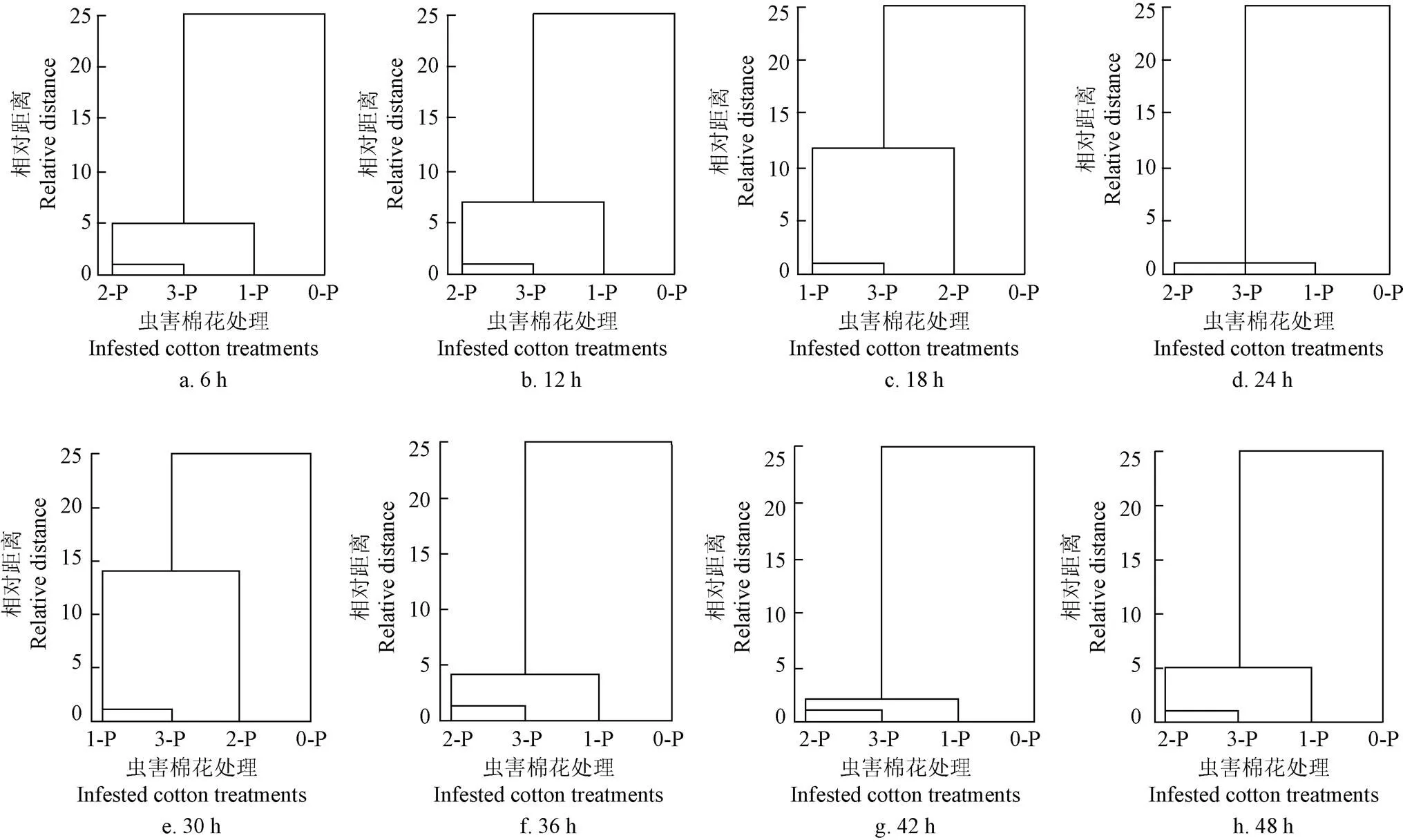
图2 4组虫害棉花处理不同时间的聚类分析
2.3 受害程度的径向基函数神经网络(RBFNN)预测
由于棉花释放的挥发物具有昼夜节律性,所以先对4组棉花样本在8个不同检测时间分别进行RBFNN分析,1个检测时间的每组处理样本为20个,在每组处理中随机选取12个棉花样本的电子鼻检测响应信号的稳定值作为训练用,其余8个棉花样本作预测检验用。这样在每个检测时间训练集有48个棉花样本,测试集有32个棉花样本。
不同检测时间4组棉花的训练集回判和测试集判别的结果见表3,棉花4个虫害试验处理训练集回判正确率分别为100%、94.8%、81.3%和88.5%,训练集回判有少数样本误判,这可能由于栽培的棉花样本影响因素众多具有个体差异,而6、12、18、24、30、36、42和48 h测试集判别正确率分别为68.8%、56.3%、68.8%、84.4%、87.5%、71.9%、78.1%和78.1%,测试集判别总的正确率为73.4%。对不同检测时间4组棉花样本测试集进行统计,0-P对照组测试集判别正确率100%,1-P处理测试集判别正确率84.4%,2-P处理测试集判别正确率37.5%,3-P处理测试集判别正确率71.9%,其中2-P处理测试集出现很多误判,表明2-P处理挥发物与其他2个虫害处理相近。0-P对照组没有出现误判表明健康棉花与虫害棉花挥发物有明显的区别。
从4组棉花样本在8个不同检测时间的RBFNN分析结果可以看出,健康棉花样本可以正确的预测,训练集和测试集的正确率均为100%,不同数量虫害棉花样本预测的准确率较低,这个结果与Henderson等[22]于2010年使用电子鼻对棉花虫害的检测结果相似,采用主成分分析对于有无椿象为害的棉花进行区分可以获得优良的效果,但是对于椿象类别的区分则无法取得满意的结果。这种结果可以从虫害诱导棉花产生特异性挥发物来合理解释,虫害造成健康棉花与受害棉花释放的挥发物成分、数量均存在很大差异,所以健康棉花样本可以准确预测,但是棉花样本存在个体差异性,害虫取食棉花在侵害时间和程度上存在不确定性,所以造成虫害棉花样本预测的准确率不高。

表3 不同时间4组虫害棉花处理的径向基函数神经网络判别
注:0-P代表健康棉花对照组,1-P、2-P和3-P分别代表接棉铃虫1、2和3条的虫害棉花处理。
Note: 0-P means healthy cotton as a control treatment. 1-P, 2-P, and 3-P treatments mean the infested cotton treatments that inoculated with 1, 2, and 3 bollworm larvae, respectively.
为了使电子鼻棉花虫害检测更具有实际应用意义,对不同时间的虫害棉花需要建立统一的预测模型,建模时不考虑时间因素把虫害棉花分成4组,这样每组处理的样本为160个4组共计640个,在每组处理中随机选取96个棉花样本的电子鼻检测响应信号的稳定值作为训练用、另64个棉花样本作预测检验用。同样采用RBFNN进行分析,当同时对4组棉花样本进行建模,训练集的回判正确率仅有66.1%,说明建立的模型不稳定,0-P处理测试集判别正确率100%,1-P处理测试集判别正确率79.7%,2-P处理测试集判别正确率32.8%,3-P处理测试集判别正确率20.3%,除了0-P对照组判别的正确率较高其余各处理均有较多误判,表明该模型只能对健康棉花与受到虫害棉花进行很好的预测。
结合表3中2-P处理测试集判别正确率很低,考虑在统一模型建立过程中去除2-P虫害处理,这样3组处理共计480个,在每组处理中随机选取96个棉花样本的电子鼻检测响应信号的稳定值作为训练用、另64个棉花样本作预测检验用。对3组棉花样本进行建模,训练集的回判的正确率为87.8%,0-P处理测试集判别正确率100%,1-P处理测试集判别正确率78.1%,3-P处理测试集判别正确率82.8%,表明去除2-P虫害处理模型的稳定性有了很大的提高,不仅能对健康棉花进行准确的预测,受到虫害棉花预测的准确性也很大的提高了。这可能是由于相对于虫害对棉花挥发物的影响虫害数量对棉花挥发物的影响较小,导致遭受虫害棉花处理误判较多,同时从另一方面也可以看出模型可以作为棉花是否遭受虫害的预测。
从不考虑时间因素的4组棉花样本的RBFNN分析结果可以看出,虽然健康棉花和虫害棉花释放的挥发物均存在节律性,棉花挥发物的成分和含量会随着时间的变化而发生改变,但是2种RBFNN模型(全部虫害试验处理、去除2-P虫害处理)对健康棉花样本预测的正确率达到100%。对于不同数量虫害棉花的预测,由全部虫害试验处理建立的RBFNN模型预测的正确率低,由去除2-P虫害处理模型可以对虫害棉花样本进行较准确的预测,这种结果说明昼夜时间更替、是否遭受虫害、虫害数量都可以造成棉花释放挥发物的变化,其中是否遭受虫害在棉花挥发物变化中起到主要因素,这是健康棉花样本能够准确预测的原因。虫害数量多少一般反映植物危害情况,植物危害越严重,挥发物的挥发量越大,并且挥发物的成分也会发生改变[19],但是由于棉花样本的个体差异性以及害虫取食的不确定性,本研究中每盆棉花苗按不同处理接虫1、2和3条并不能很好的反映棉花的实际危害程度,造成虫害棉花样本预测的准确度低。
3 结 论
1)对虫害处理棉花处理电子鼻信号进行主成分分析(Principal Component Analysis, PCA),健康棉花对照组的PCA和区分度值的结果表明,健康棉花释放的挥发物具有明显的节律性。虫害棉花处理的分布规律明显与健康棉花处理不同,具有沿第一和第二主成分变化的规律,虫害诱导棉花的特异性挥发物释放是持续的,同时也有具有昼夜循环节律性,且与健康的棉花差异显著。
2)针对8个不同时间的4组棉花进行系统聚类,所有结果显示健康棉花对照组分为一类,而3组虫害棉花处理分为一类,健康棉花与虫害棉花可以明显区分。
3)对8个不同时间的4组棉花进行径向基函数神经网络(Radial Basis Function Neural Network, RBFNN)分析,测试集判别总的正确率为73.4%,健康棉花对照组测试集判别正确率100%,误判样本出现在3个虫害棉花处理之间。
4)当建模时不考虑时间因素,对全部4组棉花样本进行RBFNN建模分析,训练集的回判正确率仅有66.1%,说明建立的模型不稳定。当仅对0-P、1-P和3-P处理进行RBFNN建模分析,训练集的回判正确率为87.8%,测试集预测结果显示模型可以对健康棉花进行准确的预测,虫害棉花处理预测的准确性也很大的提高。
综合上述分析,电子鼻检测分析结果虽然对虫害程度的预测还不完全准确,但是建立的模型对健康棉花对照组的预测正确率均达到了100%,分析结果可以作为花铃期棉花是否遭受棉铃虫侵害的依据,说明电子鼻可以作为棉花虫害发生的有效监测手段,在农作物虫害监测领域具有很好实际的应用价值。
[1] 翟治芬,徐哲,周新群,等. 基于朴素贝叶斯分类器的棉花盲椿象危害等级识别[J]. 农业工程学报,2015,31(1):204-211.
Zhai Zhifen, Xu Zhe,Zhou Xinqun, et al. Recognition of hazard grade for cotton blind stinkbug based on Naive Bayesian classifier[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(1): 204-211. (in Chinese with English abstract)
[2] Njoroge A W, Mankin R W, Smith B, et al. Effects of hypoxia on acoustic activity of two stored-product pests, adult emergence, and grain quality[J]. Journal of Economic Entomology, 2019, 112(4): 1989-1996.
[3] Dean T J, Drake V A. Monitoring insect migration with radar: the ventral-aspect polarization pattern and its potential for target identification[J]. International Journal of Remote Sensing, 2005, 26(18): 3957-3974.
[4] Boissard P, Martin V, Moisan S. A cognitive vision approach to early pest detection in greenhouse crops[J]. Computers and Electronics in Agriculture, 2008, 62(2): 81-93.
[5] Brushwood D E, Han Y J. Possible NIRS screening tool for entomological sugars on raw cotton[J]. Journal of Cotton Science, 2000, 4(2): 137-140.
[6] 卢辉,韩建国,张录达,等. 高光谱遥感模型对亚洲小车蝗危害程度研究[J]. 光谱学与光谱分析,2009,29(3):745-748.
Lu Hui, Han Jianguo, Zhang Luda. Study on hyper-spectral remote sensing models for monitoring damage of(Orthoptera: Acrididae)[J]. Spectroscopy & Spectral Analysis, 2009, 29(3): 745-748. (in Chinese with English abstract)
[7] 李强,谷宇,王南飞,等. 电子鼻研究进展及在中国白酒检测的应用[J]. 工程科学学报,2017,39(4);475-486.
Li Qiang, Gu Yu, Wang Nanfei, et al. Review of electronic-nose technologies and application for Chinese liquor identification[J]. Chinese Journal of Engineering, 2017, 39(4): 475-486. (in Chinese with English abstract)
[8] Laothawornkitkul J, Moore J P, Taylor J E, et al. Discrimination of plant volatile signatures by an electronic nose: A potential technology for plant pest and disease monitoring[J]. Environmental Science & Technology, 2008, 42(22): 8433-8439.
[9] Lan Yubin, Zheng Xianzhe, Westbrook J K, et al. Identification of stink bugs using an electronic nose[J]. Journal of Bionic Engineering, 2008, 5(Supp.): 172-180.
[10] Zhou Bo, Wang Jun. Use of electronic nose technology for identifying rice infestation by[J]. Sensors and Actuators B-Chemical, 2011, 160(1): 15-21.
[11] Ghaffari R, Laothawornkitkul J, Iliescu D, et al. Plant pest and disease diagnosis using electronic nose and support vector machine approach[J]. Journal of Plant Diseases and Protection, 2012, 119(5/6): 200-207.
[12] 程绍明,王俊,王永维,等. 基于电子鼻技术的不同特征参数对番茄苗早疫病病害区分效果影响的研究[J]. 传感技术学报,2014,27(1):1-5.
Chen Shaoming, Wang Jun, Wang Yongwei, et al. Research on distinguishing tomato seedling infected with early blight disease using different characteristic parameters by electronic nose[J]. Chinese Journal of Sensors and Actuators, 2014, 27(1): 1-5. (in Chinese with English abstract)
[13] 代雨婷,周博,王俊. 电子鼻技术在棉花早期棉铃虫虫害检测中的应用[J]. 农业工程学报,2020,36(3):313-320.
Dai Yuting, Zhou Bo, Wang Jun. Application of electronic nose in detection of cotton bollworm infestation at an early stage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(3): 313-320. (in Chinese with English abstract)
[14] Dudareva N, Klempien A, Muhlemann J K, et al. Biosynthesis, function and metabolic engineering of plant volatile organic compounds[J]. New Phytologist, 2013, 198(1): 16-32.
[15] De Moraes C M, Lewis W J, Pare P W, et al. Herbivore-infested plants selectively attract parasitoids[J]. Nature, 1998, 393: 570-573.
[16] Pare P W, Tumlinson J H. De novo biosynthesis of volatiles induced by insect herbivory in cotton plants[J]. Plant Physiology, 1997, 114(4): 1161-1167.
[17] Loughrin J H, Manukian A, Heath R R, et al. Volatiles emitted by different cotton varieties damaged by feeding beet armyworm larvae[J]. Journal of Chemical Ecology, 1995, 21(8): 1217-1227.
[18] McCormick A C, Boeckler G A, Kollner T G, et al. The timing of herbivore-induced volatile emission in black poplar () and the influence of herbivore age and identity affect the value of individual volatiles as cues for herbivore enemies[J]. BMC Plant Biology, 2014, 14(1): 304-316.
[19] Degenhardt D C, Greene J K. Influence of pyrethroid pesticide formulation on volatile emissions from cotton,L. leaves[J]. Journal of Agricultural and Urban Entomology, 2012, 28(1): 8-15.
[20] Turlings T C J, Erb M. Tritrophic interactions mediated by herbivore-induced plant volatiles: Mechanisms, ecological relevance, and application potential[J]. Annual Review of Entomology, 2018, 63(1): 433-452.
[21] Röse U S R, Tumlinson J H. Volatiles released from cotton plants in response tofeeding damage on cotton flower buds[J]. Planta, 2004, 218(5): 824-832.
[22] Henderson W G, Khalilian A, Han Y J, et al. Detecting stink bugs/damage in cotton utilizing a portable electronic nose[J]. Computers and Electronics in Agriculture, 2010, 70(1): 157-162.
Electronic nose for detection of cotton pests at the flowering stage
Zhou Bo1, Dai Yuting2, Li Chao1, Wang Jun2※
(1.,,224051,;2.310029,)
The cotton pests have the characteristics of concealment, migration, and sudden burst, and there are many influencing factors involved. The accurate diagnosis of cotton pests is a difficult problem in the agricultural field. Previous studies have demonstrated that cotton plants produce blends of volatile compounds in response to herbivores serve as cues for parasitic and predatory insects. Therefore, it is possible to obtain information about cotton pests by detecting volatile compounds in cotton. In this study, an electronic nose was used to detect the volatiles emitted by cotton plants damaged by cotton bollworm at the flowering period. The cotton samples were divided into four infested cotton treatments. According to the number of pests in each pot of cotton seedlings, the treatments inoculated with 0, 1, 2, and 3 bollworm larvae were marked as 0-P, 1-P, 2-P, and 3-P, respectively. The 0-P was healthy cotton as a control treatment. The cotton bollworm feeding lasted 48 h. During this period, the electronic nose detection tests were performed every 6 h, and a total of 8 repeated tests were performed. Appropriate pattern recognition techniques were applied to construct reliable algorithms for interpreting the acquired signal in cotton. Principal Component Analysis (PCA), discriminant function analysis, cluster analysis, and Radial Basis Function Neural Network (RBFNN) were applied to evaluate the data. The results of PCA and discrimination values of the healthy cotton treatment showed that the volatiles released by healthy cotton had obvious circadian rhythm. For the three infested cotton treatments, whereas the distribution patterns of cotton samples were different from that of the healthy cotton treatment. The three infested cotton treatments had regular distribution trends that cotton samples changed along the direction of the first and second principal components. Cluster analysis results showed that the four cotton treatments were all finally divided into two categories, the healthy cotton treatment, and the three infested cotton treatments. All these results suggested that there was a significant difference between healthy and damaged cotton samples. Then RBFNN was used to analyze four treatments of cotton samples at 8 different times. The results showed that the total correct rate of the test sets was 73.4%, the correct rate of the healthy cotton treatment was 100%, and the misjudgment samples appeared among the three infested cotton treatments. Moreover, two unified consecutive prediction models were established regardless of the time factor. The RBFNN model was established by using four treatments of cotton samples. The correct rate of the training sets was 66.1%, and the correct rates of the test sets were 100 %, 79.7 %, 32.8 %, and 20.3 % for the 0-P, 1-P, 2-P, and 3-P treatments, respectively. In another RBFNN model based on 0-P, 1-P, and 3-P treatments, the correct rate of the training sets was 87.8%, and the correct rates of the test sets were 100 %, 78.1%, and 82.8% for the 0-P, 1-P, and 3-P treatments, respectively. Comparing the results of the two RBFNN models, the prediction accuracy of the second model had been greatly improved. At the same time, it was also found that the prediction accuracy of all RBFNN models for healthy cotton treatment reached 100%. Therefore, the electronic nose could be used as an effective monitoring method for the occurrence of cotton bollworm in the cotton plants. It should have a potential application for crop pest monitoring in the field.
electronic nose; neural network; prediction; cotton; cotton bollworm; pattern recognition
周博,代雨婷,李超,等. 花龄期棉花虫害的电子鼻检测[J]. 农业工程学报,2020,36(21):194-200.doi:10.11975/j.issn.1002-6819.2020.21.023 http://www.tcsae.org
Zhou Bo, Dai Yuting, Li Chao, et al. Electronic nose for detection of cotton pests at the flowering stage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(21): 194-200. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.21.023 http://www.tcsae.org
2020-05-06
2020-08-18
国家自然科学基金资助项目(31671583)
周博,博士,副教授,主要从事电子鼻技术在农业检测中的应用研究。Email:zjzhobo@163.com
王俊,博士,教授,主要从事电子鼻、电子舌技术开发及其智能检测应用研究。Email:jwang@zju.edu.cn
10.11975/j.issn.1002-6819.2020.21.023
S224.3
A
1002-6819(2020)-21-0194-07

