脱氧雪腐镰刀菌烯醇导致厌食和呕吐的机制研究进展
张馨培,范瑞祺,2,罗荪琳,陈义强,2*
(1.中国农业大学动物科学技术学院,北京 100193;2.动物营养学国家重点实验室,北京 100193)
脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)是一种由镰刀菌属真菌产生的单端孢霉烯族化合物,因可引起猪的呕吐反应也被称为呕吐毒素。DON 化学性质稳定,广泛存在于玉米、小麦、大麦等谷物及其加工产品中[1]。
厌食和呕吐是生物体摄入DON 后出现的典型中毒症状,当DON 的短期摄入量超过一定限度时,机体则会出现更为极端的呕吐反应。采食含有20 mg/kg DON 污染的饲料能引发猪的呕吐反应[2];经腹腔注射0.25 mg/kg DON 能够诱导水貂出现呕吐[3]。摄入低剂量DON 会降低机体采食量及诱发厌食症,而摄入高剂量DON 则会引起呕吐[4]。DON 在饲料及原料中的普遍存在不仅会限制饲料产业及畜禽养殖业的发展,含DON 的畜产品也会对人类产生健康风险[5]。
尽管DON 引起厌食和呕吐的具体机制仍待明确,但主要可归因于中枢神经系统的神经反射和内分泌调节作用以及胃肠道食欲调节因子的间接作用,2 种系统又可通过肠-脑轴相互交联,构成网络;此外,DON 对细胞因子及肠道微生物的影响也可能在一定程度上诱发厌食和呕吐[5-6]。本文综述了DON 导致厌食和呕吐症状的可能机制,为进一步探究DON 的毒性作用机理和指导生产提供参考。
1 肠内分泌细胞与肠-脑轴在DON 诱导厌食和呕吐毒性效应中的作用
1.1 肠内分泌细胞与肠-脑轴概述 肠-脑轴是由肠神经系统及中枢神经系统共同构成的神经网络[7]。肠道内分泌细胞分泌的脑肠肽识别相应受体后转化为神经信号,经迷走神经传递至中枢神经系统,从而使机体做出相应的应答反应。这当中便涉及食欲和摄食行为的改变[8]。因此,肠-脑轴在DON 介导的厌食和呕吐反应中发挥着重要作用(图1A)。
肠内分泌细胞(Enteroendocrine Cells,EECs)散在分布于胃肠道黏膜的上皮组织,是毒素进入肠道后的重要靶点。肠内分泌细胞最重要的功能是感知肠腔的营养物质,并通过分泌一系列肽和胺类激素诱导机体做出相应的反应[9]。这些激素控制着不同的消化和生理功能,也参与了调节食欲和饱腹感[10]。
研究人员利用STC-1(小鼠小肠内分泌细胞)细胞,体外试验证明了DON 可通过激活钙敏感受体(Calcium Sensing Receptor,CaSR)及瞬时受体电位A1 通道(Transient Receptor Potential Cation Channel,Subfamily A,Member 1,TRPA1)来驱动Ca2+介导的激素分泌[11]。进一步的体内研究更是印证了该通路在诱导生成肽YY(Peptide YY,PYY)、胆囊收缩素(Cholecystokinin,CCK)、5-羟色胺(5-hydroxy tryptamine,5-HT)中的作用[12-13]。释放的不同信号分子随后通过迷走神经介导或经由血液循环将肠道内信号传递至中枢神经系统,并最终引发厌食和呕吐反应。涉及的脑肠肽包括PYY、CCK、5-HT、胰高血糖素样肽-1(Glucagon-like peptide 1,GLP-1)和抑胃肽(Gastric inhibitory peptide,GIP)(图1D)。
1.2 肠内分泌细胞产生的脑肠肽在DON 诱导厌食、呕吐反应中的作用
1.2.1 PYY PYY 又名酪酪肽,是一种由回肠远端和结肠L 细胞释放出的肠道激素。多项研究均证明PYY 在介导DON 诱发厌食和呕吐反应中的重要作用。经口摄入的DON 可通过激活L 细胞上的钙敏感受体及瞬态电压感受电位锚定蛋白从而介导PYY 的分泌[12-13]。释放入血后,分泌型PYY 又可被体内广泛存在的二肽基肽酶-4 转化为循环型PYY3-36[14]。
外周PYY 含量升高可能与DON 诱导的厌食反应有关。Li 等[15]在口服暴露DON 的仔猪中观察到,PYY 与DON 暴露呈时间和剂量依赖关系。Flannery 等[16]报道,经口或腹腔注射DON 均可观察到小鼠血浆中PYY 浓度升高,并伴有采食量下降;进一步,他们使用神经肽Y2(Neuropeptide Y2,NPY2)受体拮抗剂BIIE0246 进行的实验也反向证明了PYY 通过与神经肽Y2 受体结合从而介导了DON 诱导的厌食症。另一方面,研究已证实外周注射PYY3-36可降低实验动物和人类志愿者的摄食量[17]。
PYY 参与脑内厌食和食欲信号分子的调节,促进下丘脑厌食激素的表达及抑制胰腺的分泌。Batterham等[18]发现,PYY 对这种位于大脑和迷走神经上的神经肽Y2 受体具有很强的亲和力。鉴于PYY 受体在大脑和迷走神经上均有存在,因此PYY 信号的传递不仅依赖于迷走神经,也可直接经由血液循环穿过血脑屏障作用于中枢神经系统。在到达中枢神经后,PYY3-36可分别与下丘脑的神经肽Y(NPY)神经元、阿片-促黑素细胞皮质素原(Proopiomelanocortin,POMC)神经元上的Y2 受体特异性结合,抑制NPY 的释放并激活阿片-促黑素细胞皮质素原,从而降低食欲,减少饮食的摄入[17,19](图1B)。此外,DON 还可以直接诱导阿片-促黑素细胞皮质素原作用,进而产生饱腹感[20]。而在啮齿动物上,PYY3-36可以激活中枢神经系统不同区域的c-Fos基因,包括食欲调节中心下丘脑弓状核区和延髓最后区[21]。
在诱发呕吐反应方面,PYY 也发挥着一定作用。Wu 等[22]通过实验证明,静脉注射DON 可导致水貂出现呕吐,而在呕吐期间,血浆PYY3-36显著升高。此外,该研究还通过NPY2 受体拮抗剂JNJ-31020028 的预处理成功减轻了DON 和PYY 所引发的呕吐,说明与诱导厌食一致,PYY 同样通过识别特定部位的NPY2 受体,从而诱导呕吐的发生。Dumont 等[23]同样证明,PYY3-36可作用于传入迷走神经上的Y2 受体,经孤束核呈递信号或直接作用于延髓最后区内的受体,最终激活中枢模式发生器内的信号,诱导呕吐的发生。
1.2.2 CCK CCK 由十二指肠和空肠内的I 细胞分泌[14],作用于2 种分布于胃肠道及迷走神经的特异性受体(CCK-1R 和CCK-2R)。通过小鼠小肠内分泌细胞系(STC-1)体外模型证明,DON 可通过钙敏感受体激活磷脂酶C 和三磷酸肌醇(IP3)信号通路发挥作用(图1E),同时,瞬时受体电位离子通道M5(Transient Receptor Potential Melastatin-5 ion Channel,TRPM5)和L 型钙通道(L-type Voltage-Sensitive Ca2+Channel,L-type VSCCs)被激活,促使胞外Ca2+进入胞内,最终激活瞬时受体电位A1 通道介导的Ca2+信号通路,从而诱导CCK 的分泌[11]。此外,瞬时受体电位A1 通道的激活,更可能来源于DON 诱导的钙敏感受体激活,而不是毒素与TRP 通道直接作用的结果[17]。研究证实DON诱导的厌食与外周饱腹激素CCK 的升高有关。Li 等[15]在经口暴露DON 的仔猪中观察到CCK 与DON 暴露呈现的时间和剂量依赖关系。Wu 等[24]实验证明,小鼠血浆CCK 的升高与DON 诱导厌食反应显著相关。此外,使用CCK1 受体拮抗剂SR 27897 和CCK2 受体拮抗剂L-365260 均剂量依赖性地削弱了CCK 和DON 诱导的厌食症,进一步印证CCK 参与了DON 介导的厌食反应。
DON 通过激活I 细胞上的钙敏感受体及瞬时受体电位A1 通道介导了CCK 的分泌[12]。随后,CCK 可进一步参与脑内厌食和食欲信号分子的调节,促进下丘脑厌食激素的表达。此外,作为一个重要的“饱食中枢兴奋信号”,它能促进胆囊收缩,延缓胃排空,减少小肠蠕动,引发胃电节律失常及胃肠运动障碍从而导致厌食的发生[25]。由于外周产生的CCK 不能透过血脑屏障,因此排除了直接作用中枢系统的可能性[17],其更多会与迷走神经元末端的CCK-1R 结合,通过迷走神经投射到孤束核(NTS)和最后区(AP),由孤束核发挥调节摄食的作用,并将信号分送到下丘脑[26]。信号的传递进一步激活了下丘脑神经元中的厌食因子阿片-促黑素细胞皮质素原(POMC)及黑皮质素受体4(The Melanocortin-4 Receptor,MC4R),最终引起厌食的发生。
在诱发呕吐反应方面,CCK 也可能发挥一定作用。在人、猴子、犬以及啮齿类动物上,CCK 都可以诱导产生呕吐或类呕吐的反应[12]。此外,药理学剂量的CCK 可引起机体胃部的不适和恶心,并伴有垂体激素分泌的剂量依赖性增加。CCK 与催吐剂氯化锂在对成年雪貂脑干和前脑c-Fos 激活方面具有相似的模式,它们都可激活脑干内脏感觉区神经元c-Fos 的表达,这其中包括背侧迷走神经复合体(Dorsal Vagal Complex,DVC)神经元。而在前脑,激活的神经元普遍存在于下丘脑室旁核和视上核[27]。这可能部分反映了CCK 的诱导方式。而Wu 等[22]发现,在DON 诱导的呕吐期间,水貂血浆CCK 水平并未升高,CCK1 受体拮抗剂也不会缓解DON 引起的呕吐。这在一定程度上否定了DON通过CCK 诱导呕吐的可能性,但由于相关数据的缺乏,少数报道不足以排除CCK 介导的可能性,因此对于CCK 在DON 诱导呕吐中的作用,仍有待进一步研究。
1.2.3 GLP-1 GLP-1 由位于远端回肠和结肠的L 细胞分泌。除了常见的CCK 和PYY 外,饱腹激素GLP-1也可能参与了DON 介导的厌食和呕吐反应。研究显示,人无论胖瘦,静脉给予GLP-1 后均可出现食欲下降,且表现为剂量依赖性[28]。Jia 等[29]通过小鼠研究证实了GLP-1 在 DON 引起厌食反应中的作用。GLP-1 可与腹腔迷走传入神经上的GLP-1R 特异性结合,信号随后经脑干孤束核投射到中枢神经系统。作为小分子物质,GLP-1 可以自由通过血脑屏障,直接识别下丘脑摄食中枢上的GLP-1R,从而抑制NPY 的表达并增加阿片-促黑素细胞皮质素原的分泌,进而影响食欲[30]。此外,GLP-1 可抑制胃肠运动及胃酸的分泌,增强葡萄糖诱导的胰岛素分泌,抑制胰高血糖素的释放[31]。这些不同的作用方式共同介导了GLP-1 引起的机体摄食行为改变。然而,由于缺乏GLP-1 介导DON 引发呕吐反应的直接证据,因此无法断定其在诱导呕吐反应中的参与程度。GLP-1 具有降低血糖和控制体重的临床意义,因此许多的GLP-1 受体激动剂在临床中得到应用。在这个过程中发现,GLP-1 受体激动剂可诱导恶心、呕吐及其他胃肠道副作用的发生[32]。这在另一方面间接说明了GLP-1 诱发呕吐的可能性,但更为明确的作用机理仍待探究。
1.2.4 GIP GIP 由位于十二指肠和空肠的K 细胞生成,具有抑制胃酸分泌、葡萄糖浓度依赖性促胰岛素分泌的作用[33]。研究表明,DON 暴露诱导的GIP 释放也可能参与了摄食行为的改变。Jia 等[29]使用小鼠模型证实了GIP 在DON 介导厌食反应中的作用。此外,GIP 受体拮抗剂Pro3GIP 的使用可显著抑制外源性GIP 或DON诱导的厌食症的发生。这表明分泌的GIP 可与迷走神经或下丘脑上的GIPR 特异性结合,从而进一步介导了反应的发生。然而Flannery 等[34]使用相同的小鼠模型却没有发现血浆GIP 与DON 诱导厌食之间的联系。目前并未证实GIP 与呕吐反应间的关联。这些GIP 对饮食摄入影响方面的矛盾性报道以及有关GIP 确切作用机制的模糊都反映出该领域知识内容的欠缺,仍需要更多的实验作进一步探究。
1.2.5 5-HT 5-HT 又名血清素,是一种广泛存在于胃肠道和中枢神经系统中的神经递质。体内大约90%的5-HT是在肠内分泌细胞中的肠嗜铬细胞(Enterochromaffin Cell,EC)内合成分泌的[36]。来自食物的刺激可激活肠嗜铬细胞上的相应受体(钙敏感受体),随后通过激活瞬时受体电位A1 通道触发电压门控Ca2+通道激活,使5-HT 得以释放[11,36]。由于外周系统中的5-HT 不能通过血脑屏障直接作用于中枢神经,因此其作用方式为经旁分泌激活带有5HT3R 受体的腹部迷走神经,从而将信息间接传递到中枢神经系统[37]。
5-HT 具有诱发生物体出现厌食症状的潜质。腹腔注射5-HT 可引起大鼠[38]、小鼠[39]出现显著的厌食反应。涉及的作用途径为5-HT 与迷走神经元末端的受体特异性识别,经肠-脑轴发出饱腹信号,从而升高下丘脑神经元中阿片-促黑素细胞皮质素原和可卡因-安非他明转录调节肽(Cocaine-Amphetamine-Regulated Transcript,CART)的表达[22],最终得以介导食欲的调节。
也有研究显示,灌胃或静脉注射DON 不会对仔猪血浆的5-HT、5HIAA 和色氨酸(Tryptophan,TRP)水平产生影响[39],即在DON 作用下,外周5-HT 参与机体调节的能力存疑。目前,仍缺少研究证明胃肠道中5-HT 的分泌是否参与了DON 诱导的厌食反应。但Sheng 等[37]关于5-HT 介导的T-2 毒素引发厌食反应的研究,考虑到T-2 毒素与DON 同属于单端孢霉烯族化合物,因此不排除5-HT 参与DON 作用的可能性。
相较而言,5-HT 在DON 诱导呕吐方面的作用更大。Wu 等[22]报道,在DON 诱导的呕吐期间,水貂血浆5-HT 水平显著升高;而另一方面,5-HT3受体拮抗剂也可以完全抑制DON 和5-HT 诱导的呕吐。这些结果从正反两个方面证实了5-HT 在DON 诱导的呕吐中所起到的促进作用。利用水貂模型,研究人员进一步证明了DON 是通过激活钙敏感受体及瞬时受体电位A1通道,从而介导了5-HT 的分泌[13],产生的5-HT 随后作用于迷走神经元末端的5-HT3R 受体,并进一步传导至呕吐中枢,最终诱导呕吐的发生[22]。
1.3 肠道微生物在DON 诱导厌食反应中的作用 一些肠道中的微生物可通过酶解作用将DON 降解成为无毒性的DOM-1[40],从而减轻其对机体造成的危害。然而,两者的作用是相互的,DON 也同样会引发肠道微生物群的紊乱,进而影响机体的摄食行为。Wang 等[41]在断奶仔猪上试验发现部分由DON 引起的肠道微生物变化可能与厌食症的产生有关。这表明,由DON 引发的肠道菌群改变可能在一定程度上介导了厌食反应的发生。徐翰南等[42]研究表明,肠道菌群及其代谢产物会对肠内分泌细胞分泌脑肠肽的过程产生影响。在肠道菌群影响脑肠肽分泌的过程中,肠道菌群主要通过影响短链脂肪酸(SCFAs)组成来介导不同脑肠肽的分泌。通过识别G-蛋白耦合受体41(GPR41)和G-蛋白耦合受体43(GPR43)这两种在人或动物上皮黏膜细胞和内分泌细胞上的受体蛋白,短链脂肪酸可影响肠嗜铬细胞5-HT的生成[43]、介导L 细胞PYY[44]及GLP-1[45]的分泌,从而进一步影响机体的摄食行为。除了影响外周信号分子的分泌外,肠道产生的SCFAs 能通过血脑屏障直接作用于大脑组织[46]。Frost 等[47]研究表明,灌注的乙酸通过血脑屏障进入脑组织,影响小鼠的摄食中枢神经,进而调控摄食行为,这在一定程度上也肯定了SCFAs直接作用于中枢神经系统的合理性。因此,DON 可能通过影响消化道中肠道微生物菌群的组成,间接参与外周及中枢神经系统有关摄食行为的调控。
1.3 细胞因子在DON 诱导厌食反应中的作用 细胞因子(Cytokine,CK)是一类能在细胞间传递信息、具有免疫调节和效应功能的蛋白质或小分子多肽。大多数细胞因子是机体免疫应答的产物,对机体免疫系统具有强大的调节功能,但其分泌异常时亦可引起病理反应[48]。
另外,白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)等在内的促炎性细胞因子能够引发拒食、饮食紊乱及神经性厌食症[3]。其诱发机理主要是通过直接或间接作用于下丘脑的食欲调节中枢,进而调控食物的摄入。DON 可以影响这些细胞因子的水平。Bracarense 等[49]试验证明,DON 能刺激猪空肠和回肠中促炎性细胞因子(TNF-α、IL-1β、IFN-γ和IL-6)的表达。柳芹[50]证明了DON 能在mRNA 水平激活JAK/STAT 通路,而该通路参与调控炎性细胞因子IL6、IL-1β和TNF-α相关基因的表达。值得注意的是,张婷等[51]通过试验发现,日粮中添加2 mg/kg 或4 mg/kg 的DON 可使雄鼠血浆中白细胞介素-4(IL-4)、白细胞介素-6(IL-6)和肿瘤坏死因子-β(TNF-β)含量显著上升,而DON 含量增加到 8 mg/kg 时,雄鼠血浆中的白细胞介素-2(IL-2)、IL-4、IL-6、IFN-γ和TNF-β含量显著下降。这可能解释了许多看似与本文观点相矛盾的报道,即DON 显著降低了一些细胞因子的水平。由此来看,低剂量DON 会在作用初期诱导细胞因子的产生,通过不同途径最终介导厌食的发生,这也符合低剂量诱导厌食反应的事实。而当DON 摄入剂量超过一定范围时,其对机体免疫系统的破坏,最终导致了细胞因子水平的下降。因此综合来看,细胞因子的诱导同样是DON 引起厌食的一个潜在因素。
2 中枢神经系统在DON 诱导厌食和呕吐毒性效应中的作用
除了通过肠-脑轴的间接作用,部分摄入的DON可经血液循环通过血脑屏障直接作用于特定的脑区,涉及脑干、下丘脑、边缘系统及大脑皮层边缘结构[53]。一方面,DON 能够直接诱发中枢神经系统对其做出一系列的生理反应;另一方面,其可触发特定脑区的神经元释放中枢脑肠肽,介导机体相应反应的发生。在这些过程中,不同区域的激活相互联系和影响,最终使机体表现出厌食和呕吐症状(图1-C)。
2.1 DON 可能通过影响下丘脑而调节食欲 食欲的生理调节机制十分复杂,外周及中枢神经内分泌系统共同构成了一个协同合作、相互影响的“食欲调节网络”(Appetite Regulation Network,ARN)[17]。在 肠-脑轴的间接作用中,DON 诱导分泌的脑肠肽一部分经迷走神经投射到孤束核,发挥调节摄食的作用,或将内脏冲动分送至下丘脑;另一部分经血液循环穿过血脑屏障识别神经中枢上的相应受体。此外,DON 还可直接作用于中枢神经。这些信号的识别和传递进一步激活了下丘脑神经元中不同的厌食因子,并最终引起厌食的发生。哺乳动物下丘脑中分布着多个控制摄食行为的神经中枢,包括“饥饿中枢”下丘脑外侧区(Lateral Hypothalamic Area,LHA)和“饱腹中枢”下丘脑腹内侧核(Ventromedial Hypothalamus,VMH)、弓状核(ARC)、室旁核(Paraventricular Nucleus,PVN)等。不同核团都可以分泌大量食欲调节因子(包括食欲促进因子和抑制因子)并合成相关受体,它们彼此之间相互联系,某个环节平衡的破坏都可能对摄食行为产生影响,并最终导致动物体重的改变。而DON 的作用可能会破坏这些平衡。
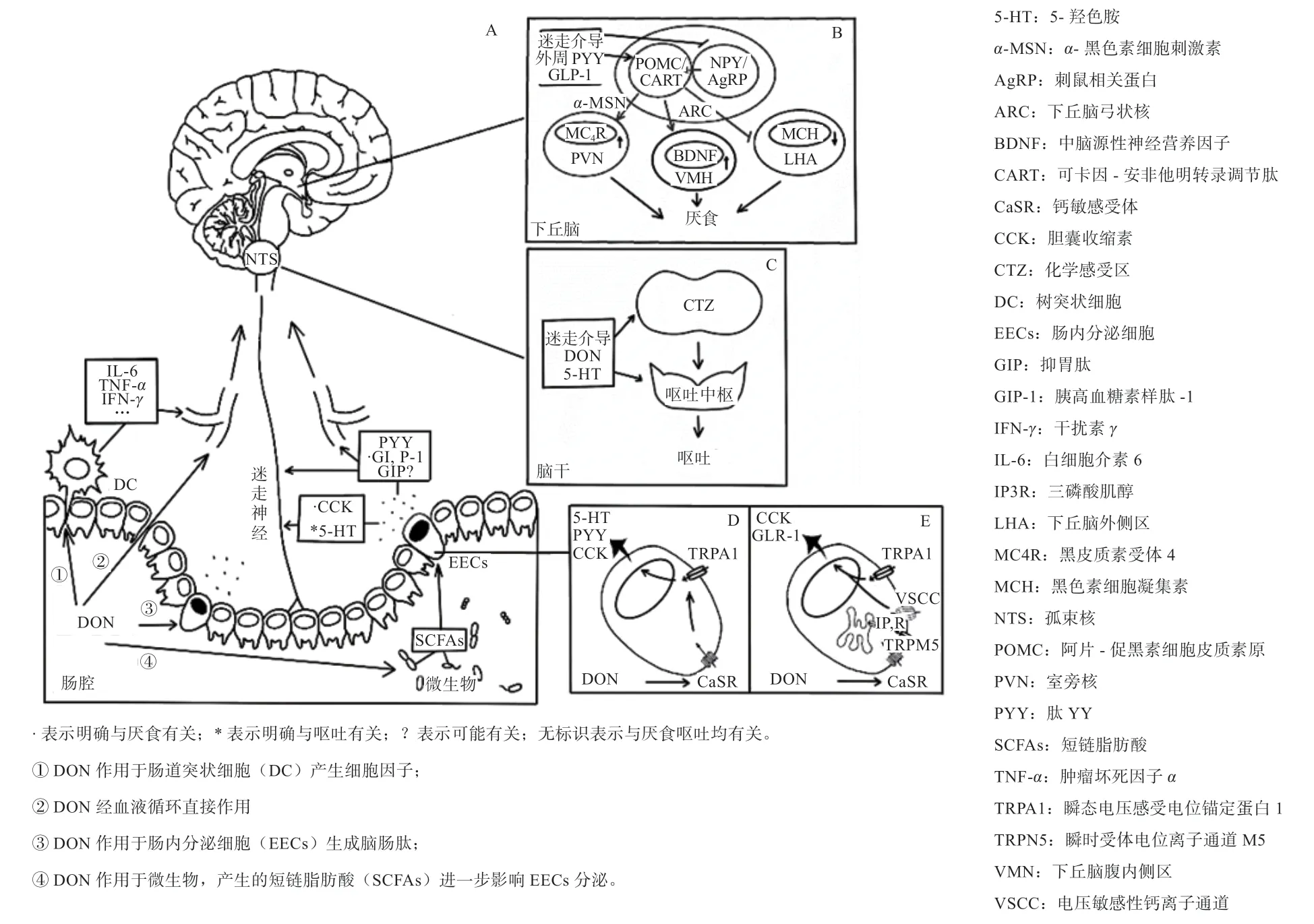
图1 DON 诱导呕吐厌食反应机理图(参考改绘自文献[10,11,52] )
下丘脑弓状核具有2 种功能相反的神经元:一种表达神经肽Y(NPY)/ 刺鼠相关蛋白(Agouti-related Protein,AgRP)刺激食欲,另一种表达阿片-促黑素细胞皮质素原(POMC)/ 可卡因-安他非明转录调节肽(CART)抑制食欲[54]。脑肠肽可直接作用于这2 种神经元,从而调节动物的摄食行为。DON 对脑肠肽的影响可能会干扰这2 种神经元的功能。
2.2 DON 可能通过影响脑干影响呕吐调节 诱发恶心呕吐的机制也同样复杂。目前认为,呕吐中枢及化学感受区(CTZ)在其中扮演着重要角色。呕吐中枢是脑干内控制呕吐的所有神经核团的总称[55],其中的最后区(AP)、孤束核(NTS)和迷走神经背核(DMNX)组成的背核迷走复合体(DVC)被认为是催吐反应的主要部位,其催吐效应与脑肠肽及其受体有关[56]。
DON 诱导内分泌细胞分泌不同的信号分子,在与腹部迷走神经传入纤维上的相应受体结合后,产生的神经冲动传至延髓及第四脑室基底部的催吐化学感受区(CTZ),并进一步传导至呕吐中枢。随后,呕吐信号通过传出神经末梢传递至膈并最终诱导呕吐反应的发生。此外,脑脊液中的DON 也可以直接刺激第四脑室后极区的化学感受器激发区,通过神经传导至呕吐中枢[57]。
5-HT 被认为是呕吐反应发生过程中的重要神经递质,鉴于DON 可升高外周[22]及中枢[58,59]神经系统中的5-HT 水平,因此其参与介导DON 诱发呕吐反应的可能性很高。然而,DON 是先经血液循环作用于呕吐中枢和化学感受区,再通过传出神经引起胃肠道中5-HT的变化,还是先通过诱导胃肠道中5-HT 的释放,再通过一系列传导途径作用于化学感受区或呕吐中枢从而引起呕吐的发生,有待进一步研究[3]。
3 小 结
DON的摄入会引起不同物种出现厌食和呕吐反应,其对于农业生产及人类健康都有着潜在的冲击和风险。目前,厌食和呕吐的产生主要可归因于DON 对中枢神经系统和胃肠道食欲因子的影响。DON 可直接作用于中枢神经系统的呕吐中枢产生呕吐反射,同时激活下丘脑神经元分泌食欲调节因子影响采食;DON 可诱导肠内分泌细胞分泌PYY、CCK、GLP-1、GIP、5-HT 等食欲调节因子从而引发厌食;同时,DON 对中枢神经系统和胃肠道分泌的影响又可通过肠-脑轴产生关联;此外,细胞因子及肠道微生物也部分参与了反应的介导。综上所述,DON 引发厌食、呕吐反应的途径是复杂且相关的。虽然部分重要的致病机理已大致探明,但不同途径在介导整个反应发生中的参与程度并不明确。同时由于不同途径彼此之间存在关联,它们之间的先后作用关系也存在疑问。因此,有关DON 诱发厌食和呕吐的机制仍需要进一步研究。

