猪脱细胞真皮基质与肿瘤坏死因子-α调控毛囊角质细胞Wnt3a/β-catenin信号通路表达的实验研究
张文文 李恭驰 邹利军 冯自波 杜 烨 胡映月 邓海波 祝友鹏 潘银根 李炳辉
(1.华中科技大学同济医学院附属梨园医院创面修复科,湖北 武汉 430077;2.华中科技大学同济医学院附属协和医院手外科,湖北 武汉 430022;3.江苏省启东市人民医院整形美容科,江苏 启东 226200)
慢性创面是一个世界性健康问题,以糖尿病性溃疡为例,因创面反复感染不愈合或者糖尿病性并发症造成截肢等严重后果,给全世界造成了巨大的经济负担[1]。皮肤损伤修复包括炎症期、组织形成期、组织重塑期,3个阶段相互关联和重叠[2],并且涉及到多种细胞因子的作用,其中肿瘤坏死因子-α(TNF-α)在早期炎症反应阶段起着重要作用。细胞外基质为组织结构提供了支持,并且通过大量信号分子来调节细胞反应,因而在伤口愈合过程中至关重要。皮肤损伤修复需要真皮层或者促进真皮层生成的结构。脱细胞真皮基质(ADM)一直被用作软组织替代品用于伤口愈合、组织修复和重建领域[3]。ADM是自体或异种皮肤去除细胞成分而得,它保留了不可溶的分子(如弹性蛋白、胶原蛋白、纤连蛋白)[4]。猪脱细胞真皮基质(pADM)为三维胶原基质,是一种常用的生物材料,具有促进创面愈合的作用[5]。毛囊是一个复杂的结构,含有能够再生表皮及皮肤附属器的干细胞[6]。Wnt信号通路在毛囊生长循环中起着十分重要的作用,是毛囊形态发生过程中的主要调控因子,Wnt3a及β-catenin是Wnt信号通路中经典的两个蛋白信号分子[7]。本研究中探讨了pADM作为一种细胞外基质,在创面愈合过程中对创面组织TNF-α蛋白表达的影响,以及二者对毛囊角质细胞中Wnt3a及β-catenin表达的影响。
1 材料与方法
1.1 实验材料 10周龄雄性C57BL/6小鼠12只,SPF级,体重20~25 g,由辽宁长生生物技术有限公司提供,分笼自由进食和饮食,适应性饲养1周。大鼠毛囊角质细胞(购自中国赛百慷生物有限公司),TNF-α(购自Peprotech公司),TNF-α抑制剂依那西普(三生国健药业有限公司生产),细胞角蛋白14(CK14)抗体、TNF-α抗体、β-catenin抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(购自Abcam公司),Wnt3a抗体(购自Affinity公司),pADM(购自江苏优创生物医学科技有限公司)。
1.2 方 法
1.2.1 小鼠慢性创面模型建立及取材 小鼠皮肤慢性创面模型的复制方法参考文献[8]的方法:在小鼠背部两侧用皮肤取样器制作直径8 mm全层皮肤缺损模型,用带有窗口的8 mm硅胶套环与创面皮缘缝合,分别使用纱布(纱布组)和pADM(pADM组)覆盖创面,观察创面愈合情况,并于第7、14、21天取从硅胶套环窗口处爬行的新生皮肤组织,采用免疫组化法检测皮肤组织中TNF-α、Wnt3a和β-catenin的蛋白表达水平。
1.2.2 免疫组化法检测创面组织TNF-α、Wnt3a和β-catenin的蛋白表达 获取的创面组织固定于4%多聚甲醛中制作石蜡切片,置于65℃烘箱中烘片2 h,脱蜡至水,用PBS洗3次,每次5 min。切片置于EDTA缓冲液中微波修复,再置于3%过氧化氢溶液中,室温下避光孵育10 min。PBS洗3次,每次5 min,甩干后5% BSA封闭20 min。加入适量兔抗鼠一抗 TNF-α(1:100)、Wnt3a(1:100)、β-catenin(1:200)覆盖组织,4 ℃过夜,PBS洗3次,每次5 min。去除PBS液,加适量相应种属辣根过氧化物酶(HRP)标记的山羊抗兔二抗(1:200),37 ℃孵育50 min,PBS洗3次,每次5 min。去除PBS液,加新鲜配制3,3′-二氨基联苯胺(DAB)溶液显色。自来水冲洗,苏木素复染,1%盐酸酒精分化(约1 s),自来水冲洗,氨水返蓝,流水冲洗;梯度乙醇(75%、90%、100%、100%,各10 min)脱水干燥,二甲苯透明,中性树胶封固。显微镜下观察,利用图像分析软件测量图片染色程度,以积分吸光度(A值)反映蛋白表达量。
1.2.3 大鼠毛囊角质细胞培养及细胞免疫荧光鉴定 大鼠毛囊角质细胞培养于iCell原代角质形成细胞培养基中,在37 ℃、5%CO2条件下恒温无菌培养,无菌超净台内制作细胞爬片,培养箱内培养6 h后用4%多聚甲醛固定30 min,PBS洗3次,每次5 min。10%山羊血清室温封闭2 h,弃封闭液,滴加适量兔抗大鼠一抗CK14,4 ℃孵育过夜。次日滴加与一抗种属对应的山羊抗兔二抗,避光室温孵育1 h,弃二抗,PBS清洗5 min,洗3次,稍甩干后滴加适量4"6-二脒基-2-苯基吲哚(DAPI)染液到爬片上,室温避光孵育15 min。PBS漂洗爬片3次,每次5 min,取出爬片滴加抗荧光淬灭封片剂于载玻片上,荧光显微镜下观察并拍照。
1.2.4 体外实验分组 取对数生长期且生长状态良好的大鼠毛囊角质细胞接种于6孔板中,接种密度为1×106个/ml。将细胞分为6组:对照组(单纯大鼠毛囊角质细胞)、pADM组(大鼠毛囊角质细胞+pADM 20 μg/ml)、TNF-α组(大鼠毛囊角质细胞+10 ng/ml TNF-α)、TNF-α抑制剂组(大鼠毛囊角质细胞+TNF-α抑制剂依那西普10 μmol/L)、TNF-α+pADM组(大鼠毛囊角质细胞+10 ng/ml TNF-α+pADM 20 μg/ml)、TNF-α 抑制剂 +pADM 组( 大鼠毛囊角质细胞+TNF-α抑制剂10 μmol/L+pADM 20 μg/ml)。各组在 37 ℃、5%CO2条件下恒温无菌培养48 h后,提取细胞总蛋白,采用Western Blot方法检测大鼠毛囊角质细胞中Wnt3a和β-catenin蛋白的表达量。
1.2.5 Western Blot检测体外大鼠毛囊角质细胞中Wnt3a和β-catenin蛋白表达 提取细胞总蛋白,适量RIPA裂解液(RIPA:PMSF=100:1)超声破碎至裂解完全。4 ℃,12 000 r/min离心20 min,取上清,BCA测定浓度后,剩余上清加入5倍上样缓冲液混匀,100 ℃水浴10 min。配电泳胶,取30 μg蛋白上样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后转至PVDF膜上,牛奶封闭2 h,洗膜后4 ℃孵育一抗过夜,次日TBST洗膜10 min,洗3次,加入与兔抗大鼠一抗种属对应的HRP标记的山羊抗兔二抗室温孵育1 h,TBST洗膜后ECL曝光显影,Image J软件测量条带灰度值进行分析。
1.2.6 统计学处理 应用SPSS 24.0 软件进行数据处理。计量资料以表示,两组间比较采用t检验,多组间的比较采用方差分析和组间两两比较配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 模型小鼠创面窗愈合情况 小鼠背部皮肤造模后第7天,pADM组与纱布组均在环形硅胶窗口处可见粉红色新生上皮组织,并随着时间延长,创面逐渐缩小,pADM组小鼠皮肤创面在第21天基本愈合,愈合速度比纱布组快,这一观察结果与我团队前期研究结果相同[8-9]。
2.2 大鼠创面修复过程中新生皮肤组织TNF-α、Wnt3a和β-catenin的蛋白表达 免疫组化结果显示,在不同时间点,pADM组创面组织中TNF-α、Wnt3a和β-catenin的表达差异均有统计学意义(FTNF-α=18.06,P=0.002 9;FWnt3a=18.26,P=0.002 8;Fβ-catenin=22.18,P=0.001 7)。两组间比较,pADM组TNF-α表达量于伤后7、14 d明显高于纱布组(P<0.01),伤后21 d则明显低于纱布组(P<0.01)。pADM组中Wnt3a在第7天表达上调且表达量最高,与纱布组比较差异有统计学意义(t7=7.297,P=0.001 9),在第14天和21天与纱布组差异无统计学意义(P<0.05)。pADM组中β-catenin在第14天和21天表达上调,在第21天表达量最高,与纱布组比较差异均有统计学意义(t14=8.633,P=0.001 0;t21=7.657,P=0.001 6),但在第7天与纱布组比较差异无统计学意义(P>0.05)。见表1。
2.3 体外实验中大鼠毛囊角质细胞鉴定 细胞在显微镜下大多呈梭型,贴壁生长,有触角。见图1(封二)。
2.4 体外实验中pADM、TNF-α对大鼠毛囊角质细胞中Wnt3a、β-catenin蛋白表达的影响 Western Blot结果显示:与对照组相比,pADM上调Wnt3a、β-catenin蛋白的表达(tWnt3a=13.43,P=0.000 2;tβ-catenin=13.43,P=0.000 2),TNF-α下调Wnt3a、β-catenin蛋 白 的 表 达(tWnt3a=6.926,P=0.002 3;tβ-catenin=6.926,P=0.002 3);TNF-α 抑 制 剂 组Wnt3a、β-catenin表 达 上 调(tWnt3a=11.20,P=0.000 4;tβ-catenin=11.20,P=0.000 4),TNF-α+pADM组表达水平上调(tWnt3a=10.31,P=0.000 5;tβ-catenin=10.31,P=0.000 5),TNF-α抑制剂+pADM组表达水平上调(tWnt3a=10.71,P=0.000 4;tβ-catenin=10.71,P=0.000 4),差异均有统计学意义。pADM组与TNF-α抑制剂组均上调Wnt3a和β-catenin的表达,两组间比较差异有统计学意义(tWnt3a=7.744,P=0.001 5;tβ-catenin=7.744,P=0.001 5),pADM组Wnt3a、β-catenin表达水平上调更高。TNF-α抑制剂组与TNF-α抑制剂+pADM组Wnt3a、β-catenin表达水平均上调,且TNF-α抑制剂+pADM组上调水平更高,两组间比较差异具有统计学意义(tWnt3a=7.629,P=0.001 6;tβ-catenin=7.629,P=0.001 6)。与TNF-α组比,TNF-α抑制剂组Wnt3a、β-catenin表达上调(tWnt3a=45.40,P〈0.000 1;tβ-catenin=45.40,P〈0.000 1),TNF-α+pADM组Wnt3a、β-catenin表达上调(tWnt3a=47.74,P〈0.000 1;tβ-catenin=47.74,P〈0.000 1),TNF-α抑制剂+pADM组Wnt3a、β-catenin表达上调(tWnt3a=13.33,P=0.000 2;tβ-catenin=13.33,P=0.000 2),差异均有统计学意义。见图2和图3。
表1 创面修复不同时间新生皮肤组织中各蛋白表达的变化
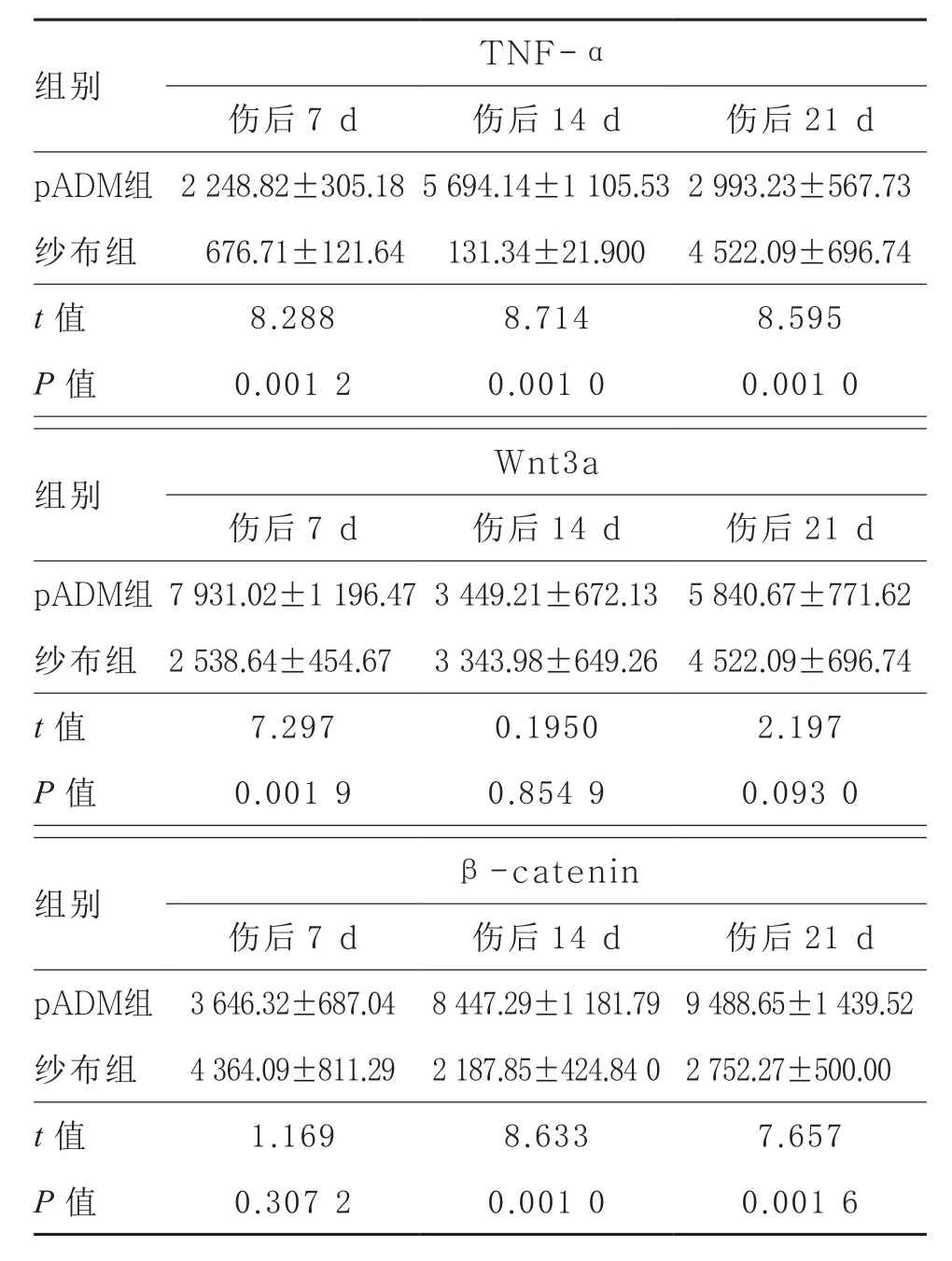
表1 创面修复不同时间新生皮肤组织中各蛋白表达的变化
组别 TNF-α伤后7 d 伤后14 d 伤后21 d pADM组 2 248.82±305.185 694.14±1 105.532 993.23±567.73纱布组 676.71±121.64 131.34±21.900 4 522.09±696.74 t值 8.288 8.714 8.595 P值 0.001 2 0.001 0 0.001 0组别 Wnt3a伤后7 d 伤后14 d 伤后21 d pADM组 7 931.02±1 196.473 449.21±672.13 5 840.67±771.62纱布组 2 538.64±454.67 3 343.98±649.26 4 522.09±696.74 t值 7.297 0.1950 2.197 P值 0.001 9 0.854 9 0.093 0组别 β-catenin伤后7 d 伤后14 d 伤后21 d pADM组 3 646.32±687.04 8 447.29±1 181.799 488.65±1 439.52纱布组 4 364.09±811.29 2 187.85±424.84 02 752.27±500.00 t值 1.169 8.633 7.657 P值 0.307 2 0.001 0 0.001 6
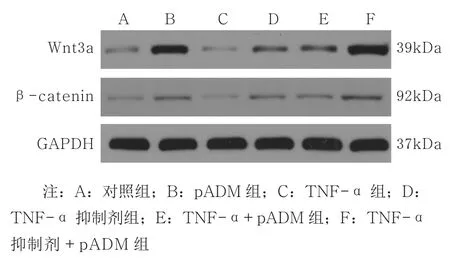
图2 Western Blot检测各组大鼠毛囊角质细胞Wnt3a和β-catenin蛋白水平的变化
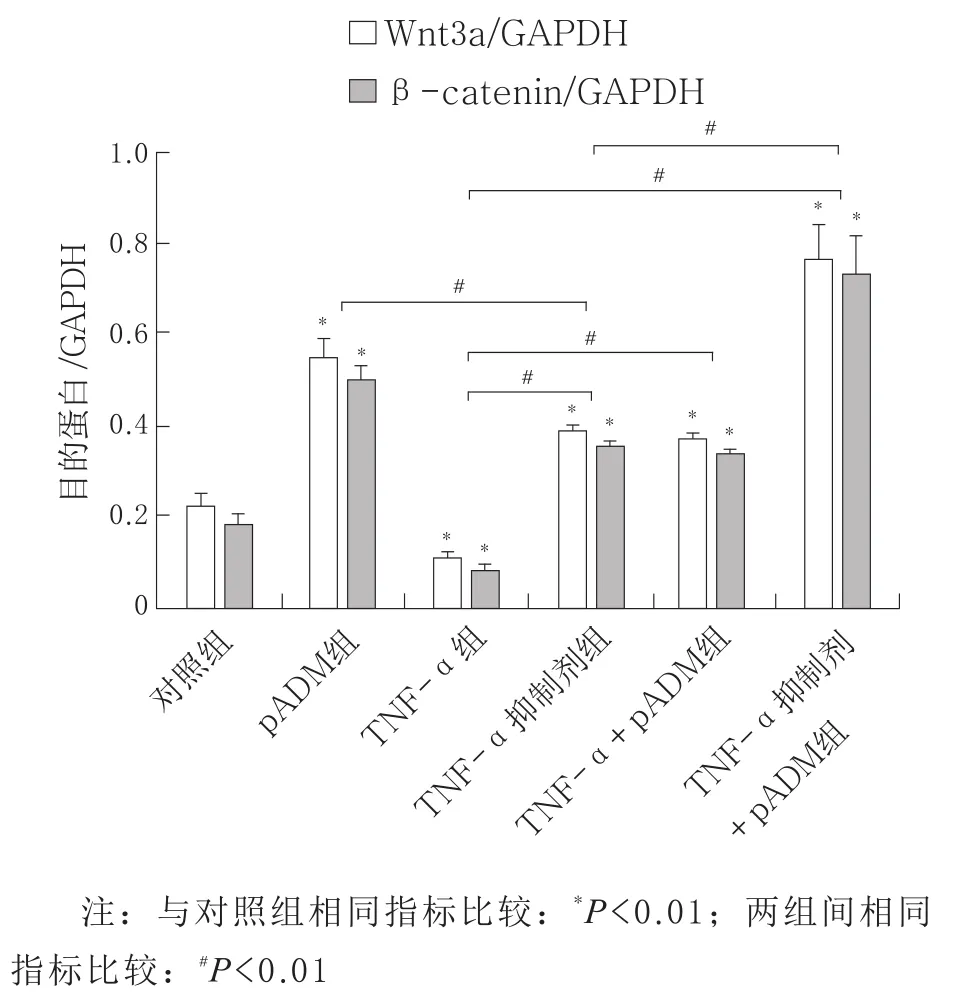
图3 各毛囊角质细胞干预组中Wnt3a和β-catenin蛋白表达水平的比较
3 讨 论
皮肤由表皮、真皮、皮下组织构成,并含有皮肤附属器官,皮肤附属器官包括毛囊和皮脂腺等。皮肤损伤时,皮肤干细胞可以再生表皮及附属物,毛囊干细胞在创面修复中亦发挥着重要作用,毛囊干细胞被证明可以动员到毛囊上部,在皮肤损伤后向伤口迁移达到表皮,分化为表皮细胞,促进再上皮化[10]。研究表明,皮肤损伤后,在早期炎症反正过程中必不可少的巨噬细胞通过分泌TNF-α激活毛囊干细胞,TNF-α的增加激活了β-catenin并增加了Wnt3a的表达[11]。有研究表明,生物材料与合成材料相比,可使创面抗炎细胞因子释放增加,细菌清除效率改善,并改善了愈合效果[6,12]。
pADM是治疗慢性创面最常用的生物材料,它起支架作用,并可能提供促进增殖、细胞附着、迁移等的信号分子[13]。本研究中pADM组比纱布组创面缩小的速度快,且pADM组在伤后第21天创面基本愈合。另外, pADM组与纱布组相比,TNF-α表达上调,在第7天Wnt3a表达上调最高,β-catenin在第14、21天表达上调并在第21天上调达到最高,但β-catenin上调的时间比Wnt3a迟了1周的具体机制有待进一步研究。
毛囊干细胞只有在创伤后才迁移到表皮[14],说明创伤是导致毛囊中干细胞迁移到表皮,从而分化为表皮细胞,促进再上皮化的重要原因[15]。TNF基因敲除和过表达均可以抑制创面毛囊新生,提示TNF-α在毛囊新生中的作用可能有更复杂的机制[10]。毛囊细胞中表达TNFR1和TNFR2两种受体,除了参与TNF-α激活毛囊以外,也可能跟参与毛囊生长周期中毛囊细胞凋亡有关系[10]。在体外实验中,与对照组相比,加入TNF-α+pADM后, Wnt3a及β-catenin表达上调,且单纯加入pADM后,上调Wnt3a及β-catenin,加入TNF-α抑制剂和pADM后,Wnt3a和β-catenin表达量最高,但是TNF-α+pADM与TNF-α抑制剂组无明显差别,表明pADM作为一种细胞外基质,可能通过调节TNF-α进而影响Wnt3a和β-catenin的表达。但本研究中体外实验显示加入TNF-α后,Wnt3a及β-catenin表达下降,与体内pADM组TNF-α上调不一致,表明体内调控机制复杂,有待进一步研究。
Wnt信号可促进细胞增殖、分化、细胞迁移和细胞黏附。本研究结果显示,pADM可以上调毛囊角质细胞中Wnt3a和β-catenin的表达,pADM作为组织工程中很重要的天然生物材料,可以通过上调TNF-α、Wnt3a、β-catenin的表达从而促进创面损伤的修复,为包括糖尿病性溃疡等慢性创面这一重要的临床问题提出潜在的临床治疗策略。

