茵陈蒿汤调控lncRNA PVT1/miRNA-30a-5p信号通路对重症急性胰腺炎大鼠模型的保护作用
项 红,胡凤林,2,陶旭锋,齐 心,2,张金楠,2,尚 东,1b,2
1 大连医科大学附属第一医院 a.中西医结合临床重点学科实验室, b.普外三科,辽宁 大连 116011;2 大连医科大学 中西医结合研究院,辽宁 大连 116044; 3 大连理工大学 化工学院,辽宁 大连 116024
重症急性胰腺炎(severe acute pancreatitis, SAP)是以胰腺局部坏死和脏器功能衰竭为主要特征的消化系统疾病,其发病率和死亡率逐年升高[1]。SAP病理研究[2-3]表明,胰蛋白酶原的过度激活导致胰腺腺泡损伤和细胞坏死在SAP的发生发展中起着至关重要的作用。细胞凋亡维持细胞膜的完整性而无炎症反应,但SAP胰腺腺泡细胞的凋亡延迟导致腺泡细胞晚期凋亡和坏死增加并释放多种炎症因子诱导炎性级联反应,促进SAP重症化演变[4]。因此,诱导受损的腺泡细胞从晚期凋亡向早期凋亡转变可能减轻SAP的严重程度。近年来,细胞凋亡与自噬的相互调控引起了广泛关注;研究[5]发现调节细胞自噬和凋亡的蛋白质网络是高度相互关联的。最新研究[6-8]表明miRNA在细胞凋亡和自噬之间的相互作用中起着重要的调控作用;长链非编码RNA(long non-coding RNA, lncRNA)可以作为一种miRNA竞争性的内源性RNA,参与生物调节过程[9]。然而,近年来关于lncRNA的研究大多集中在肿瘤上,在SAP中的作用研究还很少。茵陈蒿汤(YCHT)是由茵陈蒿、栀子和大黄组成的经典中药复方,在亚洲作为抗炎和利胆药已有数百年的历史[10]。本课题组前期通过网络药理学发现YCHT通过诱导凋亡、抗炎、抗氧化和血脂调节发挥对SAP的保护作用[11],但具体的分子机制还不明确。
1 材料和方法
1.1 材料 牛磺胆酸钠购自Solarbio (中国,北京);酶联免疫吸附检测(ELISA)试剂盒购自Lengton (中国,上海);TUNEL检测试剂盒购自美仑(中国,大连);各类抗体购自Abcam (英国,剑桥)。RNA提取试剂盒、实时荧光定理PCR试剂盒购自TIANGEN(中国,北京)。
1.2 YCHT制备 YCHT由大连医科大学第一附属医院药剂科提供,其制备经过严格的质量控制。方法如下:将茵陈蒿在10倍于其质量的蒸馏水中浸泡1 h,然后煎煮40 min,加入栀子和大黄,煮沸15 min。收集滤液后,将残渣浸泡在7倍于其质量的蒸馏水中,另外煎煮20 min。最后,将这两次滤液混合并浓缩至0.25 g/ml。茵陈蒿∶栀子∶大黄的质量比为2∶1∶1。
1.3 分组及实验模型建立方法 SD大鼠(雄性,200±20 g)购自大连医科大学实验动物中心[实验动物生产许可证编号:SCXK(辽)2018-0003;实验动物使用许可证编号:SYXK(辽)2018-0007]。将30只SD大鼠随机分为3组:假手术(Sham operation,SO)组(n=10)、SAP模型组(n=10)和YCHT (4.0 g/kg)治疗组(n=10)。根据既往方法建立实验模型[12]:大鼠禁食12 h,自由饮水,然后通过腹腔注射0.3%戊巴比妥钠(1 ml/100 g)进行麻醉,经胰胆管逆行注射5.0%牛磺胆酸钠(0.1 ml/100 g)建立SAP模型。模型建立成功后,治疗组待大鼠麻醉苏醒后每间隔6 h灌胃给予YCHT (4.0 g/kg)治疗1次。SO组仅打开腹部作为对照。造模后24 h,取腹主动脉血进行生化分析,取胰头标本固定在4%多聚甲醛中进行后续的组织病理学和免疫荧光分析;其他胰腺组织保存在-80 ℃,进行后续的实时荧光定量PCR和Western Blot等分析。
1.4 HE染色 取多聚甲醛固定后的胰腺组织进行石蜡包埋,并对切片进行苏木精和伊红(HE)染色,并在放大200倍的显微镜(Olympus BX53,日本)下进行观察。
1.5 ELISA分析 采用ELISA试剂盒检测血浆淀粉酶、TNFα和IL-1β水平。在450 nm处采用酶标仪(BioTek,美国)测量吸光度。
1.6 免疫荧光染色 胰腺切片脱蜡水合后,在4 ℃下与稀释的兔源LC-3抗体(1∶100)孵育过夜,然后在37 ℃下与TRITC结合的山羊抗兔IgG(H+L)孵育1 h,并采用DAPI (5 μg/ml)复染5 min。最后在荧光显微镜(Olympus BX63,日本)200倍的视野下观察拍照。根据LC-3蛋白的荧光强度和定位判断胰腺组织的自噬情况。
1.7 TUNEL染色 采用TUNEL检测试剂盒,按照说明书的方案进行细胞凋亡检测。将胰腺组织切片与荧光素(红色)标记的dUTP溶液在37 ℃的湿盒室中孵1 h,然后在荧光显微镜(Olympus BX63,日本)下观察拍照。荧光图像中阳性细胞(红色)的数量代表细胞凋亡。
1.8 实时荧光定量qPCR 采用总RNA提取试剂盒从细胞和胰腺组织中提取总RNA样品,并测定提取RNA的纯度,然后采用PrimeScript RT试剂盒进行反转录。最后按照试剂盒说明书,采用SYBR®Premix Ex TaqTMⅡ (TliRNaseH Plus)试剂盒进行基因的相对定量,以GAPDH和U6分别作为lncRNA PVT1和miRNA-30a-5p的内参,并计算基因的表达变化。基因引物序列见表1。

表1 引物序列
1.9 Western Blot 采用含1 mmol PMSF的预冷裂解缓冲液提取细胞和胰腺组织中的总蛋白样品,并使用BCA蛋白检测试剂盒定量蛋白浓度。采用SDS-PAGE(10%~15%)法分离蛋白质,并转移到PVDF膜上,5%脱脂牛奶封闭,采用兔LC-3、Beclin-1、XIAP、Caspase-3和NF-κB抗体(1∶1000)在4 ℃下孵育过夜,并用山羊抗兔IgG在室温下孵育2 h (1∶2000)。最后,采用增强化学发光法在凝胶成像仪下检测相应的蛋白表达。
1.10 伦理学审查 本研究方案经由大连医科大学实验动物伦理委员会审批,批号:AEE18072,符合实验室动物管理与使用准则。

2 结果
2.1 YCHT减轻SAP诱导的大鼠胰腺损伤和炎症反应
HE染色显示SO组大鼠胰腺未见明显病理损伤,而SAP模型组大鼠胰腺出现水肿、坏死、出血及炎性细胞浸润;YCHT可明显改善SAP诱导的胰腺病理损伤(图1)。与形态学变化一致,胰腺组织病理学评分也显示YCHT显著减轻SAP诱导的胰腺损伤。ELISA结果表明,SAP模型组大鼠血浆淀粉酶、以及炎症因子TNFα和IL-1β水平较SO组明显升高,而YCHT可显著降低其水平(表2)。这些结果证明YCHT能够减轻SAP诱导的大鼠胰腺损伤和炎症反应。
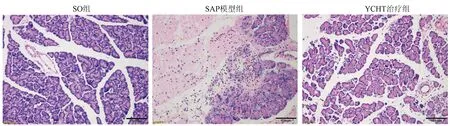
图1 YCHT对SAP大鼠胰腺病理的影响(HE染色,×200)
2.2 YCHT诱导SAP大鼠胰腺细胞凋亡 如图2所示,SAP模型组大鼠TUNEL阳性细胞(红色)数量多于SO组,并且YCHT治疗组的红色荧光进一步增强,提示YCHT可增加TUNEL阳性细胞的数量,诱导损伤胰腺细胞发生凋亡。
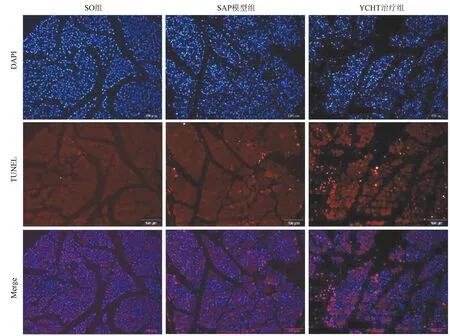
图2 SO组、SAP模型组和YCHT治疗组胰腺组织TUNEL染色(红色)典型图像(×200)
2.3 YCHT抑制SAP大鼠胰腺细胞自噬 LC-3是外源性刺激后自噬启动的一种特异性标志物。如图3所示,免疫荧光结果表明,与SO组相比,SAP大鼠胰腺组织显示更多的LC-3阳性区(红色荧光),但YCHT能够明显下调SAP诱导的LC-3蛋白表达,提示YCHT能够抑制SAP大鼠胰腺细胞自噬。
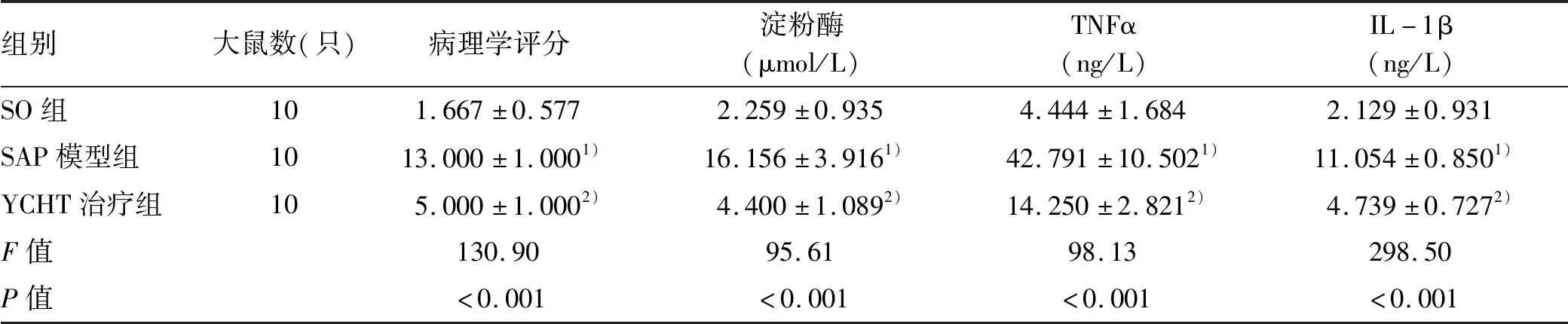
表2 各组大鼠胰腺组织病理学评分以及血浆淀粉酶、TNFα、IL-1β水平的比较
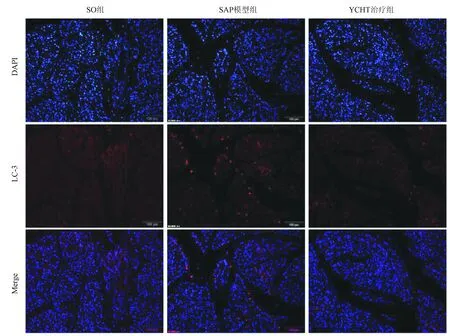
图3 SO组、SAP模型组和YCHT治疗组胰腺组织LC-3蛋白表达(红色)典型图像(×200)
2.4 YCHT调节自噬和凋亡相关蛋白的表达 与SO组相比,SAP模型组LC-3Ⅱ/LC-3Ⅰ比值及Beclin-1、X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)、Caspase-3和NF-κB蛋白表达明显上调。然而,YCHT能够显著下调LC-3Ⅱ/LC-3Ⅰ、Beclin-1、XIAP和NF-κB的表达水平,并进一步提高Caspase-3的表达水平(表3,图4),这些结果说明YCHT能够抑制细胞自噬,同时诱导细胞发生凋亡。
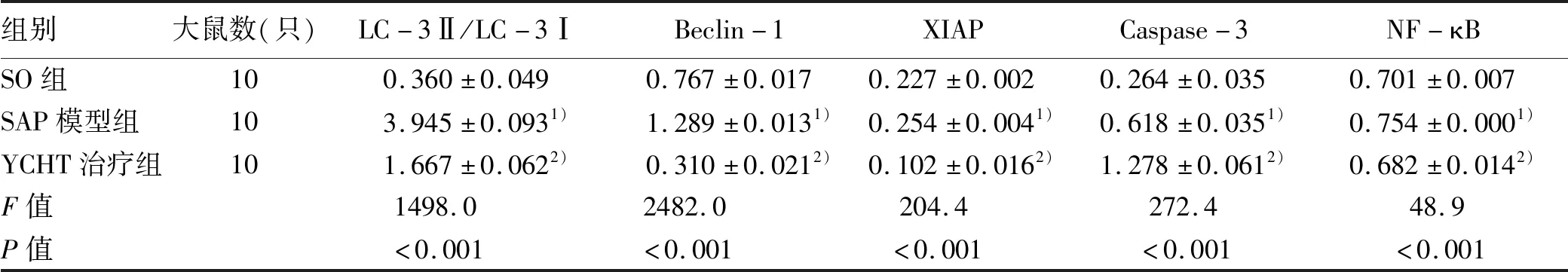
表3 各组自噬和凋亡标记蛋白相对表达量的比较
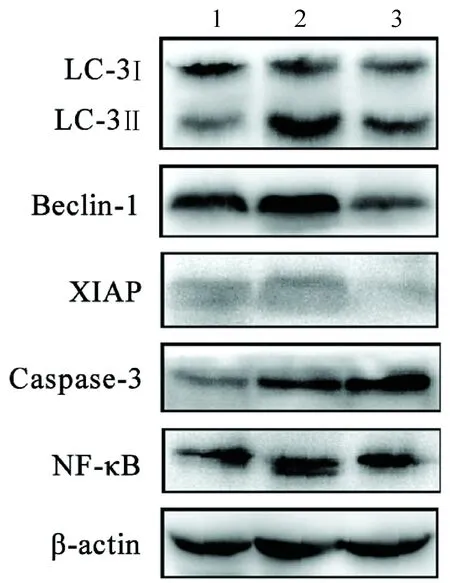
注:1.SO组;2.SAP模型组;3.YCHT治疗组
2.5 YCHT调控lncRNA PVT1/miRNA-30a-5p信号通路 SAP模型组lncRNA PVT1的表达水平明显高于SO组,而miRNA-30a-5p的表达水平明显低于SO组,但YCHT能够显著下调lncRNA PVT1以及升高miRNA-30a-5p的表达水平(表4)。
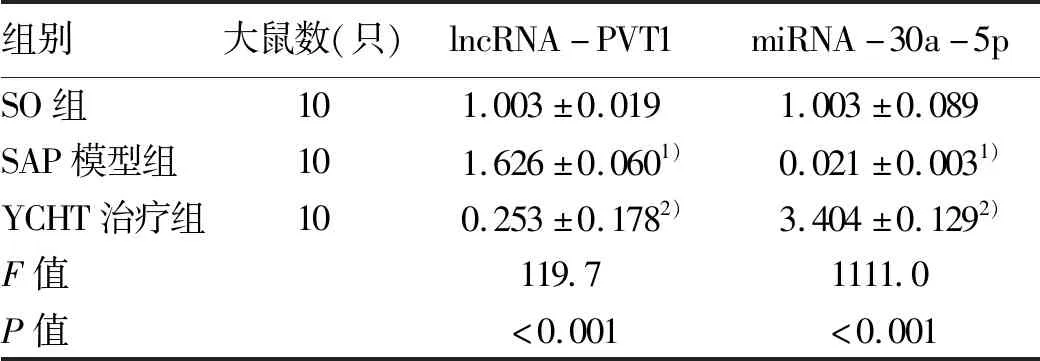
表4 YCHT对胰腺组织中lncRNA-PVT1和miRNA-30a-5p相对表达量的影响
3 讨论
SAP病程复杂,其特征是胰腺腺泡细胞坏死,出现局部和全身炎症[13]。胰腺腺泡细胞的早期凋亡被认为是SAP中的自我保护机制,与发生晚期凋亡的腺泡细胞相比,早期凋亡的诱导可能会降低SAP的严重程度[14-15]。研究[16]报道有利于诱导胰腺腺泡细胞早期凋亡的干预措施可以保护小鼠免受SAP的侵害。
自噬是一个吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程[17]。细胞自噬在SAP发病机制中是一种保护机制还是一种有害机制仍然是一个悬而未决的问题[18]。研究[5,19]报道细胞凋亡与细胞自噬之间相互调控,细胞自噬可以抑制细胞应激和化疗后的细胞凋亡。此外,胰腺特异性自噬的过度激活引起腺泡细胞中酶原颗粒的大量积聚,进一步增加了SAP损伤[16]。本研究发现YCHT能够减轻SAP诱导的大鼠胰腺损伤和炎症反应;此外,采用免疫荧光和TUNEL法发现YCHT能够显著抑制SAP大鼠胰腺组织的细胞自噬以及增加细胞凋亡。
miRNA是一种非编码的单链RNA,通过切割或翻译抑制在动植物中调控基因表达[20];miRNA作为生物过程的关键调控因子参与了多种疾病的发生发展[21-22]。miRNA-30a-5p是miRNA-30家族的成员,在细胞生长、分化和凋亡等过程中起着重要的调节作用[23]。据报道,miRNA-30a-5p在Ⅱ型糖尿病和胰腺导管腺癌的发发展中发挥着重要的作用[24-25]。本组前期研究[12]也发现SAP胰腺组织miRNA-30a-5p的表达异常,能够靶向上调人丝氨酸蛋白酶(HtrA serine peptidase 1, HTRA1)基因,抑制TGFβ1介导的炎症反应。此外,研究[26-27]发现miRNA-30a-5p通过直接与肿瘤细胞的3’-UTR区域序列结合,负性调节自噬基因Beclin-1和凋亡调节因子Bcl-2的表达,从而抑制自噬促进凋亡。
lncRNA的转录本长度超过200个核苷酸残基,但不编码蛋白质。最初被认为是基因组转录的“噪音”,是RNA聚合酶Ⅱ转录的副产物,没有生物学功能[28]。然而,近年来研究发现lncRNA可以通过直接结合靶基因来激活或抑制靶基因的表达,并通过组蛋白修饰或募集转录因子来参与基因表达调控,或者作为一种miRNA竞争性的内源性RNA,参与生物调节过程[9]。本组前期研究中,基于生物信息学方法和双荧光素酶报告基因检测,发现lncRNA PVT1可能是一种内源性miRNA-30a-5p的竞争抑制剂,通过靶向调节lncRNA PVT1/miRNA-30a-5p信号通路介导的细胞凋亡和自噬可改善SAP。
中医古籍中并无急性胰腺炎的相关记载,根据SAP腹痛、呕吐、便结、黄疸等主要临床表现,将其归属于中医“腹痛”“脾心痛”“结胸”等范畴。总体来说,急性胰腺炎病性多为里、实、热证,病机以肝胆气机失调、湿热蕴阻中焦、脾胃升降失常为要。其中,在急性胰腺炎的发病过程中,湿、热、瘀是最关键的病理因素,因此清热利湿、活血化瘀应作为最重要的治疗原则贯穿始终。YCHT始见于汉代医圣张仲景的《伤寒论》,主要病机是里热炽盛、与湿相搏、壅滞中焦、瘀热在里。通常认为,茵陈清热利湿、疏肝利胆,为君药;栀子清泄三焦湿热,为臣药;大黄泻热逐瘀、通降腑气,为佐药。近年来针对YCHT配伍机理进行了更深入的研究,研究认为在YCHT中,只有大黄既能清热泻火、活血化瘀,又可通利大便导湿热而出,大黄相对于茵陈更符合“瘀热在里”的病机。因此,在治疗急性胰腺炎时,茵陈蒿汤中大黄可能起君药作用,而茵陈、栀子对大黄有协同或相加效应。本研究发现,YCHT显著减轻SAP诱导的胰腺组织病理损伤,降低SAP大鼠血浆淀粉酶、以及炎症因子TNFα和IL-1β水平,抑制炎症反应。机制研究发现,YCHT可通过抑制自噬和促进细胞凋亡减轻SAP损伤,其机制可能与调控lncRNA-PVT1/miRNA-30a-5p信号通路有关。这些数据也为中药方剂YCHT的进一步开发提供了依据。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:项红、胡凤林负责课题设计,资料分析,撰写论文;陶旭锋参与收集数据,修改论文;齐心、张金楠协助收集数据,整理参考文献;尚东负责拟定写作思路,指导撰写文章并最后定稿。

