胰高血糖素样肽1受体激动剂在非酒精性脂肪性肝病治疗中的作用及相关机制
俞晓菡,王雨露,许笑阳,平 键,1b,2,3,赵长青,1b,2,3
1 上海中医药大学附属曙光医院 a.肝病研究所, b.肝病二科,上海 201203; 2 上海市中医临床重点实验室,上海 201203; 3 肝肾疾病病证教育部重点实验室,上海 201203
非酒精性脂肪性肝病(NAFLD)是一种无过量饮酒史,以肝细胞脂肪变性和脂质贮积为特征的临床病理综合征。随着对疾病的深入认识,国际专家组建议以代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)代替现有命名[1]。NAFLD影响了全世界超过25%的普通人群,也是美国进行肝移植的主要指征之一[2-4]。研究表明,NAFLD与代谢综合征关系密切,由于中国人群调节脂质代谢的基因更易发生非同义突变,NAFLD在中国人群中具有更高的发病风险。在过去10年中,NAFLD发病率从18%急剧增加到29%,增长速度是西方的2倍[5]。NAFLD的发病机制十分复杂,近年“多重打击”学说逐渐取代经典的“二次打击”学说以解释NAFLD的发病机制[6]。NAFLD的发病过程与胰岛素抵抗、脂毒性、氧化应激、炎症反应和肝脏因子等多种因素有关,但在机制间的相互作用以及在NAFLD发生发展中的变化规律有待进一步明确。迄今为止,针对NAFLD尚无公认的药物疗法,因此寻找新治疗方案十分迫切。NAFLD是一种代谢紊乱相关的多系统疾病[7],在2型糖尿病(Type 2 diabetes mellitus, T2DM)和肥胖患者中更为常见[8]。鉴于胰高血糖素样肽1(Glucagon-like peptide-1, GLP-1)受体激动剂已成功用于临床治疗T2DM和肥胖症[9],故近年来,GLP-1对NAFLD的影响也成为国内外研究的热点。本文综述GLP-1受体激动剂在NAFLD中的治疗作用及相关机制。
1 胰高血糖素样肽1(GLP-1)
20世纪初,研究发现正常体质量者和肥胖者在口服葡萄糖后均刺激了胰岛素的分泌,称该作用为肠降血糖素作用。GLP-1被发现是肠降血糖素之一,摄入食物后通过刺激胰岛β细胞分泌胰岛素克服餐后高血糖症[10]。GLP-1可以通过与B类家族中结构相似的G蛋白偶联受体结合,促进其生物学作用,GLP-1是GLP-1受体(GLP-1R)的内源性配体,可激活腺苷酸环化酶提高环磷酸腺苷水平。GLP-1R在人体中分布广泛[11],近年研究[12]表明,GLP-1R在肝门附近的门静脉壁上表达,可能位于门静脉神经末梢。并且,在肝脏中,GLP-1于肝门静脉循环中被释放,在门静脉中达到其最高静脉内浓度[13]。虽然,未在肝脏中发现大量GLP-1R,但是与其同源的胰高血糖素受体在人肝细胞中大量表达,也介导了GLP-1的肝效应[13]。因此,肝脏也是GLP-1的潜在靶标。GLP-1具有许多促新陈代谢作用,包括葡萄糖依赖性的胰岛素分泌刺激,胃排空减少,食物摄取抑制,利尿以及调节啮齿动物胰岛β细胞增殖。并且,还可抑制啮齿动物和人类的餐后乳糜微粒分泌并降低循环甘油三酯水平[14-15],参与减轻局部或全身炎症。GLP-1R激动剂已成功用于临床治疗T2DM,其中长效GLP-1R激动剂利拉鲁肽[16]是目前临床T2DM一线用药之一,几种基于GLP-1的药物疗法正在临床治疗肥胖症。
2 GLP-1R激动剂在NAFLD中的临床研究
2.1 减轻胰岛素抵抗 Khoo等[17]将24例NAFLD肥胖患者分为2组分别接受利拉鲁肽(3 mg/d)或等量生理盐水治疗26周。治疗后,治疗组患者总脂肪含量和胰岛素抵抗水平均明显降低;血清ALT、AST、肝脂肪分数和肝硬度也较基线水平显著改善。分析表明,GLP-1R激动剂可通过降低体质量、肝酶活性和肝脏脂肪分数进而降低患者胰岛素抵抗水平。
Armstrong团队[18]每天用1.8 mg利拉鲁肽或等量安慰剂分别治疗14例非酒精性脂肪性肝炎(NASH)患者12周。发现利拉鲁肽可以提高肝脏胰岛素敏感性,改善患者空腹血糖水平;增加全身脂肪组织(尤其是皮下组织)胰岛素敏感性,降低NASH中功能异常脂肪组织的脂毒性,加强胰岛素抑制脂解的能力。
2.2 调节肝脏脂质代谢 Petit等[19]开展了一项临床研究,接受6个月1.2 mg/d的利拉鲁肽注射治疗后,57例NAFLD合并T2DM患者肝脏脂肪含量较基线水平下降了33%,该作用与肝酶活性的改善明显相关。GLP-1R激动剂诱导的体质量减少也是引起肝脂肪含量降低的重要因素,同时促进了HbA1c和甘油三酯指标的改善。
Armstrong等[18]还发现利拉鲁肽降低了脂肪胰岛素抵抗指数和INS-1/2-max非酯化脂肪酸,减少了循环中脂毒性代谢和促炎介质的数量,明显抑制了肝脏脂肪的从头合成。
Shao等[20]纳入60例NAFLD合并T2DM的肥胖症患者,分别用GLP-1R激动剂艾塞那肽或强化胰岛素治疗12周后,发现经GLP-1R激动剂可通过降低肥胖患者的体质量而减轻患者肝损伤。此外,肝活检发现经艾塞那肽治疗后,脂肪肝的逆转率高达93.3%,GLP-1R激动剂有效逆转了肝细胞脂肪变性。
2.3 改善肝脏组织学 Armstrong等[21]在一项Ⅱ期临床试验中,将52例NASH患者按1∶1比例随机接受1.8 mg/d利拉鲁肽或等量生理盐水注射治疗48周,经药物治疗的9例患者消除了NASH且无纤维化恶化,3例T2DM和6例非T2MD患者肝组织学得到改善。与安慰剂相比,经利拉鲁肽治疗的患者肝纤维化明显好转,并且肝细胞脂肪变性和气球样变性改善的比例更高。
Eguchi等[22]用0.9 mg/d利拉鲁肽治疗26例糖耐量异常NASH患者24周后,血清HbA1c水平明显下降。并在第96周时,对10例患者进行了重复肝活检,其中6例患者NASH活性评分和Brunt评分显示组织学炎症程度减轻。另有研究[17,23]表明,GLP-1R激动剂可明显降低受试者肝酶、总脂肪量和肝脏硬度。这些结果均提示,GLP-1R激动剂可安全有效的改善肝组织学变化。
3 GLP-1R激动剂影响NAFLD病程进展的实验研究
3.1 在糖脂代谢中的作用 Rahman等[24]用利拉鲁肽(200 μg/kg)治疗高脂肪、果糖和胆固醇(fat, fructose, and cholesterol diet,HFCD)饮食喂养的WT型小鼠4周。发现用药小鼠高血糖症状和胰岛素敏感性得到了改善。机制研究显示,利拉鲁肽激活了HFCD-WT小鼠中磷酸肌醇依赖激酶、蛋白激酶B和蛋白激酶Cζ,抑制c-Jun氨基末端激酶的激活;同时下调了固醇调节元件结合蛋白(sterol-regulatory element binding proteins,SREBP)-1c和碳水化合物响应元件结合蛋白的表达(图1)。提示,GLP-1R激动剂通过激活肝细胞胰岛素信号通路和抑制葡萄糖代谢主要调控因子改善了葡萄糖代谢。
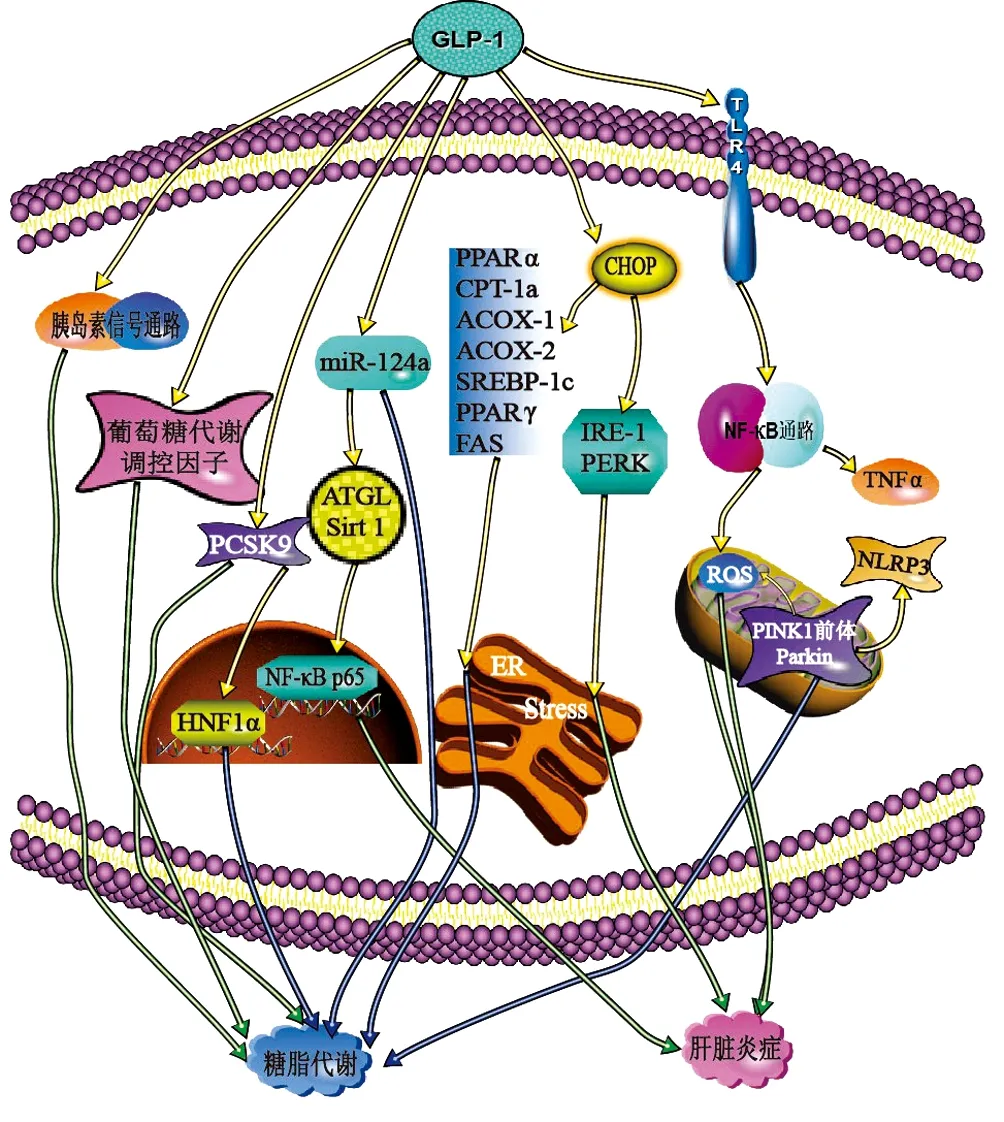
注:PCSK9,前蛋白转化酶枯草杆菌蛋白酶/kexin9型;HNF1α,肝细胞核因子1;ATGL,脂肪甘油三酯脂肪酶;PPARα,过氧化物酶体增值物激活受体α;CPT-1a,肉碱棕榈酰转移酶-1a;ACOX-1,酰基辅酶A氧化酶-1;SREBP-1c,固醇调节元件结合蛋白-1c;FAS,脂肪酸合酶;IRE-1,肌醇需要酶1;PERK, PKR样内质网激酶;ER,内质网;NLRP3,富含亮氨酸的重复序列含受体的吡啶结构域3。
PCSK9主要由肝脏分泌,是胆固醇稳态的重要调节剂[25]。近年来研究[26-27]表明,PCSK9也与葡萄糖代谢相关。Yang等[28]给7周大的db/db小鼠皮下注射利拉鲁肽(200 μg/kg),2次/d,连续7周后,肝细胞内脂滴数量明显减少,血糖、血脂水平得到改善,并发现血浆PCSK9与空腹血糖、胰岛素之间呈正相关,抑制了HNF1α表达。进一步研究表明,利拉鲁肽以剂量及时间依赖性方式下调了PCSK9的蛋白质和mRNA水平。并且,用高剂量利拉鲁肽处理HepG2细胞24 h后,HNF1α的蛋白质和mRNA的表达均降低。相反,抑制HNF1α的表达时,PCSK9的水平增高(图1)。结论是在NAFLD中,GLP-1R受体激动剂直接通过PCSK9调节葡萄糖代谢,而其改善脂质代谢的部分作用是通过HNF1α依赖性机制降低PCSK9得以实现。
Fang等[29]给高脂饮食(HFD)的C57雄性小鼠注射利拉鲁肽(200 μg/kg)8周后,明显减轻了HFD-WT小鼠的肝细胞脂肪变性。体外实验发现,利拉鲁肽也降低了棕榈酸酯(palmitate,PA)培养的HL-7702细胞的细胞内脂质水平。但是,过表达的miR-124a会抵消利拉鲁肽减轻细胞内脂质蓄积的功能(图1)。可知,GLP-1R激动剂可抑制miR-124a,激活自噬以拮抗脂质蓄积。
CCAAT/增强子结合蛋白同源蛋白(homologous protein,CHOP)是内质网应激介导的细胞凋亡的主要转录调节因子[30-31]。增加CHOP肝脏表达可以保护肝细胞免脂毒性的影响[32]。Rahman等[24]每天给予HFCD喂养的CHOP基因敲除(CHOP-/-)型和WT型小鼠利拉鲁肽(200 μg/kg)或等量生理盐水治疗4周。治疗后,2组小鼠的肝脏脂肪变性均有好转,但WT组小鼠好转更加明显,其PPARα,肉碱棕榈酰转移酶-1a、酰基辅酶A氧化酶-1和乙酰辅酶A氧化酶-2表达减少;SREBP-1c、PPARγ和脂肪酸合酶的表达水平也明显下降,说明利拉鲁肽可有效抑制WT小鼠新生脂肪的生成和过氧化物酶体的β氧化(图1)。为进一步研究其作用机制,作者用GLP-1R激动剂Exendin-4和PA处理WT和Chop-/-小鼠原代肝细胞24 h后,比较数据发现Exendin-4可通过CHOP分子抑制新生脂肪的合成。
Yu等[33]用无血清的DMEM或PA联合脂多糖分别处理人肝癌细胞HepG2细胞,再用不同浓度(0、50、100、200、500 nmol/L)的利拉鲁肽作用于HepG2细胞16 h。结果显示,HepG2细胞的脂肪堆积明显减轻,并以浓度梯度依赖性方式提高了HepG2细胞活力。他们还发现,利拉鲁肽可以增加功能性线粒体含量,改善线粒体共定位,增强线粒体中PTEN诱导蛋白酶1前体和帕金蛋白(Parkin)的表达,并抑制细胞中NLRP3炎性体的活化(图1)。表明,GLP-1R激动剂可以通过增强线粒体吞噬作用来减少脂质蓄积,限制活性氧的产生,并通过抑制NLRP3炎性小体的激活减少肝细胞的凋亡,以治疗NASH。
3.2 对肝脏炎症反应的抑制作用 ER应激是导致肝脏脂肪变性、氧化应激和细胞凋亡的重要环节,而CHOP蛋白是ER应激介导凋亡的主要转录调节器。Rahman等[24]每日给HFCD喂养后出现轻度脂肪性肝炎表现的Chop-/-型和WT型小鼠利拉鲁肽(200 μg/kg)或等量生理盐水治疗4周。经治疗,2组小鼠肝脏炎症表现减轻,HFCD-WT小鼠ER应激调节因子PKR样内质网激酶和肌醇需要酶1活性减弱。但是HFCD-Chop-/-小鼠体内肌醇需要酶1的表达未被抑制(图1)。可知GLP-1R激动剂还通过CHOP抑制内质网应激以减轻HFCD所诱导的肝损伤,最终改善NASH的症状。脂肪甘油三酯脂肪酶(adipose triglyceride lipase, ATGL)是一种肝脂酶,主要通过沉默信息调节因子2相关酶1(silencing information regulator1, Sirt1)激活自噬/脂质吞噬作用来调节肝内脂质分解和脂肪酸氧化[34]。Fang等[29]将HFD干预12周的C57BL/6J雄性小鼠分组后给予腹腔注射利拉鲁肽(200 μg/kg)或等量生理盐水治疗8周。经治疗后发现,ATGL和Sirt1蛋白水平显著升高。体外实验中,利拉鲁肽增加了Sirt1的蛋白质水平,降低体外炎症反应,减少肝细胞核中NF-κB p65的存在。他们还发现,GLP-1可抑制HFD-WT小鼠肝脏和PA处理的人肝细胞中miR-124a的表达,导致ATGL表达增加。各项数据显示,抑制miR-124a会破坏炎症细胞因子的表达,促进细胞中ATGL和Sirt1的表达(图1)。GLP-1R激动剂能有效抑制miR-124a,上调ATGL/Sirt1途径以减轻NAFLD中的炎症。
Saad等[35]发现用40 μg/kg(体质量)艾塞那肽治疗HFD喂养的Wistar大鼠,能最有效地减轻肝细胞脂肪变性和门静脉炎症。研究表明,艾塞那肽降低了肝脂质过氧化物水平,脂肪变性程度,使肝实质再生。同时,显著下调Toll样受体4的肝含量,其下游信号通路NF-κB的表达也受到了抑制,其减少了TNFα诱导的细胞凋亡,还调节了线粒体pH值,避免肝细胞发生氧化应激和线粒体功能障碍(图1)。GLP-1R通过Toll样受体4抑制NF-κB信号,不仅使促炎基因的表达下调,还改善了线粒体功能,最终减轻了NAFLD炎症反应。
4 小结
目前,由于NAFLD复杂的发病机制和临床代谢表现,至今没有靶向治疗药物。大量临床和机制研究结果表明,鉴于T2DM与NAFLD的紧密关联,降糖药GLP-1R激动剂可能是NAFLD的潜在药物,其通过激活GLP-1R,提高体内GLP-1水平。GLP-1R激动剂主要在改善胰岛素抵抗、调节脂质代谢和抗肝纤维化三个方面发挥治疗作用。对GLP-1R激动剂影响NAFLD病程进展的机制研究表明,GLP-1R激动剂可以通过各种机制减少肝细胞凋亡和内质网应激,促进肝脏糖脂代谢,抑制炎症反应,缓解了肝纤维化进程,预防NAFLD发展。目前,GLP-1R激动剂在NAFLD的临床研究主要集中在小样本量的临床试验,且对非T2DM的NAFLD临床疗效观察甚少,以及对GLP-1如何在肝脏中发挥作用的探索不够深入,故仍需进一步研究,以期为治疗NAFLD提供更多依据。
作者贡献声明:俞晓菡负责课题设计,资料分析,撰写论文;王雨露、许笑阳参与收集数据;平键、赵长青负责拟定写作思路,修改论文,指导撰写文章并最后定稿。

