人参皂苷20(S)-Rg3通过抑制DNMT3A介导的启动子甲基化促进卵巢癌细胞中抑癌基因VHL的表达
王莉洁,韩 曦 ,郑 霞,周园园,侯惠莲 ,陈 葳,李 旭 ,赵 乐
西安交通大学第一附属医院1转化医学中心,5妇产科,6病理科,7检验科,8陕西省肿瘤精准医学重点实验室,陕西 西安710061;2兰州大学第二医院妇科,甘肃 兰州 730030;3陕西省人民医院妇产科,陕西 西安 710068;4浙江大学医学院附属第二医院妇产科,浙江 杭州 310009
卵巢癌是死亡率最高的妇科恶性肿瘤[1]。因卵巢位于盆腔深部、卵巢癌早期无特异性的症状和体征,加之缺乏有效的早期筛查方法和特异的诊断指标,导致卵巢癌难以被早期发现,约三分之二的卵巢癌患者于中晚期才被确诊[2]。目前,晚期卵巢癌患者的5年生存率仅为15%~45%[3]。因此,改善晚期卵巢癌患者的预后是亟待解决的医学问题。筛选获得靶向关键分子的卵巢癌治疗新药将是改善卵巢癌患者治疗效果的一个重要途径。
人参皂苷是人参具有药物活性的精华成分[4]。目前已分离获得70种以上的人参皂苷单体,包括Ra1-3、Rb1-3、Rg1、Rg3、Rh1等[5]。其中Rg3的抗肿瘤活性吸引了众多注目,已报道Rg3在胶质瘤[6]、结肠癌[7]、肺癌[8]、前列腺癌[9]、乳腺癌[10]、宫颈癌[11]、卵巢癌[12]等多种肿瘤中具有抗肿瘤作用。Rg3根据第20位碳原子(C20)上羟基的空间位置而分为20(S)-Rg3和20(R)-Rg3两个同型异构体[13]。我们课题组前期研究发现,20(S)-Rg3通过上调卵巢癌细胞中的von Hippel-Lindau(VHL)的表达而减弱卵巢癌细胞的侵袭转移能力[12]。VHL的一个重要功能是介导缺氧诱导因子-1α(HIF-1α)经泛素-蛋白酶体途径降解[14]。常氧下,HIF-1α的关键脯氨酸残基由脯氨酸羟化酶区域蛋白羟基化,使得HIF-1α被VHL/E3泛素连接酶复合物识别,进而被多泛素化并被26S蛋白酶体降解[15]。VHL基因失活则使得HIF-1α蓄积,进而促进VEGF、TGF-α等细胞因子表达,加快细胞能量代谢、血管生长等过程,促进肿瘤的发生发展[16]。VHL基因的失活机制主要包括基因突变、杂合性缺失和基因启动子区的甲基化[17-18]。但是,20(S)-Rg3上调抑癌基因VHL的机制尚不明确。
本研究从DNA甲基化这一转录前水平的调控机制入手,发现20(S)-Rg3通过下调DNA甲基转移酶DNMT3A而削弱了其介导的VHL基因启动子区甲基化,使得VHL表达水平升高,为20(S)-Rg3能成为治疗卵巢癌的新型药物提供理论依据。
1 材料和方法
1.1 实验材料
人卵巢癌细胞株SKOV3(中国科学院细胞库);人参皂苷20(S)-Rg3(天士力制药集团股份有限公司);1640培养基(GIBCO);5-Aza-CdR(Sigma);DNMT3A过 表 达 载 体(Addgene)[19]。 质 粒 转 染 试 剂 X-tremeGENE HP(Roche);基因组DNA提取试剂盒(天根生化科技);EZ-DNA Methylation-Direct试剂盒(Zymo Research);RNA提取试剂盒RNAfast 200(上海飞捷生物);反转录试剂盒RevertAid first strand cDNA synthesis Kit(Thermo Fisher);甲基化PCR试剂盒Epi Taq HS和real-time PCR试剂SYBR Green Master Mix(TaKaRa);小鼠抗人β-actin多克隆抗体、兔抗人VHL多克隆抗体、兔抗人DNMT3A单克隆抗体(Cell Signaling Technology);HRP-羊抗兔/鼠IHC二抗试剂盒(福州迈新生物技术)。
1.2 细胞培养与20(S)-Rg3处理
SKOV3细胞用含10%胎牛血清的RPMI 1640培养基在37℃、5% CO2、100%湿度的条件下培养。种板后24 h使细胞密度达到50%,更换新的完全培养基,并加入终浓度为80 μg/mL的20(S)-Rg3,继续培养24 h后提取总DNA、RNA或48h后提取总蛋白备用。
1.3 使用5-Aza-CdR处理细胞
3×105个细胞/孔接种于6孔板中,培养24h后细胞汇合度达到40%~50%时加5-Aza-CdR储存液(10mmol/L)使其终浓度分别达到1、2或5 μmol/L。放入37℃、5% CO2和饱和湿度的培养箱继续培养48h提取总RNA。
1.4 质粒转染
4×105个细胞/孔接种于6孔板中,约24h后细胞汇合度达70%时按照X-treme GENE HP DNA转染试剂说明书进行瞬时转染。每孔使用转染试剂6 μL,质粒2 μg。转染后继续培养48h提取总RNA,72h提取总蛋白。
1.5 DNA提取、重亚硫酸盐处理和甲基化特异性PCR(MSP)
利 用 MethPrimer(http://www.urogene.org/methprimer/)获取VHL基因启动子区的CpG岛信息,并设计MSP引物(序列信息见表1)。提取基因组DNA后,用EZ DAN Methylation-Direct Kit进行DNA重亚硫酸盐处理及纯化回收。按下列体系进行MSP反应:Epi Taq HS 0.1 μL,10×Epi Taq PCR Buffer 2 μL,dNTP mixture 2.4 μL,MgCl2(25 mmol/L)2.4 μL,上、下游引物各0.8 μL,硫化的DNA<40 ng,灭菌水补足至25 μL;反应条件:94℃ 5 min,之后 94 ℃ 30 s,49 ℃ 30 s,72℃30 s,32个循环,之后72℃10 min。PCR产物进行3%琼脂糖凝胶电泳。
1.6 细胞总RNA提取、反转录与real-time PCR
按照RNAFast200试剂盒说明书提取细胞总RNA。核酸蛋白浓度分析仪检测RNA浓度和A260/280比值。采用反转录试剂盒RevertAid first strand cDNA synthesis Kit进行 RNA 反转录:总 RNA 2 μg,random hexamer primer1 μL,用nuclease-free water补足体积到12 μL,在PCR仪中65℃5 min,然后冰上急冷5 min;再加入5×Reaction Buffer 4 μL,dNTP Mixture 2 μL,RNase Inhibitor 1 μL,M-MuLV Reverse Transcriptase 1 μL,将PCR管放入预热的PCR仪,设置反应条件25℃5 min,42℃60min,70℃5min。将得到的cDNA保存于-20℃备用。按照SYBR Green Master Mix说明书进行realtime PCR反应:2×SYBRP remix Ex Taq10μL,10μmol/L上、下游引物各0.4 μL,cDNA1 μL,灭菌水7.4 μL,realtime PCR反应条件为预变性95℃30 s,然后95℃5 s、60℃30 s,重复40个循环,之后接熔解曲线条件。采用CFX-96 real-time PCR system(Bio Rad)软件通过2-ΔΔCt方法计算基因的相对表达量。引物序列见表1。
1.7 Westernblotting
提取总蛋白,BCA法定量,蛋白变性后按照每孔30 μg进行10%SDS-PAGE电泳,320 mA转膜90 min,5%脱脂奶粉封闭,一抗4℃孵育过夜(均为1∶1000),二抗室温孵育1h(1∶2000),化学发光。
1.8 20(S)-Rg3治疗的裸鼠皮下移植瘤组织以及对照组织切片的制备
课题组前期进行了20(S)-Rg3治疗裸鼠皮下移植瘤的实验[12],在裸鼠左前肢背侧皮下接种SKOV3细胞悬液0.1 mL(2×106个),10 d后肿瘤体积大于10 mm3时随机将裸鼠分成对照组和20(S)-Rg3干预组,后续30 d中干预组隔天尾静脉注射5 mg/kg的20(S)-Rg3,对照组则尾静脉注射相同体积的PBS。观察结束时颈椎脱臼处死裸鼠,剥离肿瘤,4%多聚甲醛固定,石蜡包埋并切片。
1.9 免疫组织化学
石蜡脱蜡、水化,高压抗原修复,3%过氧化氢阻断内源性过氧化物酶,一抗4℃孵育过夜,二抗室温孵育15 min,DAB显色,苏木素复染,盐酸酒精分化,氨水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察并拍照。结果判定标准:VHL和DNMT3A以细胞质内有棕黄色颗粒为阳性。
1.10 统计分析
所有数据以均数±标准差表示,用统计学软件SPSS21.0进行统计分析。两组之间差异比较采用独立样本双侧t检验。甲基化特异PCR结果采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 20(S)-Rg3上调卵巢癌细胞SKOV3的VHL表达
Real-time PCR结果显示,相对于对照细胞,终浓度80 μg/mL的20(S)-Rg3处理24 h后卵巢癌细胞SKOV3的VHLmRNA水平显著升高(图1A)。与mRNA水平的变化一致,Western blotting结果显示,20(S)-Rg3令SKOV3细胞的VHL蛋白表达水平显著增强(图1B)。

图1 20(S)-Rg3上调卵巢癌细胞SKOV3的VHLFig.1 20(S)-Rg3 upregulates VHL in ovarian cancer cell line SKOV3.A:Real-time PCR shows elevatated VHL mRNA levelin 20(S)-Rg3-treated cells;B:Western blotting shows increased VHL protein level in20(S)-Rg3-treated cells.*P<0.05.
2.2 20(S)-Rg3降低卵巢癌细胞中VHL基因启动子区的甲基化水平
Real-time PCR结果显示,卵巢癌细胞SKOV3中VHL的mRNA水平随着DNA甲基转移酶抑制剂5-氮杂-2-脱氧胞苷(5-Aza-CdR)处理浓度的增加而升高(图2A)。调取VHL基因序列上游3000个碱基作为其启动子区域,采用MethPrimer在线分析发现这一区域存在CpG岛(图2B)。甲基化特异性PCR(MSP)结果显示,20(S)-Rg3处理后卵巢癌细胞SKOV3的VHL启动子区甲基化水平下降(图2C)。

图2 20(S)-Rg3降低VHL基因启动子区的甲基化水平Fig.2 20(S)-Rg3 reduces methylation level in VHL gene promoter.A:Real-time PCR shows increased VHL mRNA level in 5-Aza-CdR-treated SKOV3 cells;B:The promoter region of VHL gene is predicted to contain CpG islands;C:MSP results show significantly decreased methylation level in the promoter region of VHL gene by 20(S)-Rg3.U=Unmethylated.M=Methylated.*P<0.05.
2.3 20(S)-Rg3通过下调卵巢癌细胞中甲基转移酶DNMT3A表达而增强VHL的表达
Real-time PCR结果显示,在用20(S)-Rg3处理卵巢癌细胞SKOV3后,DNMT3A的RNA水平下降、DNMT3B的RNA水平略有升高,但DNMT1的RNA水平无显著变化(图3A)。Western blotting结果显示DNMT3A的蛋白水平明显降低,而DNMT3B和DNMT1蛋白水平无明显变化(图3B)。在卵巢癌细胞SKOV3中过表达DNMT3A以及过表达DNMT3A同时用20(S)-Rg3处理,real-time PCR和Western blotting检测发现,与对照组相比,单纯过表达DNMT3A后VHL的mRNA和蛋白水平均较对照组下降,DNMT3A过表达拮抗了20(S)-Rg3上调VHL表达的作用(图3C、D)。MSP结果显示单纯过表达DNMT3A后,VHL基因启动子区的甲基化水平升高(图3E)。
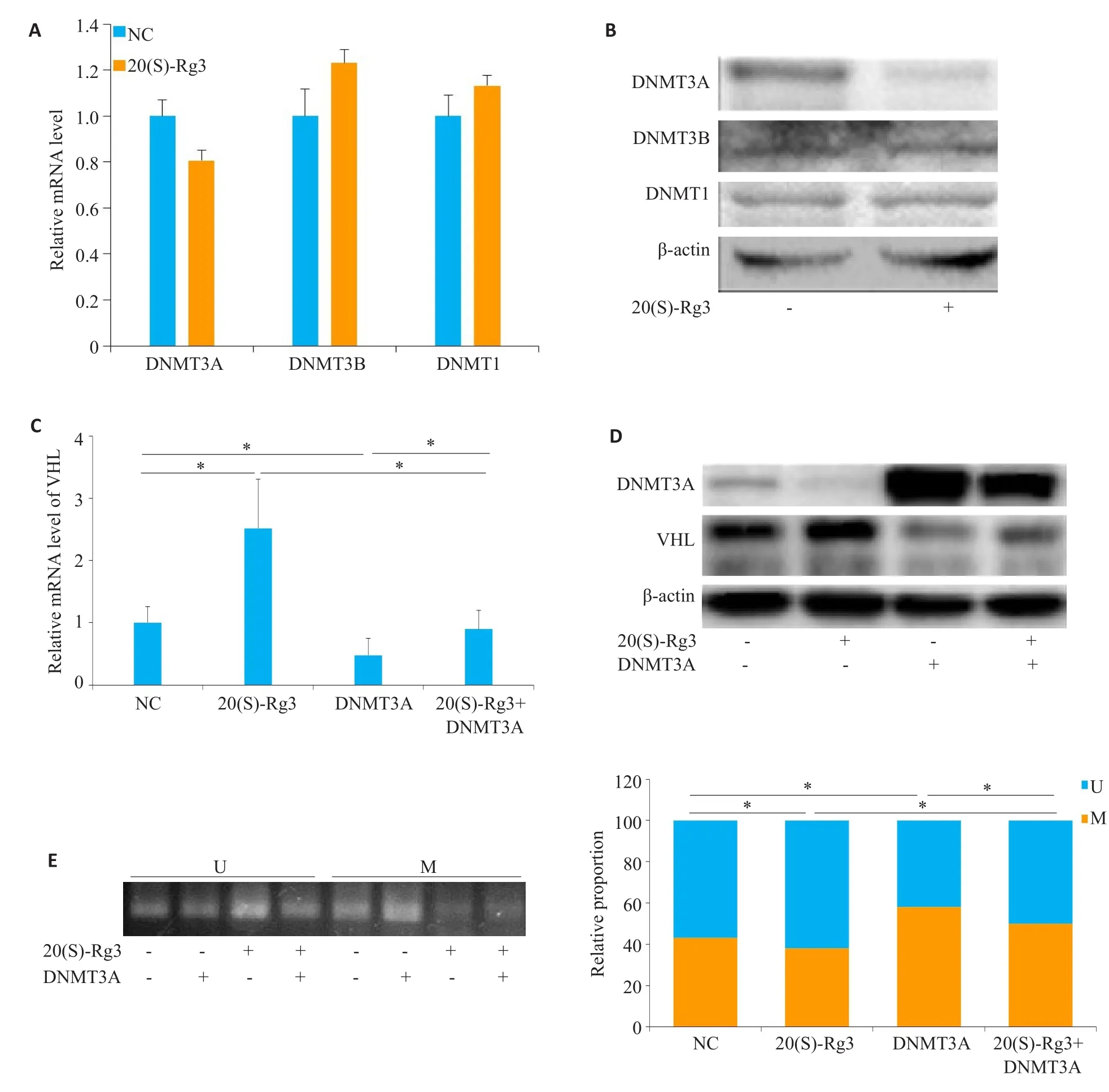
图3 20(S)-Rg3通过抑制DNMT3A介导的DNA甲基化而上调VHLFig.3 20(S)-Rg3 upregulates VHL via suppressing DNMT3A-mediated methylation in the promoter region of VHL gene.A:Real-time PCR results show that 20(S)-Rg3 treatment decreases DNMT3A mRNA level and increases DNMT3B mRNA level without affecting DNMT1 mRNAin the cells;B:Western blotting results show that 20(S)-Rg3 treatment decreases DNMT3A and increases DNMT3B protein expressions without affecting DNMT1 expression in the cells;C:Real-time PCR shows reduced VHL mRNA level in 20(S)-Rg3-treated cells overexpressing DNMT3A;D:Western blotting results show lowered VHL protein expression in 20(S)-Rg3-treated cells overexpressing DNMT3A;E:MSP results show increased methylation level in the promoter region of VHL gene in 20(S)-Rg3-treated cells overexpressing DNMT3A.U=Unmethylated.M=Methylated.Ns:non-significant;*P<0.05.
2.4 免疫组化检测
采用免疫组织化学检测组织中VHL和DNMT3A的表达结果显示,相对于对照组,20(S)-Rg3治疗过的移植瘤组织中VHL表达升高而DNMT3A表达降低(图4)。

图4 20(S)-Rg3治疗的SKOV3细胞裸鼠皮下移植瘤组织中VHL表达增强而DNMT3A表达减弱Fig.4 Immunohistochemical staining showing increased VHL and lowered DNMT3A expressions in subcutaneous tumors derived SKOV3 cells in 20(S)-Rg3-treated nude mice(Original magnification,×200;insets,×400).
3 讨论
本研究证实20(S)-Rg3下调卵巢癌细胞中DNMT3A的蛋白水平,从而抑制其介导的VHL基因启动子甲基化,促进VHL的表达。
20(S)-Rg3抑制卵巢癌细胞恶性表型的重要机制之一为上调抑癌基因VHL基因,但相关分子机制不明[12,20]。在卵巢癌细胞中,20(S)-Rg3在mRNA水平即上调VHL,提示VHL mRNA转录增多或降解减少,相关调控可能发生在转录前、转录或转录后水平,如启动子CpG岛甲基化、非编码RNA等表观遗传调控或转录因子调控等。5-Aza-CdR升高VHLmRNA水平的现象反映出VHL受到DNA甲基转移酶的负调控,而当使用20(S)-Rg3处理后,哺乳动物体内3种主要的DNA甲基转移酶中,仅催化从头甲基化的DNMT3A表达下降,而维持DNA甲基化的DNMT1和催化从头甲基化的DNMT3B表达无变化,提示20(S)-Rg3导致的人卵巢癌细胞VHL表达上调可能与DNMT3A有关。实验结果证实了20(S)-Rg3下调DNMT3A蛋白水平、抑制其介导的DNA甲基化这一表观遗传调控机制,最终促进了VHL表达。这与研究报道的肿瘤中VHL的低表达与启动子区异常高甲基化相关的结果相符[21-22]。DNMT3A在多种肿瘤中发挥促癌作用,其在卵巢癌组织中异常高表达,参与促进卵巢癌细胞的增殖、迁移和侵袭等[23]。下调DNMT3A蛋白水平是20(S)-Rg3抑制卵巢癌细胞恶性表型的另一重要机制。20(S)-Rg3不影响DNMT1和DNMT3B的表达,仅下调DNMT3A,显示20(S)-Rg3对DNMT3A的抑制作用具有一定的特异性。文献报道DNMT3A的蛋白表达水平受到microRNA的负调控[24-26],同时其蛋白稳定性受到泛素-蛋白酶体途径的调控[27-28]。我们已获得了20(S)-Rg3影响的卵巢癌细胞microRNA表达谱,但尚未鉴定到靶向抑制DNMT3A的microRNA[29]。有关20(S)-Rg3降低DNMT3A蛋白水平的机制有待探讨。此外,我们前期发现,在卵巢癌细胞中DNMT3A通过介导microRNA前体基因启动子区甲基化而抑制部分具有抑癌作用的microRNA包括miR-532-3p、miR-603等的表达,从而促进了癌细胞的增殖、迁移和侵袭[29-32],本研究获得的DNMT3A抑制VHL表达的证据在此基础上进一步丰富了DNMT3A促癌作用的分子机制。
综上,人参皂苷20(S)-Rg3通过削弱DNMT3A介导的启动子甲基化而促进卵巢癌细胞中VHL的表达,这一结果拓展了对20(S)-Rg3抗卵巢癌分子机制的认识,为20(S)-Rg3成为临床治疗卵巢癌的候选药物提供了一定的理论依据。

