Müller细胞与视网膜神经再生研究进展
贾茜钰,蓝诗翰,单 亭,叶河江,陈 婕
0引言
视网膜退行性病变(retinal degenerative,RD)是我国及发达国家严重影响视力甚至导致失明的一类疾病,如青光眼、视网膜色素变性、视网膜脱离、年龄相关性黄斑变性等,其主要病理过程为视网膜神经元凋亡。视网膜病变过程中会出现一系列神经元和神经胶质细胞的重塑改变[1],Müller细胞(Müller glial cells,MGCs)是贯穿视网膜全层的主要神经胶质细胞,Müller细胞的神经源潜能可通过其靶向特异性激活相应信号通路,启动胶质反应去分化为神经元,目前RD研究更注重减缓神经元凋亡进程,而忽视了Müller细胞对神经再生的调控作用,故本文以Müller细胞与神经再生研究进行综述。
1 Müller细胞简介
Müller细胞是一种特殊的胶质细胞,其功能多样性和独特的径向形态使其成为视网膜神经元再生治疗的靶点。Müller细胞穿过所有的视网膜层长度(Lc)约为250μm,其胞体耦合神经细胞突触,监测视网膜稳态[2]。Müller细胞具有一系列重要功能:(1)负责视网膜光传导:Müller细胞作为视网膜上活光纤来收集入射光,引导光线穿过视网膜组织走向最外层的光感受器;(2)参与视网膜发色团再循环:Müller细胞转化11顺式视黄醛后,发色团返至视锥细胞上,重新开始视觉周期[3];(3)参与建立血-视网膜屏障(BRB):Müller细胞可通过分泌相关因子增加内皮屏障致密性从而增强视网膜内外屏障功能,对视网膜免疫至关重要;(4)保护视网膜神经元免受兴奋性毒性影响:当氧化应激发生时,Müller细胞释放谷胱甘肽,使谷氨酸转化为无毒的谷氨酰胺,中和活性氧(ROS)以防神经元受兴奋性毒性影响[4-6];(5)离子缓冲及水通道调节:Müller细胞表达多种电压门控离子通道和多种神经递质受体[7]。神经元活动期间,神经元释放钾离子(K+),Müller细胞通过主动或被动转运吸收K+,并且将多余的K+重新分配到神经视网膜外—玻璃体液、视网膜下腔及血液中,缓冲K+不平衡[8],钾离子通道和Müller细胞水通道蛋白4共同调控来保持视网膜水稳态;(6)Müller细胞向神经元提供葡萄糖:Müller细胞为视网膜神经元节省氧气,通过厌氧降解自身葡萄糖,产生大量乳酸,而被光感受器优先吸收[9]。此外,Müller细胞可以产生神经营养因子和保护因子,如血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、胶质细胞神经营养因子(GDNF)、色素上皮衍生因子(PEDF)、胰岛素样生长因子1(IGF-1)等,以上因子通过自分泌和旁分泌方式激活相应靶向信号通路,诱导Müller细胞重编程、增殖,与视网膜微循环、神经再生关联紧密[3]。
2 Müller细胞调节视网膜神经再生的因素
2.1视网膜神经再生过程视网膜损伤和疾病导致神经元变性凋亡时,受损区域丢失的神经元不会自发替换,细胞凋亡最终导致视力丧失。斑马鱼的Müller细胞对视网膜损伤的反应是启动胶质反应去分化,其特征是细胞肥大和增加胶质纤维酸性蛋白(GFAP)表达,使驻留在内核层的Müller细胞在损伤后增殖,进行运动间核迁移,不对称分裂致多能祖细胞形成,随后迁移到丢失的光感受器神经元空白处,迅速增殖,表明Müller细胞是再生神经元祖细胞的替代来源,具有视网膜内源性干细胞的特性[10](图1[3])。近年来研究证明,除鱼类外,鸟类、脊椎动物及人类的Müller细胞也会采取干细胞样状态,产生视网膜神经元[11-13]。研究表明,Müller细胞可定向分化为视杆细胞[14],影响视网膜光感受器功能进而调控神经元重塑[15],并且Müller细胞中的免疫球蛋白样受体B影响视网膜神经再生[16],表明Müller细胞作为视网膜神经元替代治疗的内源性种子细胞,在视网膜神经再生过程中起到重要作用[17-18]。
2.2 Müller细胞特异性靶向Müller细胞是与各级神经元保持功能紧密联系的重要胶质细胞,为神经元靶向提供营养支持。裴雪婷等[19]研究表明直接作用于Müller细胞的中脑星形胶质细胞源性神经营养因子(MANF)通过调控p44/42MAPK信号通路对神经元具有保护作用。李宗义等[20]通过构建Müller细胞结合人源促红细胞生成素稳转株可减慢神经元损伤进程,说明Müller细胞可作为治疗视网膜神经变性的靶向细胞。研究发现在视黄醛结合蛋白1基因的部分调控区域进行条件性Müller细胞消融的转基因模型小鼠中,调控Müller细胞的睫状神经营养因子(CNTF)可减少光感受器细胞凋亡[21]。Müller细胞作为CNTF反应性细胞类型在视网膜退行性病变神经元保护中占重要地位[22]。除此之外,在神经再生基因治疗及病毒转染治疗中Müller细胞特异性靶向可有效降低视网膜其他类型细胞对载体或药物的无效摄取,间接对神经元细胞起到支撑作用[23]。视网膜下通过转导作用于Müller细胞慢病毒载体更易于转染光感受器细胞和色素上皮细胞[24],有效的Müller细胞转基因表达可以通过神经胶质特异性启动子来驱动,如GFAP、波形蛋白、分化簇44(CD44),研究表明含有胶质细胞特异性启动子的慢病毒载体可在Müller细胞中有效转导并指导持续的转基因表达。外源性干细胞移植促进Müller细胞增殖重编程可用于视网膜神经再生的实验治疗[25]。
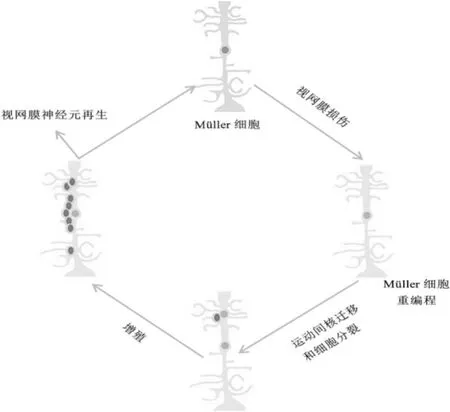
图1 Müller细胞与视网膜神经再生示意图。
2.3 Müller细胞神经源潜能—视网膜神经再生关键因素Müller细胞可作为神经元再生潜能靶细胞主要是由于Müller细胞与祖细胞存在重叠的再生基因。Yu等[26]研究证明电刺激通过调控bFGF途径触发遗传性视网膜色素变性小鼠模型Müller细胞重新进入细胞周期动员内源性祖细胞逆转光感受器细胞,产生新的光感受器细胞。Conedera等[27]实验运用局灶性二极管激光器损伤斑马鱼视网膜,造模后Müller细胞表达GFAP,磷酸化p44/42MAPK(Erk1/2)和增殖细胞核抗原(PCNA)上调。王芳等[28]建立N-甲基-N-亚硝脲(MNU)感光细胞凋亡模型发现造模2d后Müller细胞开始分泌神经干细胞相关因子,继而增殖去分化展现干细胞特征。董晓飞等[29]将N-甲基-d-天门冬氨酸(NMDA)神经毒素混合液注射于实验大鼠玻璃体腔,分离Müller细胞进行体外培养后移植入自发性遗传性视网膜变性大鼠视网膜下腔,结果显示神经干细胞占总细胞量比重过半,诱导产生神经干细胞特性,Müller细胞可以有效延缓模型大鼠视网膜光感受器细胞变性。Ooto等[30]研究发现NMDA诱导视网膜神经节细胞(RGCs)损伤可引起Müller细胞增殖,并产生具有神经元细胞分化标志物的新细胞。外源性晶状体伴视神经损伤,可诱导Müller细胞活化,对视神经损伤后RGCs具有保护作用[31]。
3调控Müller细胞增殖分化相关通路及因子
Müller细胞是视网膜受损后神经细胞再生的主要来源,其可通过信号级联重新编程获得视网膜干细胞特性,去分化增殖为视网膜前体细胞。参与Müller细胞增殖和分化的信号通路主要有Wnt/Gsk3β/β-catenin信号通路、MAPK-Erk信号通路、JAK/STAT3信号通路、Notch信号通路等。
3.1 Wnt/Gsk3β/β-catenin信号通路β-连环蛋白(β-catenin)是一种多功能蛋白,与T细胞因子、淋巴蛋白增强因子家族成员协作,将细胞表面Wnt和钙黏蛋白与基因表达联系起来,Wnt蛋白分泌脂质修饰糖蛋白,结合Frizzed家族受体调节β-catenin稳定,糖原合酶激酶3β(Gsk3β)则通过磷酸化调节β-catenin稳定。研究表明,抑制Wnt表达可抑制损伤视网膜的祖细胞形成,此外Gsk3β抑制剂在斑马鱼视网膜再生研究中通过β-catenin信号通路激活Müller细胞重编程和祖细胞形成[32-33]。Yao等[34]实验表明β-catenin的基因转移可刺激Müller细胞增殖,继β-catenin基因转移后,细胞周期激活Müller细胞重新编程产生光感受器细胞。
3.2 MAPK-Erk信号通路在视网膜损伤研究中,Müller细胞衍生祖细胞的产生是由表皮生长因子(EGF)和MAPK-Erk信号通路所介导,作用可能是EGF和成纤维细胞生长因子(FGF)受体通过丝裂原激活蛋白激酶(MAPK)和细胞外信号调节激酶(Erk)调节衍生祖细胞功能[35]。
3.3 JAK/STAT3信号通路JAK非受体酪氨酸激酶,通过介导细胞因子磷酸化STAT3,诱导Müller细胞重编程和视网膜再生;JAK/STAT3信号通路在胶质细胞的发育和神经损伤后胚胎干细胞自我更新能力的维持过程中作用明显。近年研究发现Müller细胞中STAT3的表达在视网膜损伤后增强,激活的Müller细胞以及增殖的前体细胞高表达,使用JAK/STAT3信号通路抑制剂可抑制hbegfa、Ascl1a、lin-28等再生相关基因表达,并减弱视网膜再生,由此可见JAK/STAT3信号通路在Müller细胞重编程和视网膜再生中起着关键作用[36-37]。
3.4 Notch信号通路Notch信号可调节神经元生长,与神经元受损后的修复及再生密切相关[38]。研究发现Notch信号通路在斑马鱼视网膜再生过程中起抑制作用,在视网膜受损鱼类中Müller细胞数量减少;在鸡视网膜病变中Notch信号起促增殖作用,表明Notch信号通路与反应的Müller细胞数量和视网膜损伤的程度相关,Notch通路既可以抑制又可以促进Müller细胞增殖,且对于抑制干细胞的分化发挥了重要作用[39]。
3.5其他相关因子斑马鱼视网膜再生相关转录组分析表明视网膜损伤后斑马鱼快速诱导转录因子和生长因子,如hbegfa和肿瘤坏死因子α(TNFα)[40],它们由Müller细胞表达,以自分泌、旁分泌的方式刺激祖细胞形成和增殖,损伤诱导Ascl1a基因表达导致细胞分化,激活促增殖程序。Ascl1a刺激lin-28基因表达,通过调节Wnt信号影响Müller细胞重编程和增殖。Ascl1a亦可调节胰岛素样相关因子表达,影响Müller细胞重编程和祖细胞周期退出,在轻度损伤的斑马鱼视网膜中,STAT3基因的表达可能先于Ascl1a[41],而损伤依赖性Ascl1a的表达仅限于重编程的Müller细胞衍生的祖细胞[42]。近期实验研究表明,在NMDA小鼠模型中Ascl1强表达可诱导Müller细胞的神经源性状态,但在出生后第16d,Ascl1过表达,Müller细胞失去神经源性能力,成熟Müller细胞神经源性能力的丧失伴随着染色质可及性的降低,说明表观遗传因素限制了再生[43]。但运用组蛋白脱乙酰基酶抑制剂可诱导成年小鼠视网膜损伤后Müller细胞产生神经元。离体Müller细胞研究表明Müller细胞在48h内上调细胞周期调节因子,表达神经源性因子Ascl1、Pax6和Vsx2,且高达60%的细胞重新进入细胞周期,Müller细胞后代亚群开始表达转录因子和神经元标志物,而不是神经胶质标志物,此过程表明神经再生[44]。除此之外,表皮细胞生长因子(HB-EGF)、成纤维细胞生长因子2(FGF2)、谷氨酸盐及其拟似物α-Aminadipate等因子与Müller细胞转化为视网膜神经元相关[39]。MicroRNA驱动基因调控机制可促进发育过程中从视网膜祖细胞获取Müller细胞谱系过程,诱导其对视网膜变性的响应以及Müller细胞增殖分化[45]。另有研究表明,ARS2-FLASH介导的组蛋白mRNA可调节视网膜祖细胞周期和神经胶质细胞命运,影响Müller细胞和感光细胞分化改变[46]。
4总结和展望
视网膜神经再生是复杂的过程,基于Müller细胞特性研究神经保护机制及对神经元再生的调控作用,对实现神经再生和视觉重建精准靶向治疗具有重要指导意义。近年视网膜神经再生研究具有显著进步,已证明Müller细胞可作为视网膜神经再生关键靶点,但仍有些问题亟待研究。人类视网膜神经再生机制如何?免疫性方面Müller细胞的异质性如何?如何有效激活Müller细胞神经源启动胶质反应去分化为神经元?有待进一步研究,理清这些问题,将为视网膜退行性病变的治疗提供新思路。

