异槲皮苷对Aβ25-35导致的PC12细胞损伤的保护作用及机制研究
郑传痴,周旭美,高健美*
1遵义医科大学第二附属医院药剂科;2遵义医科大学药学院,遵义 563000
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见于老年期的以进行性认知能力下降和社会功能障碍为临床表现的神经系统退行性疾病。据报道,预计到2050年AD患者总数预计达1亿3 150万,不仅严重影响中老年人身体健康和生活质量,而且给患者和家庭带来了沉重的精神负担和经济负担[1]。而随着我国人口老龄化加速,AD在老年人疾病谱中的地位日益突显。因此,对AD的防治研究是全球关注的重点。AD的典型病理特征为β-淀粉样蛋白(amyloidβ-protein,Aβ)沉积形成的老年斑,细胞内Tau蛋白异常磷酸化引起的神经纤维缠结和神经元缺失[2]。但是其作用机制复杂,目前尚不清楚。其中,Aβ导致的神经元氧化应激损伤被认为是导致AD的重要因素之一[3]。因此,研发抗Aβ导致的神经元氧化应激损伤的药物意义重大。但目前尚无理想的防治AD的药物。
我国中草药资源十分丰富,某些记载的具有抗衰老和促智的传统中药已被证明可以改善AD动物模型的学习和记忆能力[4]。因此,从中草药及其活性成分等天然产物中寻找有效的防治AD的药物具有重要的现实意义。异槲皮苷是多种中药(例如多穗石柯、红景天、桑叶、白花蛇舌草)的黄酮醇苷类活性成分之一,具有抗人肝癌细胞HepG2增殖作用[5]、抑制脂多糖诱导的RAW264.7巨噬细胞炎症反应的作用[6]、保护叔丁基过氧化氢诱导的人肝细胞氧化损伤的作用[7]。最近研究发现,异槲皮苷能够抑制氧化应激发挥对链脲佐菌素诱导的神经毒性的保护作用[8],但是,其对AD细胞模型是否具有保护作用尚不清楚。因此,本研究拟通过Aβ25-35损伤PC12细胞建立体外AD模型,从氧化应激的角度探讨异槲皮苷的神经保护作用并初步分析其作用机制,为异槲皮苷临床用于防治AD提供药理学依据。
1 材料与方法
1.1 试验药物
异槲皮苷(成都普思生物科技股份有限公司,纯度>98%,批号PS000510)。试验药物用DMSO溶解,-20 ℃冻存,临用前用DMEM培养液稀释,采用0.22 μm微孔滤器过滤除菌,备用。
1.2 细胞
大鼠肾上腺髓质嗜铬细胞瘤细胞株PC12来源于American Type Culture Collection (ATCC,Rockville,MD,USA)。接种于含10%胎牛血清,2%谷氨酰胺的DMEM培养液中,在37 ℃,5% CO2培养箱中培养。
1.3 试剂
DMEM培养液(Hyclone公司);Aβ25-35(Sigma公司);甲基噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、活性氧(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malonaldehyde,MDA)试剂盒(南京建成生物工程研究所);腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、p-AMPK、过氧化物增殖体受体辅激活子-1α(peroxisome proliferator-activated receptor coactivator-1α,PGC-1α)、沉默信息调节因子3(sirtuin3,Sirt3)和异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH2)抗体(Abcam公司)。
1.4 主要仪器
FormaTMSteri-CycleTMi250型二氧化碳培养箱(美国Thermo Scientific);CX31型倒置显微镜(日本Olympus);IX73型荧光显微镜(日本Olympus);电泳仪(美国Bio-Rad);全自动电泳凝胶成像分析系统(美国Bio-Rad)。
1.5 方法
1.5.1 成分-靶点分子对接
从RSCB 数据库(http://www.rcsb.org/)中下载 AMPK蛋白的晶体结构(PDB ID:2UV5),使用AutoDockTools1.5.6软件将晶体结构中的水分子删除,进行加氢处理后保存为pdbqt格式文件。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载异槲皮苷化合物2D及3D结构的SDF格式文件。利用Pymol软件进行蛋白小分子结构处理,运用AutoDock vina软件进行分子对接。
1.5.2 Aβ25-35对PC12细胞毒性损伤的浓度选择
将浓度为1×105个/mL的处于对数生长期PC12 细胞接种于96孔板,培养12 h后,分别加入终浓度为5、10、20、40、80 μmol/L Aβ25-35溶液,分别作用培养12、24、48、72 h后,每孔加入 25 μL MTT(5 mg/mL)继续作用4 h后,弃上清, 每孔加入150 μL二甲基亚砜,震摇10 min后,于酶标仪492 nm波长处检测吸光度值。
1.5.3 实验分组及药物处理
将对数生长期的PC12细胞以1×105个/mL细胞密度接种于96孔板中,培养24 h后,随机分为正常对照组、模型组(Aβ25-35)、异槲皮苷给药组(1、10和100 μmol/L)。不同浓度1、10和100 μmol/L异槲皮苷预处理1 h后,再加入Aβ25-35继续作用48 h。
1.5.4 MTT法检测异槲皮苷对Aβ25-35损伤PC12细胞存活率的影响
PC12细胞按照“1.5.3”项方法经药物处理后,每孔加入25 μL MTT(5 g/L),继续培养4 h后,弃上清,每孔加入150 μL DMSO溶解,振摇10 min后,于酶标仪492 nm波长处检测吸光度值。
1.5.5 LDH释放率检测异槲皮苷对Aβ25-35损伤PC12细胞细胞毒性的影响
PC12细胞按照“1.5.3”项方法经药物处理后,以4 000 rpm在4 ℃条件下离心10 min后,取上清,严格按照 LDH 测试盒说明书操作测定LDH释放率。
1.5.6 形态学观察
PC12细胞按照“1.5.3”项方法接种于6孔板,经药物处理后,于倒置显微镜下观察细胞形态变化并拍照记录。
1.5.7 异槲皮苷对ROS、MDA含量、SOD和GSH-Px活力的影响
PC12细胞按照“1.5.3”项方法经药物作用48 h后,3 000 rpm在4 ℃条件下离心10 min后,取上清,严格按照试剂盒操作测定ROS和MDA含量以及SOD和GSH-Px活力。
1.5.8 Western blot法检测AMPK、PGC-1α、Sirt3、IDH2蛋白表达
PC12细胞按照“1.5.3”项方法经药物处理后,提取PC12细胞总蛋白后,采用BCA试剂盒测定蛋白浓度,加热使之变性后,每孔上样30 μg,经12%十二烷基磺酸钠凝胶电泳后,将蛋白采用半干法转印至硝酸纤维素膜上,封闭2 h后,加入相应一抗:p-AMPK(1∶1 000)、AMPK(1∶1 000)、PGC-1α(1∶1 000)、Sirt 3(1∶1 000)、IDH2(1∶1 000),于4 ℃孵育过夜,TBST洗膜后3次后,以辣根过氧化酶标记的二抗封闭孵育1 h后,采用ECL发光法经凝胶成像系统曝光显影,条带灰度值分析采用Image J软件。
1.5.9 数据分析
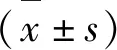
2 结果
2.1 异槲皮苷作用于AMPK蛋白的分子对接结果
通过分子对接技术分析异槲皮苷与AMPK结合情况的研究结果显示:异槲皮苷与AMPK蛋白的结合能为﹣9.48 kJ/mol,其结合能≤﹣5 kJ/mol说明异槲皮苷能够与AMPK蛋白结合。其氨基酸结合位点主要包括:ASN256、LEU249和LYS253(图1)。以上结果提示AMPK可能为异槲皮苷对Aβ25-35导致的PC12细胞损伤的保护作用的潜在靶点。

图1 异槲皮苷与AMPK对接模式图Fig.1 The molecular docking pattern diagram of isoquercitrin with AMPK注:A:异槲皮苷与AMPK结合表面3D可视化图;B:异槲皮苷与AMPK结合位点的3D可视化结果;C:异槲皮苷与AMPK结合位点的2D模式图。Note:A:3D visualization bingding surface of isoquercitrin with AMPK;B:3D visualization bingding sites of isoquercitrin with AMPK;C:2D visualization bingding sites of isoquercitrin with AMPK.
2.2 Aβ25-35对PC12细胞损伤的浓度选择
通过MTT法检测Aβ25-35对PC12细胞的损伤。结果发现与空白对照组比较,5、10、20、40、80 μmol/L Aβ25-35能够显著抑制PC12细胞的活力(P<0.05)。由于20 μmol/L Aβ25-35作用48 h存活率接近50%,因此确定20 μmol/L Aβ25-35作用48 h为最佳作用浓度和时间用于后续实验(图2)。
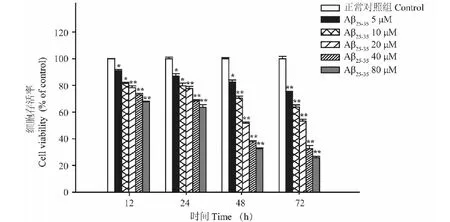
图2 Aβ25-35对PC12细胞损伤的影响Fig.2 The effect of Aβ25-35 on PC12 cell 注:与正常对照组比较,*P<0.05;** P<0.01。Note:Compared with control,*P<0.05;**P<0.01.
2.3 异槲皮苷对Aβ25-35损伤的PC12细胞存活率和LDH含量的影响
模型组(Aβ25-35)细胞活力较空白对照组显著降低,LDH含量明显升高(P<0.01),与模型组比较,异槲皮苷(1、10和100 μmol/L)作用48 h能够浓度依赖性的增加细胞存活率,降低LDH含量(P<0.05,P<0.01)(图3、图4)。

图3 异槲皮苷对Aβ25-35损伤的PC12细胞存活率和LDH含量的影响Fig.3 The effect of isoquercitrin on cell viability of 注:A:正常对照;B:模型;C:异槲皮苷1 μmol/L;D:异槲皮苷10 μmol/L;E:异槲皮苷100 μmol/L。 与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01,下同。Note:A:Control;B:Model;C:Isoquercitrin 1 μmol/L;D:Isoquercitrin 10 μmol/L;E:Isoquercitrin 100 μmol/L.Compared with normal group,**P < 0.01;Compared with model group,#P<0.05,##P<0.01,the same below.
图4 异槲皮苷对Aβ25-35损伤的PC12细胞LDH含量的影响Fig.4 The effect of isoquercitrin on LDH level of
2.4 异槲皮苷对Aβ25-35损伤的PC12细胞形态的影响
模型组(Aβ25-35)细胞较正常对照组细胞数量减少,细胞形态出现皱缩、变圆且部分漂浮在培养液中;异槲皮苷(1、10和100 μmol/L)作用后较模型组细胞数量和形态均有所改善(图5)。

图5 异槲皮苷对Aβ25-35导致损伤的PC12细胞形态的影响(200 ×)Fig.5 The effect of isoquercitrin on cell morphology of Aβ25-35-induced PC12 cell injury (200 ×)
2.5 异槲皮苷对ROS、MDA含量和GSH-Px、SOD活性的影响
结果显示,Aβ25-35模型组较正常对照组ROS和MDA含量显著增加;而异槲皮苷(1、10和100 μmol/L)组较模型组ROS和MDA含量明显降低(P<0.05,P<0.01)。同时,Aβ25-35模型组较正常对照组SOD和GSH-Px活力显著降低;异槲皮苷(1、10和100 μmol/L)组较Aβ25-35模型组SOD和GSH-Px的活性明显增加(P<0.05,P<0.01)(表1)。

表1 异槲皮苷对ROS、MDA含量和GSH-Px、SOD活性的影响
2.6 异槲皮苷对AMPK、PGC-1α、Sirt3、IDH2蛋白表达的影响
Aβ25-35模型组较正常对照组p-AMPK水平、PGC-1α、Sirt3和IDH2蛋白表达明显降低(P<0.01);而异槲皮苷较Aβ25-35模型组p-AMPK水平、PGC-1α、Sirt3和IDH2蛋白表达明显增加(P<0.05,P<0.01)(图6、图7)。
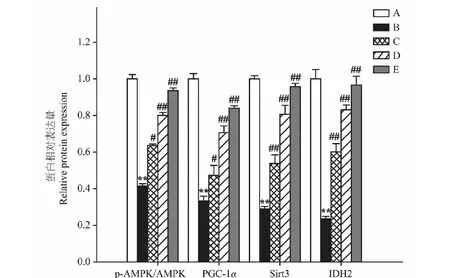
图7 异槲皮苷对AMPK、PGC-1α、Sirt3、IDH2蛋白表达的影响Fig.7 The effect of isoquercitrin on AMPK,PGC-1α,Sirt3 and IDH2 protein
3 讨论
最近文献报道,异槲皮苷能够减少Aβ诱导的小鼠大脑淀粉样变性,但是其作用机制尚不明确[9]。值得注意的是,异槲皮苷能够通过激活调节体内能量代谢的重要激酶AMPK发挥抗脂质代谢紊乱的作用。因此,我们推测AMPK可能为异槲皮苷防治AD的作用靶点。分子对接是一种通过模拟配体和受体相互作用来筛选小分子化合物的药物设计方法。可通过构建关键靶点的分子对接模型,分析小分子化合物与关键靶点的相互作用[10]。因此,本研究首先采用分子对接技术分析异槲皮苷与AMPK的结合情况。研究结果显示,异槲皮苷能够与AMPK结合,提示AMPK可能为异槲皮苷防治AD的作用靶点。
目前,Aβ沉积被认为是AD发病的始动因素和病理改变的重要因素,因此,本研究采用了公认的Aβ25-35导致神经元损伤模型建立体外AD模型进一步观察异槲皮苷的神经保护作用[11]。本研究结果显示,Aβ25-35明显减低细胞活力,增加细胞LDH含量,提示Aβ25-35损伤细胞严重,与文献报道一致[12]。而异槲皮苷能够浓度依赖性的增加Aβ25-35损伤的细胞活力并降低其LDH含量,表明异槲皮苷具有保护Aβ25-35导致的细胞损伤作用,但是其作用机制有待于进一步探索。有研究发现,Aβ导致的氧化应激损伤是导致AD发生发展的关键因素。氧化应激损伤是指体内的ROS(主要包括羟自由基、过氧化氢、超氧阴离子等)与体内抗氧化系统(主要包括SOD、GSH-Px)失平衡导致的细胞损伤。本研究结果显示,Aβ25-35可导致细胞内ROS和脂质过氧化物MDA明显增加,同时降低抗氧化物酶SOD和GSH-Px的活力,表明Aβ25-35可导致神经元氧化损伤,与文献报道一致[13,14]。而异槲皮苷能够浓度依赖性的减少ROS和MDA含量并提高抗氧化物酶活力,提示异槲皮苷对Aβ25-35导致的细胞损伤作用与其提高抗氧化物酶活力而清除Aβ25-35产生的过多ROS有关。
近年来研究发现,AMPK/Sirt3信号通路与Aβ导致的氧化应激损伤进而引发AD的发生关系密切[15]。其中AMPK的活化可减少脑内Aβ的沉积[12]。Sirt3是Sirtuin家族在进化上高度保守的成员之一,在氧化应激导致的AD发生发展过程中发挥重要的作用。值得注意的是,AMPK能够通过磷酸化激活其下游的PGC-1α进而活化Sirt3,Sirt3可进一步激活其下游的IDH2发挥抗氧化应激损伤作用[16,17]。本研究结果显示,Aβ25-35明显降低AMPK的磷酸化水平及其下游PGC-1α的表达,同时下调Sirt3及其下游IDH2的表达,表明AMPK/Sirt3信号通路在Aβ导致的AD中发挥重要作用,与文献报道一致[18,19]。而异槲皮苷可显著增加AMPK的磷酸化水平及其下游PGC-1α的表达,同时上调Sirt3及其下游IDH2的表达,表明异槲皮苷通过调控AMPK磷酸化进而激活Sirt3发挥抗Aβ导致的神经细胞氧化应激损伤作用。尽管本研究初步明确了异槲皮苷对Aβ25-35导致的PC12细胞氧化损伤的保护作用,但是其具体作用机制仍需深入研究。在进一步的研究中将采用AMPK的抑制剂或其他信号通路相关siRNA干扰手段,验证该信号通路是否参与其中并在体内动物模型中进一步确定其药效及其可能的作用靶点。
综上所述,异槲皮苷能够抑制Aβ25-35导致的神经细胞氧化损伤,其作用与激活AMPK/Sirt3信号通路有关,但是仍需通过体内实验进一步确定其药效及其作用机制。

