载10-羟基喜树碱靶向相变纳米粒联合高强度聚焦超声治疗裸鼠肝癌移植瘤
任春蓉 张战峰 陈春燕 魏小芳 周 洋
高强度聚焦超声(high intensity focused ultrasound,HIFU)作为最具代表性的非侵入性治疗肿瘤的方式之一,应用前景广泛,但其治疗深部肿瘤(如肝癌)时需增加超声功率或延长单次消融时间,且其疗效和生物安全性降低,严重阻碍了其在临床的进一步发展应用[1]。相关研究[2-3]应用超声增效剂改变组织的声环境、增加超声空化作用和能量沉积来增效HIFU 治疗。其中相变超声造影剂通过静脉注射后再行HIFU 辐照,可在肿瘤原位相变产生微泡,增效HIFU 的同时监控HIFU消融过程,取得了较好的效果。然而,HIFU消融不可避免存在残余肿瘤细胞,导致肿瘤复发和转移,同时因HIFU 消融可破坏肿瘤血管致化疗药物难以到达肿瘤[4-5]。本实验拟制备一种叶酸受体靶向的载10-羟基喜树碱相变纳米粒(folic acid receptortargeted 10-hydroxycamptothecin -loaded phase-change nanoparticle contrast agent,FR-HCPT-PNPCA),可以在增效HIFU 消融的同时释放化疗药物,旨在更好地杀灭肿瘤细胞,增强远期疗效,为肿瘤精准治疗提供一种新的手段。
材料与方法
一、实验动物
BALB/c 裸鼠 160 只,3~5 周龄,平均体质量(20.1±2.2)g,购于西南交通大学实验动物中心。所有动物实验均取得西南交通大学医学院伦理委员会同意。
二、仪器与试剂
1.主要试剂和细胞:磷脂酰胆碱(DPPC)、偶联叶酸的磷脂酰乙醇胺[DSPE(PEG)Folate]、普通磷脂酰乙醇胺(DSPE)、甘油磷脂(DPPG)、泊洛沙姆(PF68)及胆固醇(CH)购于美国Avanti 公司,全氟己烷(PFH)购于法国Elf Atochem 公司,末端标记测定法(TUNEL法)检测细胞凋亡和增殖细胞核抗原(PCNA)抗体购于美国 Sigma 公司,10-HCPT、三氯甲烷、甲醛及 TTC 染色试剂购于生工生物工程(上海)有限公司。人肝癌7721 细胞购于中国科学院细胞库,细胞培养液购于美国Gibco公司。
2.实验仪器:78-1 磁力搅拌器(上海越磁电子科技有限公司),RE-52A 旋转蒸发器(上海亚荣生化仪器厂),FJ-200 高速分散均质机(上海隆拓仪器有限公司),VCX-130 超声破碎仪(美国SONIC 公司),倒置荧光显微镜(日本Olympus 公司),MyLab 90 彩色多普勒超声诊断仪(意大利百胜医疗),JC-A HIFU 治疗仪(重庆海扶医疗科技股份有限公司)。
三、FR-HCPT-PNPCA 的制备
HIFU 消融前 1 d 参照本课题组前期研究[6-7]的方法,将壳材[DPPC、DSPE(PEG)Folate/DSPE、DPPG、PF68、CH 和10-HCPT]按5∶1∶1∶1∶1∶1 的比例用三氯甲烷、甲醛溶解,加入后真空旋转蒸发成膜,重新水化后加入PFH 经过双步乳化制得乳白色的FR-HCPTPNPCA 乳剂。不加入10-HCPT 则制得单纯靶向非载药相变纳米粒(FR-PNPCA)乳剂,成品送西南交通大学材料学院测得乳剂平均粒径(340±45)nm,浓度1.12×1010个/ml。
四、荷瘤裸鼠模型建立及分组
1.荷瘤裸鼠模型建立及分组:选取160 只BALB/c裸鼠,采用皮下注射人肝癌7721细胞的方法建立荷瘤裸鼠模型,3~4 周后选取肿瘤大小约1 cm×1 cm×1 cm荷瘤裸鼠120 只,随机等分为4 组,于HIFU 治疗前1 d分别通过尾静脉注射药物或生理盐水200 μl。A 组为注射生理盐水后行HIFU 辐照,B 组为注射HCPT(2 mg/ml)后行 HIFU 辐照,C 组为注射 FR-PNPCA 后行 HIFU 辐 照 ,D 组 为 注 射 FR-HCPT-PNPCA 后 行HIFU辐照。
2.HIFU 治疗:参照既往实验研究[2-3]方法,裸鼠腹腔内注射1%戊巴比妥钠(30 mg/kg)麻醉,固定四肢,将肿瘤部位完全浸入HIFU 治疗仪的脱气水槽中,超声确定焦域位于肿瘤中心,采用点辐照的方式进行消融治疗,能量为120 W,作用时间5 s。
五、观察指标
1.HIFU 辐照后即刻应用超声(LS 22 探头,频率3~7 MHz)观察各组肿瘤内灰度变化,手动勾画出变化明显区域,仪器自动计算灰度变化值和灰度变化面积。
2.辐照后2 h 观察大体病理和药物浓度。每组均处死10 只裸鼠,取肿瘤组织行TTC 染色先肉眼观察,后组织切片行HE 染色于显微镜下观察肿瘤细胞坏死情况。然后肿瘤组织作组织匀浆,高效液相色谱检测各组瘤内HCPT浓度。
3.辐照后48 h 行免疫组化检测肿瘤细胞增殖和凋亡情况。每组再处死10 只裸鼠,取肿瘤组织切片行PCNA 和TUNEL 染色。显微镜下人工计数视野下染棕黄色细胞数,计算细胞增殖率和凋亡率。
4.辐照后2 周观察肿瘤的生长和远处转移情况。处死各组剩余裸鼠,测量肿瘤大小,并取主要脏器观察肿瘤转移情况。
六、统计学处理
应用SPSS 18.0 统计软件,正态分布的计量资料以表示,各组间比较采用单因素方差分析,两两比较行LSD 法;非正态分布的计量资料比较行Mann-WhitneyU秩和检验。P<0.05 为差异有统计学意义。
结 果
一、各组肿瘤灰度变化比较
HIFU辐照后即刻,超声示A、B组辐照区域几乎无灰度变化,C、D组均见明显灰度变化,其灰度变化面积和变化值与A、B组比较,差异均有统计学意义(均P<0.05);C、D组间比较差异无统计学意义。见图1和表1。
二、各组瘤内药物浓度比较

图1 各组裸鼠肿瘤HIFU辐照前后超声图像
表1 各组肿瘤观察指标比较()
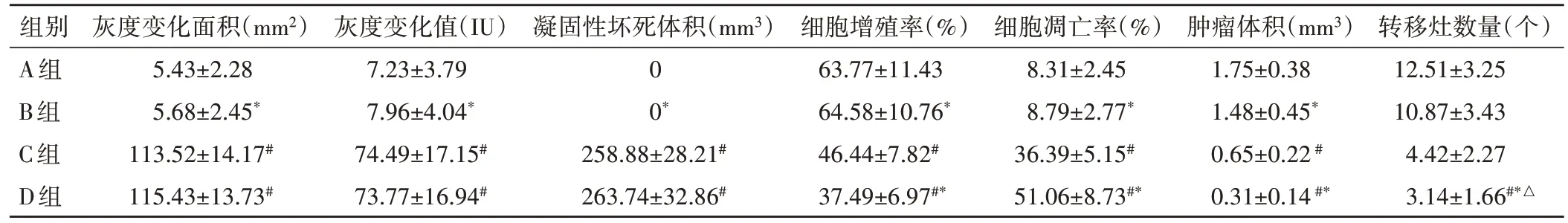
表1 各组肿瘤观察指标比较()
与A组比较,#P<0.05;与B组比较,△P<0.05;与C组比较,*P<0.05
组别A组B组C组D组转移灶数量(个)12.51±3.25 10.87±3.43 4.42±2.27 3.14±1.66#*△灰度变化面积(mm2)5.43±2.28 5.68±2.45*113.52±14.17#115.43±13.73#灰度变化值(IU)7.23±3.79 7.96±4.04*74.49±17.15#73.77±16.94#凝固性坏死体积(mm3)0 0*258.88±28.21#263.74±32.86#细胞增殖率(%)63.77±11.43 64.58±10.76*46.44±7.82#37.49±6.97#*细胞凋亡率(%)8.31±2.45 8.79±2.77*36.39±5.15#51.06±8.73#*肿瘤体积(mm3)1.75±0.38 1.48±0.45*0.65±0.22#0.31±0.14#*
A、C组肿瘤组织匀浆内均未测得HCPT,B、D组测得HCPT浓度分别为(0.50±0.14)mg/ml、(1.20±0.42)mg/ml,差异有统计学意义(P<0.05)。
三、病理结果比较
1.大体病理:辐照后2 h,A、B 组肿瘤内均无明显凝固性坏死,呈均匀红色;C、D组肿瘤内均可见明显凝固性坏死,边界清楚,呈灰白色,C、D 组坏死范围与A、B组比较差异均有统计学意义(均P<0.05)。辐照后2周,A、B 组肿瘤体积均明显增大,与C、D 组比较差异均有统计学意义(均P<0.05)。各组均见不同部位(肝、腹腔、肺、脑)的肿瘤转移,A、B、C、D 组转移灶数量分别为(12.51±3.25)个、(10.87±3.43)个、(4.42±2.27)个、(3.14±1.66)个,D 组与A、B、C 组比较差异均有统计学意义(均P<0.05)。见表1和图2。
2.组织病理:辐照后2 h,病理示C、D 组靶区细胞大片坏死,细胞结构破坏,呈不规则红色,与未坏死的肿瘤细胞边界清楚。辐照后24 h,免疫组化示D 组增殖率最低,凋亡率最高,与A、B、C 组间比较差异均有统计学意义(P<0.05)。见表1和图3。

图2 各组裸鼠肿瘤HIFU辐照后大体图
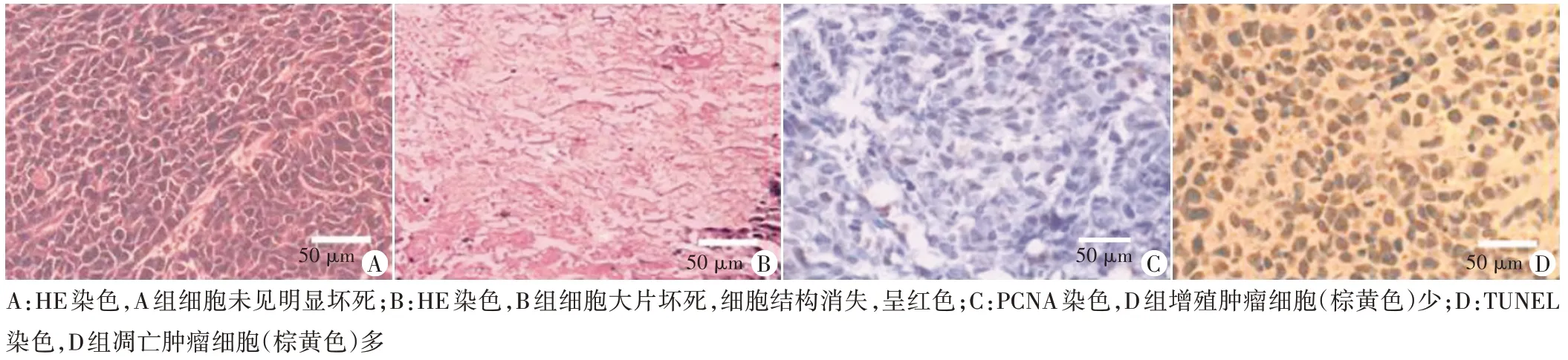
图3 裸鼠肿瘤HIFU消融后病理图(×400)
讨 论
HIFU通过聚焦超声能量来消融和破坏肿瘤组织,已应用于临床原发性实体瘤及转移性肿瘤的治疗。然而,在面对位置较深、体积较大的肿瘤(如肝癌、胰腺癌等)时,由于沿超声途径的能量快速衰减,治疗效果欠佳,限制了其临床应用。研究[3]证实微泡可以改变组织的声环境,通过增加超声空化作用可增强HIFU消融的效果,但其受微泡不稳定、循环时间短、粒径大等因素影响,尤其作为血池显影剂,其在增效HIFU 的同时可能导致能量在焦域近场沉积,甚至因坏死区变形成为近大远小的“蝌蚪形”,从而导致消融灶不可控,可能存在焦点前加热和周围组织损伤。在此背景下,基于各种纳米系统的相变超声造影剂应运而生[1-4],广泛应用于HIFU增效。经静脉注射后,相变造影剂粒径足以通过血管内皮间隙在肿瘤组织内存留,在HIFU 能量作用下,其可在靶区原位产生微泡,增加HIFU 能量沉积,降低HIFU 作用功率、缩短治疗时间、增加消融范围,最终达到增强HIFU 治疗效果,且此“从小到大、原位相变”的策略还有利于避免微泡增效HIFU 引起焦点外损伤的缺陷[1,3]。本实验所用 HIFU能量为120 W,作用时间为5 s,这一能量不足以消融肿瘤,故A、B 组辐照后肿瘤并无灰度变化和细胞凝固性坏死,而注射了靶向相变造影剂的C、D 组辐照后均提示肿瘤灰度变化和细胞凝固性坏死。
为了增加相变纳米粒在肿瘤细胞周围的蓄积以增效HIFU,包载具有主动靶向能力的叶酸受体相变纳米粒是可供选择的方式之一。本课题组前期研究[6-7]中制备了包载10-HCPT 的叶酸受体靶向相变造影剂,并证实其能够较好地黏附在肿瘤细胞周围。本课题组另一研究[3]也发现叶酸受体靶向的相变造影剂可在肿瘤内靶向沉积,与非靶向的相变造影剂相比,HIFU消融后肿瘤坏死范围增大,肿瘤细胞增殖率降低而凋亡率升高。但无论采取何种增效方式,HIFU消融后肿瘤残余、复发和转移均是难以避免的问题[2,8-9]。
本实验制备的靶向载药相变纳米粒FR-HCPTPNPCA,将基于超声靶向破坏微泡技术[10]的肿瘤靶向给药系统融入HIFU 消融和增效中,结果显示,D 组肿瘤内FR-HCPT-PNPCA 沉积,在HIFU 辐照后可破坏微泡定向释放HCPT,不仅消融范围扩大、肿瘤细胞增殖率最低、凋亡率最高,且肿瘤生长缓慢、转移灶最少,由此可见该方法对肿瘤的远期疗效最好。A 组为生理盐水+HIFU 辐照,既往研究[3]表明,低剂量 HIFU辐照不足以引起肿瘤细胞明显坏死。B 组为注射HCPT+HIFU 辐照,治疗效果欠佳,C 组 HIFU 辐照后即刻肿瘤灰度变化和坏死体积与D组比较差异均无统计学意义,但辐照2 周后疗效低于D 组(P<0.05)。究其原因可能为:①HIFU 能量低,HCPT 溶液不能增效HIFU;②注射的HCPT 单体容易通过代谢清除,可能降低抑瘤效果;③靶向相变造影剂有利于增加HIFU能量在靶区沉积,故辐照后短时间内C、D 组效果差异无统计学意义。本实验中D 组的肿瘤组织HCPT 浓度高于B 组(P<0.05),原因为纳米材料在肿瘤蓄积,在HIFU 作用下,既发生了相变(靶区灰度变化证实),又破坏相变微泡释放HCPT(瘤内药物浓度证实),达到了超声靶向破坏微泡联合肿瘤靶向给药的作用,C、D 组间肿瘤细胞增殖率和凋亡率的差异也能解释两组间远期疗效的差异,但其相关机制和最佳释放药物条件(如持续辐照或者间歇辐照、辐照时间的优化等)有待今后进一步研究。
本实验的局限性:仅在既往研究[3]结果证实的基础上应用同一剂量进行HIFU 消融,未针对不同能量、时间、消融方式等进行分组,待以后进一步研究以确定更有效地消融和释放药物,获得最佳的治疗效果。
综上所述,本实验制备的FR-HCPT-PNPCA 既是一种高效的HIFU 增效剂,又是一种协同HIFU 消融的靶向药物,二者联合能显著增强HIFU 的消融疗效和生物安全性,有望为肿瘤治疗提供一种精准、高效的手段。

