磁性氧化石墨烯的制备及其对沙门氏菌荧光探针的猝灭机理
刘丽莉,孟圆圆,杨晓盼,代晓凝,郝威铭1
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.食品加工与安全国家级教学示范中心,河南 洛阳471023)
石墨烯是由单层碳原子以 sp2方式杂化并有序排列堆积而成的新型二维蜂窝状原子晶体[1],因其结构独特,使石墨烯具有优良的热导性、吸附性、化学稳定性等物理化学特性,但石墨烯在溶剂中分散性较差且易团聚[2-3]。氧化石墨烯(GO)是石墨烯的衍生物,其表面含有丰富的羟基、环氧基和羧基等亲水基团,在一定程度上改善了石墨烯的分散性、水溶性及生物相容性[4-5]。为进一步扩大GO 的应用范围,将GO 与Fe3O4等磁性纳米颗粒相结合,制备的磁性氧化石墨烯复合材料因更具有优良特性而成为当前研究的热点。
Fe3O4/GO集磁性纳米材料和GO的优良特性于一体[6],不仅具有较强的超顺磁性,还拥有对荧光的猝灭作用及对DNA 单链强烈的吸附能力[7-8]。已报道的Fe3O4/GO 的制备方法有水热法、微乳液法、溶胶-凝胶法、水解法、化学共沉淀法等。利用Fe3O4/GO 所建立的检测方法操作简便、成本较低、特异性好、灵敏度高。杨宇等[9]将Fe3O4/GO 作为荧光猝灭剂,利用磁性富集荧光法分离大肠埃希菌O157∶H7,从而实现对其高灵敏检测。LI 等[10]以萘酰亚胺衍生物标记富含胸腺嘧啶(T)的 ssDNA,以 Fe3O4/GO 为猝灭剂和预浓缩剂,建立了一种检测汞(II)的荧光法。但以上Fe3O4/GO 的制备方法仍存在对设备要求高、粒子结晶性能差、产量低、影响因素多等缺点。目前,关于 Fe3O4/GO 制备表征后在沙门氏菌荧光猝灭方面的应用尚少见报道。本研究中,采用改进后的化学共沉淀法制备Fe3O4/GO,并对其结构进行表征,以达到降低成本、操作简单、提高荧光猝灭率的效果;利用Fe3O4/GO 的顺磁性、荧光猝灭效应及对 DNA 单链强烈的吸附能力等优良特性,及荧光探针具有选择性好、灵敏度高和成本低等优点,探究 Fe3O4/GO 对沙门氏菌荧光探针的猝灭作用,得出 Fe3O4/GO 猝灭沙门氏菌荧光探针的速率常数(kq)、结合常数(K),以进一步探讨其荧光猝灭机理,并对 Fe3O4/GO 荧光探针复合物的选择性进行研究,以期建立一种基于荧光标记DNA结合 Fe3O4/GO 荧光猝灭效应快速检测沙门氏菌的新方法,减少由沙门氏菌所引起的食品中毒事件的发生及对人和动物生命健康造成的危害。
1 材料与方法
1.1 材料与试剂
氧化石墨烯,由南京先丰纳米材料科技有限公司生产;溴化钾,分析纯,由上海一研生物有限公司生产。
FeCl3、FeCl2,由天津市福晨化学试剂厂生产;氨水,分析纯,由上海强顺化学试剂有限公司生产;无水乙醇,分析纯,由天津市德恩化学试剂有限公司生产。所有沙门氏菌 DNA 碱基序列由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 沙门氏菌DNA 序列的设计
根据文献[11-12],采用Primer Premier 5.0 设计沙门氏菌DNA 碱基序列,并用Ribosomal Database Project II和NCBI Blast 2数据库提供的Probe Match检测序列的特异性。设计的沙门氏菌DNA 序列如表1 所示。
1.2.2 Fe3O4/GO 的制备
在刘闯[13]的方法上作适当改进。采用化学共沉淀法制备Fe3O4/GO,分别取2 g FeCl3和1 g FeCl2加入到100 mL 灭菌超纯水中,超声处理2 h,得溶液A;取0.3 g GO 加入到100 mL 灭菌超纯水中,超声处理4 h,得溶液B;将以上2 种溶液进行混合,加入30%氨水,将溶液pH 调整为9~10 左右,置于水浴锅中加热到 90 ℃,同时搅拌至混合物颜色完全变黑,将其从水浴锅中取出,自然冷却到室温,置于离心机中离心5 min(10 000 r/min),得到黑色固体,用灭菌超纯水和无水乙醇洗涤数次至混合物上清液的pH 为7 左右,再将黑色固体置于70 ℃的干燥箱中烘干,即可制得Fe3O4/GO。
1.2.3 Fe3O4/GO 溶液的配置
取一定质量的Fe3O4/GO 加入到灭菌超纯水中,放入超声波清洗仪中进行超声,直到 Fe3O4/GO 完全分散到水中为止;再将超声后的 Fe3O4/GO 分别稀释成 4×10−5、8×10−5、1.2×10−4、1.6×10−4、2.0×10−4、2.4×10−4、2.8×10−4、3.2×10−4、3.6×10−4g/mL 不同质量浓度的溶液。
1.2.4 GO 和Fe3O4/GO 的结构表征
1) 扫描电镜(SEM)和透射电镜(TEM)分析。分别取微量的GO 和Fe3O4/GO 待测样品,用导电银胶将待测样品粘到样品台上,并将其置于扫描电子显微镜下对其形貌进行表征;分别将 GO 和Fe3O4/GO 粉末通过超声制成分散液,取1~2 滴分散液于碳支持膜的铜网格上,再放在干燥的滤纸上自然干燥后将其置于JEM 2100 型透射电镜上,观察其形貌并摄像。
2) X 射线衍射(XRD)分析。在党志敏[14]的方法上作适当改进。采用粉末衍射法,分别取适量的GO 和Fe3O4/GO 待测样品于研钵中研细,置于样品台上,放入X 射线衍射仪中,对待测样品进行表征。采用 Cukα辐照(λ=0.154 nm),管压 40 kV,管流 30 mA,2θ 值为 5°~80°。
3) 傅里叶变换中远红外(FT-IR)分析。采用KBr 压片法制样,将待测样品与干燥后的 KBr 按1∶100 进行混合,并置于玛瑙研钵中,研磨均匀后进行压片,在压强约为15 MPa 的条件下保持1 min,即可得到样品薄片。对KBr 薄片作背景扫描,再对样品薄片进行扫描,设置扫描范围为400~4000 cm−1[14]。
1.2.5 荧光猝灭机理分析
1) 荧光光谱分析。分别取上述不同质量浓度的Fe3O4/GO 与合成的50 nmol/L 沙门氏菌荧光探针进行混合,在四维旋转混匀器上37 ℃条件下孵育1 h,利用磁场磁力收集 Fe3O4/GO 荧光探针复合物,取上清液于荧光石英比色皿中,在激发波长495 nm、发射波长517 nm 条件下,采用荧光分光光度计进行荧光测定。为消除 Fe3O4/GO 纳米材料对荧光强度的遮蔽效应,以超纯水代替沙门氏菌荧光探针,在相同条件下,对不同质量浓度的 Fe3O4/GO 进行荧光测定。扣除自身荧光背景吸收,所测荧光强度△F=F-Ft(F 为加入沙门氏菌荧光探针时的荧光强度,Ft为未加入沙门氏菌荧光探针时的荧光强度)。
2) 紫外(UV)光谱分析。分别取 3.2×10−4g/mL质量浓度的GO 溶液、Fe3O4/GO 及Fe3O4/GO 荧光探针溶液置于紫外石英比色皿中,在 185~400 nm扫描范围内用紫外分光光度计进行测定,并扣除其背景吸收。
1.2.6 Fe3O4/GO 荧光探针复合物的选择性分析
分别吸取浓度为 1 pmoL/L 的沙门氏菌目标DNA 溶液和单碱基配错序列(MT1)、双碱基配错序列(MT2)、三碱基配错序列(MT3),加入到质量浓度为 3.2×10−4g/mL 的 Fe3O4/GO 荧光探针复合物溶液中,在 42 ℃条件下反应一定时间,以完成部分杂交,随后置于磁场中磁分离10 min,收集磁性颗粒,移除原溶液,取PBS 缓冲液清洗磁性颗粒,除去未反应的DNA。再吸取用PBS 缓冲液稀释的释放探针溶液加入到磁性颗粒中,富集5 倍,在42 ℃条件下反应 2 h,根据碱基互补配对原则完成杂交试验。完成杂交之后的DNA 双链将脱离Fe3O4/GO 表面,荧光恢复,再利用磁场磁性分离Fe3O4/GO,通过检测上清液的荧光强度变化,即对建立的纳米复合材料 Fe3O4/GO 荧光探针复合物采用检测沙门氏菌DNA 的方法进行选择性分析。
1.2.7 数据分析
每组试验重复3 次,取平均值。所有光谱图均扣除其背景吸收,采用Origin 8.5 对试验数据进行统计分析并绘图。
2 结果与分析
2.1 氧化石墨烯和磁性氧化石墨烯的结构表征
2.1.1 扫描电镜(SEM)和透射电镜(TEM)分析
由图1-a 扫描电镜图可知,GO 的形貌为层状结构,但也存在层面团聚现象,且有许多褶皱,可增大其比表面积,有利于负载磁性纳米粒子,这种特性可使GO 作为载体材料[15]。从图1-b 可以看出,与GO 相比,Fe3O4/GO 的结构发生了明显的变化,其表面形貌不规则且有很多粒径较小的白色粒子聚合[16]。从图1-c 可以看出,GO 为不规则片状结构,表面光滑,上面有部分褶皱,具备作为载体的优势。由图1-d 可知,Fe3O4的粒径为10~20 nm,且均匀地附着在GO 表面,表明化学共沉淀法制备的Fe3O4/GO 具有良好的结构。
2.1.2 X 射线衍射(XRD)分析
图 2 为 GO 和 Fe3O4/GO 的 XRD 图。两者都出现了特征衍射峰,但其位置明显不同。由a 曲线可知,在2θ 为11.54°处出现的强峰对应着GO 特征衍射峰;由 b 曲线可知,在 2θ 为 30.44°、35.53°、43.21°、53.55°、57.14°、63.09°处的特征衍射峰,分别与Fe3O4纯立方尖晶石晶体结构中(220)、(331)、(400)、(422)、(511)和(440)的位置相对应[7,16]。其中,2θ为 30.44°、35.53°、43.21°、57.14°处的衍射峰属于具有磁性的磁赤铁矿(maghemite)或磁铁矿(magnetite),在 2θ 为 53.55°和 63.09°处的衍射峰属于赤铁矿(hematite),这与前面的表征相一致,说明所制备的Fe3O4/GO 中含有Fe3O4晶体[7,17]。

图2 GO 和Fe3O4/GO 的X 射线衍射结果Fig.2 X-ray diffraction results of GO and Fe3O4/GO
2.1.3 傅里叶变换中远红外(FT-IR)分析

图3 GO 和Fe3O4/GO 不同波数的红外光透过率Fig.3 Infrared t ransmittance of G O and F e3O4/GO w ith different wave numbers
由图3 可知,GO 和Fe3O4/GO 的红外光图谱存在差异,说明两者结构之间存在一定的差异。由 a曲线可知,GO 在3414.10 cm−1处出现一个强吸收峰,可能是由于—OH 的伸缩振动引起的[16];在1730.01 cm−1和1623.44 cm−1处出现了芳香基C==O和C==C 的特征吸收峰,在1403.42 cm−1、1230.54 cm−1和 1055.96 cm−1处出现的吸收峰可能是由C—OH、O—C—O 和烷氧基C—O 的伸缩振动引起的,说明 GO 结构中含有 C==O、—OH、C==C、O—C—O 等官能团。由 b 曲线可知,Fe3O4/GO在 3424.58 cm−1和 1190.76 cm−1处出现了—OH 和O—C—O 的伸缩振动峰,在1574.75 cm−1处C==C的特征吸收峰明显减弱,1042.81 cm−1处的烷氧基C—O 的吸收峰几乎消失,在589.31 cm−1指纹区出现了Fe-O 的伸缩振动峰,说明含氧官能团与Fe3O4磁性纳米粒子发生了化学键合作用[18],证明 Fe3O4磁性纳米粒子已附着在GO 表面,Fe3O4/GO 已成功合成。
2.2 荧光猝灭机理初探分析
2.2.1 荧光光谱分析
由图4-A 可知,在未加入Fe3O4/GO 时,沙门氏菌荧光探针在495 nm 激发波长下,其荧光发射峰在517 nm 处;当沙门氏菌荧光探针浓度为50 nmol/L时,扣除 Fe3O4/GO 的背景吸收后,其荧光强度F=944.92;由图4-B 可知,固定沙门氏菌荧光探针浓度(50 nmol/L)不变,当向其溶液中加入不同质量浓度的 Fe3O4/GO 后,沙门氏菌荧光探针的荧光被猝灭,且随着 Fe3O4/GO 质量浓度的增加,其荧光强度逐渐减小,荧光猝灭率逐渐增大;当Fe3O4/GO质量浓度为 3.2×10−4g/mL 时,其荧光猝灭率可达96.86%,表明 Fe3O4/GO 对沙门氏菌荧光探针有强烈的荧光猝灭作用。由图 4-C、图 4-D 可知,在3.2×10−4g/mL 质量浓度下,Fe3O4/GO 对沙门氏菌荧光探针的荧光猝灭率高于GO,表明Fe3O4/GO 具有较好的生物相容性,对沙门氏菌荧光探针的荧光猝灭率较高。
2.2.2 紫外(UV)光谱分析
荧光猝灭通常可分为动态猝灭和静态猝灭 2 种类型:动态猝灭是猝灭剂与荧光团分子之间发生碰撞致使荧光强度降低的过程;静态猝灭是猝灭剂与荧光团形成不发光静态配合物,使得荧光强度降低的过程。荧光猝灭的类型与紫外吸收光谱密切相关,若为动态猝灭,其紫外吸收光谱不发生变化;若为静态猝灭,其紫外吸收光谱则发生相应的变化[19-20]。由图5 可知,沙门氏菌荧光探针的紫外吸收最强,Fe3O4/GO 的紫外吸收次之,Fe3O4/GO 沙门氏菌荧光探针的紫外吸收最弱,吸收峰红移且峰形变宽,可能是因为 Fe3O4/GO 与沙门氏菌荧光探针相互作用后,沙门氏菌荧光探针单链DNA 碱基上的C-N杂环与 Fe3O4/GO 碳六环结构之间存在π-π 堆积作用和静电引力作用而吸附在Fe3O4/GO 表面[21],产生了屏蔽效应,使其紫外吸收峰值减弱,吸收峰红移2 nm,说明形成了基态的Fe3O4/GO 沙门氏菌荧光探针复合物。而峰形变宽则是因为沙门氏菌荧光探针与Fe3O4/GO 之间存在着强烈的离子和π-π 堆积效应[22]。根据猝灭后发生变化的紫外吸收光谱,可初步判断 Fe3O4/GO 对沙门氏菌荧光探针的荧光猝灭属于静态猝灭。
2.2.3 Fe3O4/GO 对沙门氏菌荧光探针的猝灭机理
为了进一步判断荧光猝灭的类型,则需计算出荧光猝灭剂与荧光物质之间的动态荧光猝灭速率常数(kq)、结合常数(K)等[20]。若为动态猝灭,应符合 Stern-Volmer 方程[22-23]。
式(1)中:F0为未加入荧光猝灭剂时的荧光强度;F 为加入荧光猝灭剂后的荧光强度;[Q]为荧光猝灭剂浓度(g/mL);τ0为无荧光猝灭剂时的生物大分子平均荧光寿命,取τ0=10−8s[20];kq为动态荧光猝灭速率常数;Ksv为Stern-Volmer 动态猝灭常数。

根据不同温度下Fe3O4/GO 的荧光猝灭光谱图,可得 F0/F-[Q]的 Stern-Volmer 关系图,如图 6 所示。

图 6 Fe3O4/GO 对沙门氏菌荧光探针的荧光猝灭Stern-Volmer 结果Fig.6 Fluorescence que nching S tern-Volmer r esults o f Fe3O4/GO against salmonella fluorescent probe
若猝灭类型为静态猝灭,应符合 Lineweaver-Burk方程[24]。

式(3)中,K 为静态荧光猝灭结合常数,单位为mL/g。根据不同温度下Fe3O4/GO 的荧光猝灭光谱图,可得(F0-F)−1-[Q]−1的 Lineweaver-Burk 关系图,如图7 所示。
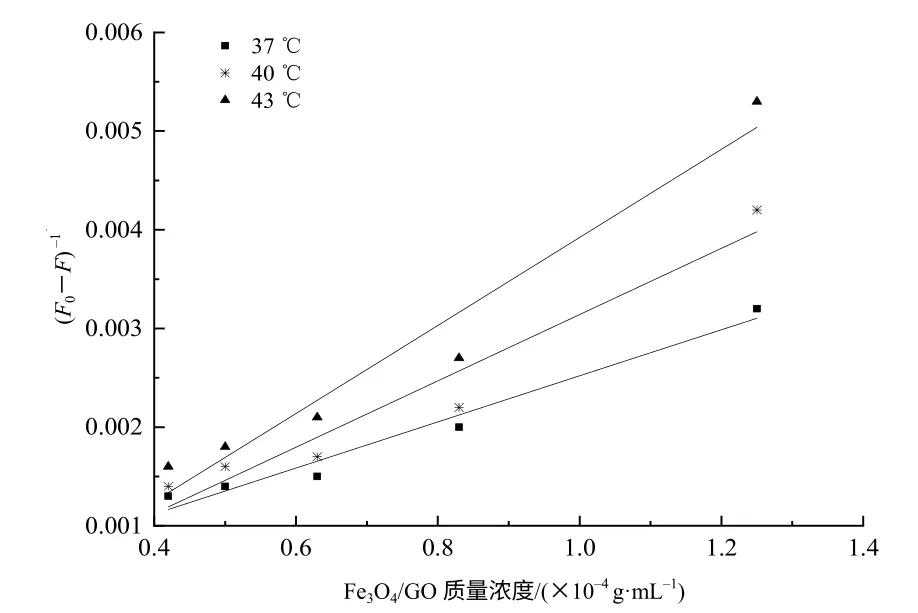
图 7 Fe3O4/GO 对沙门氏菌荧光探针的荧光猝灭Lineweaver-Burk 结果Fig.7 Fluorescence quenching of the salmonella fluorescent results by Fe3O4/GO Lineweaver-Burk plot
由图6、图7 及式(1)、(2)、(3)可分别求得不同温度下 Fe3O4/GO 与沙门氏菌荧光探针的 Ksv、Kq和K 值,如表2 所示。
若荧光猝灭过程为动态猝灭,在一定温度范围内,其分子活化能随温度的升高而不断增大,增加了荧光猝灭剂与荧光分子团之间的有效碰撞,从而加快荧光猝灭速率,使得Stern-Volmer 直线斜率、Ksv及Kq值均增大。由图6、表2 可知,F0/F 与[Q]呈良好的线性关系,随着温度的升高,Stern-Volmer直线斜率、Ksv及 Kq值均减小。在 37、40、43 ℃时,Fe3O4/GO 与沙门氏菌荧光探针的 Kq分别为1.58×1012、9.00×1011、7.25×1011mL/(g·s),故其 Kq值大于动态猝灭中的最大扩散碰撞猝灭常数[20],初步证明了 Fe3O4/GO 对沙门氏菌荧光探针的猝灭过程不是动态猝灭。

表2 不同温度下Fe3O4/GO 与沙门氏菌荧光探针相互作用常数Table 2 Interaction constants of Fe3O4/GO and salmonella fluorescent probes at different
由图 7、表 2 可知,(F0-F)−1与[Q]−1呈良好的线性关系,随着温度的升高,Lineweaver-Burk 直线斜率增大,结合常数 K 减小,这与 Lineweaver-Burk方程相符合。说明Fe3O4/GO 对沙门氏菌荧光探针的荧光猝灭不是由荧光猝灭剂与荧光分子之间的碰撞所引起的动态猝灭,而是由于两者之间发生非辐射能量转移生成复合物所引起的静态猝灭[20]。由表 2可知,其结合常数K 较大,说明Fe3O4/GO 与沙门氏菌荧光探针之间所形成的复合物较稳定,这是由于沙门氏菌荧光探针单链DNA 碱基上的C-N 杂环能与Fe3O4/GO 碳六环结构之间存在π-π 堆积作用而吸附在 Fe3O4/GO 表面[21]。
2.3 Fe3O4/GO 沙门氏菌荧光探针复合物的选择性分析
为了验证 Fe3O4/GO 沙门氏菌荧光探针复合物的选择性,分别对相同浓度的沙门氏菌 DNA 序列和单碱基配错序列(MT1)、双碱基配错序列(MT2)和三碱基配错序列(MT3)进行荧光强度测定,结果如图8 所示,MT1、MT2 和MT3 的荧光强度远低于沙门氏菌 DNA 序列所对应的荧光强度,说明所建立的 Fe3O4/GO 荧光探针复合物检测沙门氏菌DNA 具有良好的选择性。

图8 Fe3O4/GO 沙门氏菌荧光探针复合物的荧光强度Fig.8 Fluorescence i ntensity of Fe 3O4/GO salm onella flu orescent probe complex
3 结论
本研究中,以 GO 为载体,采用化学共沉淀法制备了Fe3O4/GO,并分别采用SEM、TEM、XRD、FT-IR 对GO 和Fe3O4/GO 的结构进行了对比表征;在此基础上,分析了Fe3O4/GO 对沙门氏菌荧光探针猝灭的机理。结果表明:所制备的Fe3O4/GO 结构良好;Fe3O4/GO 具有荧光猝灭作用,当Fe3O4/GO 质量浓度为 3.2×10−4g/mL 时,荧光猝灭率可达96.86%;其猝灭机理为静态猝灭;结合常数K 较大,两者之间所形成的复合物较稳定,对沙门氏菌DNA的检测具有良好的选择性。可为下一步更深层次地探究其荧光猝灭机理提供依据,为后续利用Fe3O4/GO 对荧光的猝灭作用及磁分离技术在沙门氏菌及其他致病菌检测方面提供技术支撑。

