X 射线诱导非小细胞肺癌A549 细胞凋亡的适应性反应及相关miRNA 筛选的研究
余小玲 荣利 方芳 丁晓文 王洪胜 谢婷婷 牛东升 王小春 李珏
北京市化工职业病防治院北京市职业病防治研究院科研部 100093
辐射适应性反应(adaptive response,AR)是靶物质(如细胞)先暴露于一个较低的辐射剂量,间隔一段时间后,再接受较大剂量(效应剂量)照射,靶细胞对大剂量照射引起的生物效应产生抵抗[1]。低剂量辐射诱导的AR 为当前放射生物学研究的热点。微RNA(microRNAs,miRNA)作为内源性非编码小RNA 分子,广泛参与调节细胞分化、增殖、凋亡及细胞免疫应答等重要生物过程[2]。有研究者发现,部分miRNA 通过调控DNA 双链断裂修复,抑制肿瘤细胞增殖和转移,增强肿瘤细胞的辐射敏感性[3-4];或通过调节细胞凋亡相关信号通路上下游分子影响电离辐射诱导的细胞凋亡,发挥生物功能[5-6]。尽管已有研究结果表明,miRNA 可以调节电离辐射生物效应,其在不同细胞中的表达水平与电离辐射敏感性有关,但目前尚未见辐射诱导AR 相关的miRNA 研究报道。辐射诱导AR 相关miRNA 研究及其调控机制的阐明,对辐射防护有一定理论参考价值,而且筛选到的miRNA 还可能作为生物标志物为临床肿瘤放射治疗方案的制定提供参考依据。本研究探索X 射线辐射诱导非小细胞肺癌(non-small-cell lung cancer,NSCLC)A549细胞凋亡的AR,并通过基因芯片筛选相关的miRNA,运用生物信息学分析miRNA 调控的靶基因及信号通路,初步探索辐射AR 的可能机制。
1 材料与方法
1.1 细胞培养
NSCLC A549 细胞购自中国医学科学院基础医学研究所细胞中心,培养代次为16~27 代。DMEM培养基、胎牛血清、0.25%胰酶均购自美国GIBCO公司。5×106个/瓶A549 细胞培养于含10%胎牛血清、10%青链霉素的(北京索莱宝科技有限公司)DMEM 完全培养基中,培养条件为37℃、5% CO2,培养24 h 后进行照射。
1.2 照射及实验分组
使用X 射线辐照仪[美国Precision X-ray(PXi)公司,型号X-RAY 225]进行细胞照射,剂量率分别为0.38 Gy/min(低剂量50、200 mGy 照射时源距96 cm)和0.96 Gy/min(效应剂量20 Gy 照射时源距60 cm)。将A549 细胞分为6 组,包括50 mGy+20 Gy、200 mGy+20 Gy、20 Gy、50 mGy、200 mGy照射组及对照组(0 Gy),前2 组细胞分别用50、200 mGy 初始剂量进行照射,培养6 h 后用20 Gy的效应剂量进行照射,同时,20 Gy、50 mGy、200 mGy 照射组分别用20 Gy、50 mGy、200 mGy进行照射,对照组不照射。
1.3 细胞凋亡的检测
采用碘化丙啶(PI)/Annexin-V 双染法(美国BD 公司)进行细胞凋亡检测。不同剂量照射A549 细胞后培养24 h,用0.25%胰酶进行消化,210×g离心5 min 后,用PBS 重悬细胞,洗2 次,用100 μL 1×Annexin V 缓冲液(美国BD 公司)重悬细胞。按照实验设计加入PI、Annexin-V 染料,4℃染色30 min。染色后加入PBS,4℃、210×g离心5 min,洗2 次,细胞用400 目尼龙膜过滤,用流式细胞仪(美国BD 公司Accuri C6 Plus 型)进行细胞凋亡的检测。
1.4 RNA 的提取及测序
用TRIzol 试剂(北京索莱宝科技有限公司)裂解照射后的A549 细胞,按照试剂盒的说明提取细胞总RNA。每个样本提取10 μg 总RNA,利用NanoDrop(美国LabTech 公司)进行RNA 质检。质检合格的样品用于后续miRNA 测序分析。使用Small RNA Sample Pre Kit(美国Illumina 公司)构建文库,利用miRNA 的3′及5′端特殊结构,直接将RNA 两端加上接头,反转录合成cDNA。进行PCR 扩增,电泳分离目标DNA 片段,切胶回收得到cDNA 文库。质检合格后的文库按照有效浓度进行HiSeq/MiSeq 测序。本研究miRNA 测序及前期数据分析均由天津诺禾致源公司完成。
1.5 生物信息学分析
对各样品中miRNA 进行表达量的统计,并用TPM(transcript per million)进行表达量归一化处理[7]。聚类图由cluster 3.0 软件生成,由总信号密度大于1000 的miRNA 生成。用火山图推断差异miRNA 的整体分布情况,从差异倍数和校正后的显著水平(q<0.05)进行评估,筛选差异miRNA[8-9],筛选条件为q<0.01、log2(差异倍数)>1。采用miRanda、RNAhybrid 软件对各比较组之间差异表达miRNA 靶基因进行预测,并对miRNA 靶基因进行基因本体(gene ontology,GO)功能注释分析。GO 富集分析方法为GO seq,其能准确地计算出GO 条目被候选靶基因富集的概率[10]。京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路显著性富集分析是以KEGG通路为单位,应用超几何检验,与整个基因组背景相比,找出在候选靶基因中显著性富集的通路[11]。对候选靶基因中显著性富集的信号通路采用Benjamini&Hochberg(BH)的方法对P值进行校正(P<0.05 为差异有统计学意义,即显著性富集)。
1.6 miRNA 表达水平验证
为了验证miRNA 测序结果,随机挑选10 个50 mGy+20 Gy 照射组和200 mGy+20 Gy 照射组差异表达趋势相同的miRNA,采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)验证其表达水平。使用SuperTaq 聚合酶(美国应用生物系统公司)和MicroRNAs qPCR SYBR Green 试剂盒(上海生工生物工程有限公司)进行检测。使用miRNA 特异性引物从总RNA 中扩增获取cDNA,其引物见表1。使用qRT-PCR 仪(美国应用生物系统公司 7500fast 型)进行分析。Ct 值被定义为荧光通过固定阈值的分数循环数。U6 作为内参基因,各组间的miRNA 相对表达水平用2-△△Ct计算[12]。
1.7 统计学分析
应用SPSS 20.0 软件进行统计学分析。符合正态分布的数据以±s表示,采用Welcht检验进行2 组间的比较。P<0.05 为差异有统计学意义。
2 结果
2.1 X 射线诱导A549 细胞凋亡的AR
50 mGy+20 Gy 照射组和200 mGy+20 Gy 照射组的A549 细胞早期凋亡率分别为(1.81±0.11)%和(2.17±0.19)%,低于20 Gy 照射组的(4.54±0.23)%,且差异均有统计学意义(均P<0.01);50 mGy 照射组、200 mGy 照射组的细胞凋亡率与对照组比较,差异均无统计学意义(t=1.165、0.078,均P>0.05)(图1)。以上结果表明,50 mGy和200 mGy 照射剂量的X 射线均能诱导A549 细胞凋亡的AR。

图1 X 射线照射后非小细胞肺癌A549 细胞的凋亡率 a 表示与20 Gy 照射组相比,差异均有统计学意义(t=10.680、8.006,均P<0.01)Figure 1 Apoptosis rate of non-small-cell lung cancer A549 cells after irradiated by X-rays
2.2 miRNA 表达谱的变化
本研究中50 mGy+20 Gy、200 mGy+20 Gy、20 Gy 照射组鉴定到的成熟miRNA 的个数分别为649、681、905 个,差异表达miRNA聚类分析热图见图2。与20 Gy 照射组相比,50 mGy+20 Gy照射组上调miRNA 有7 个、下调miRNA 有36个;200 mGy+20 Gy 照射组上调miRNA 有23 个、下调miRNA 有40 个(图3)。与20 Gy 照射组相比,50 mGy+20 Gy 照射组、200 mGy+20 Gy 照射组共同差异表达的miRNA 有1 个上调、15 个下调(表2)。
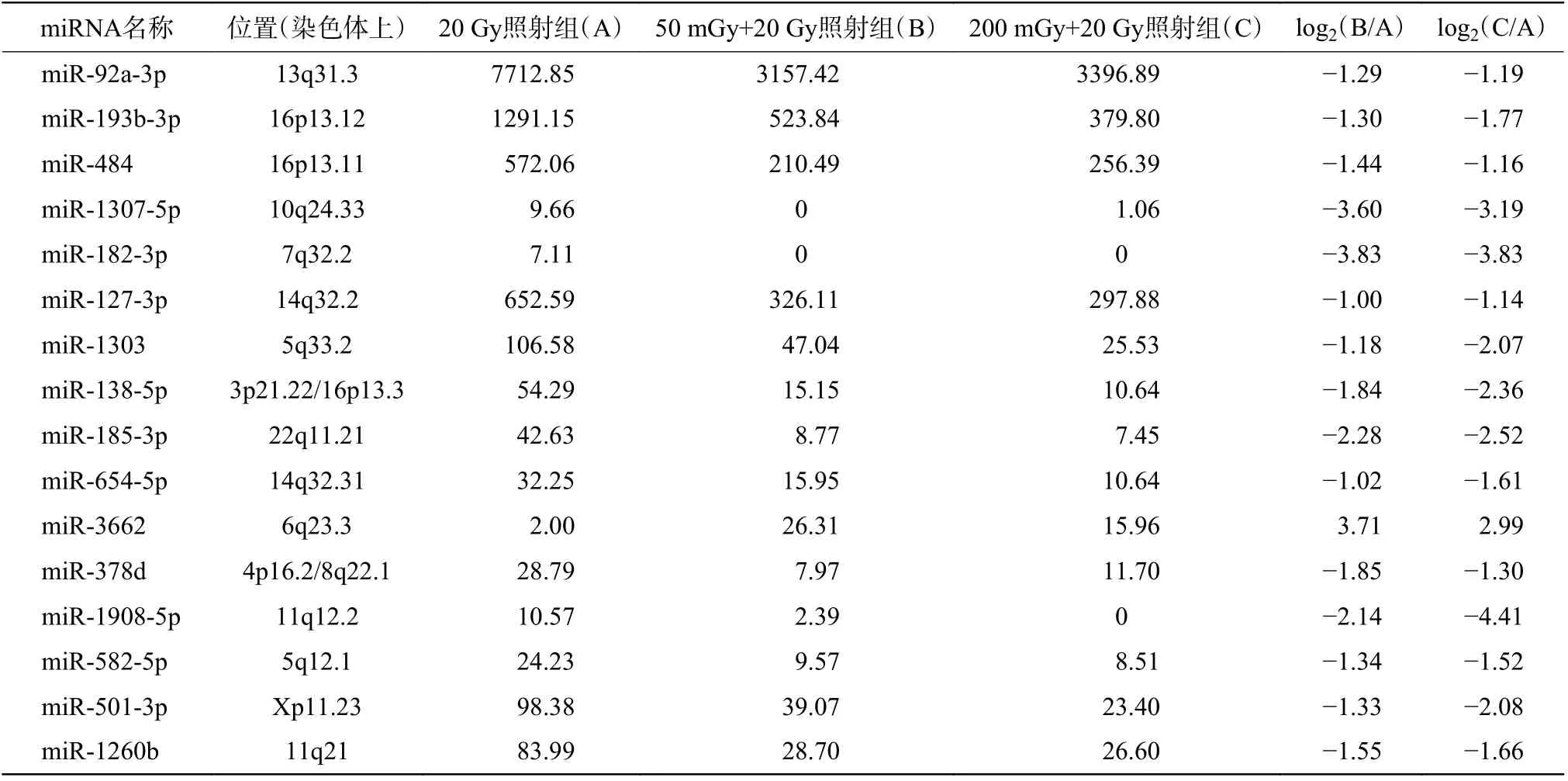
表2 X 射线照射后非小细胞肺癌A549 细胞的16 个差异表达的miRNATable 2 Sixteen microRNAs differentially expressed in non-small cell lung cancer A549 cells after X-ray irradiation
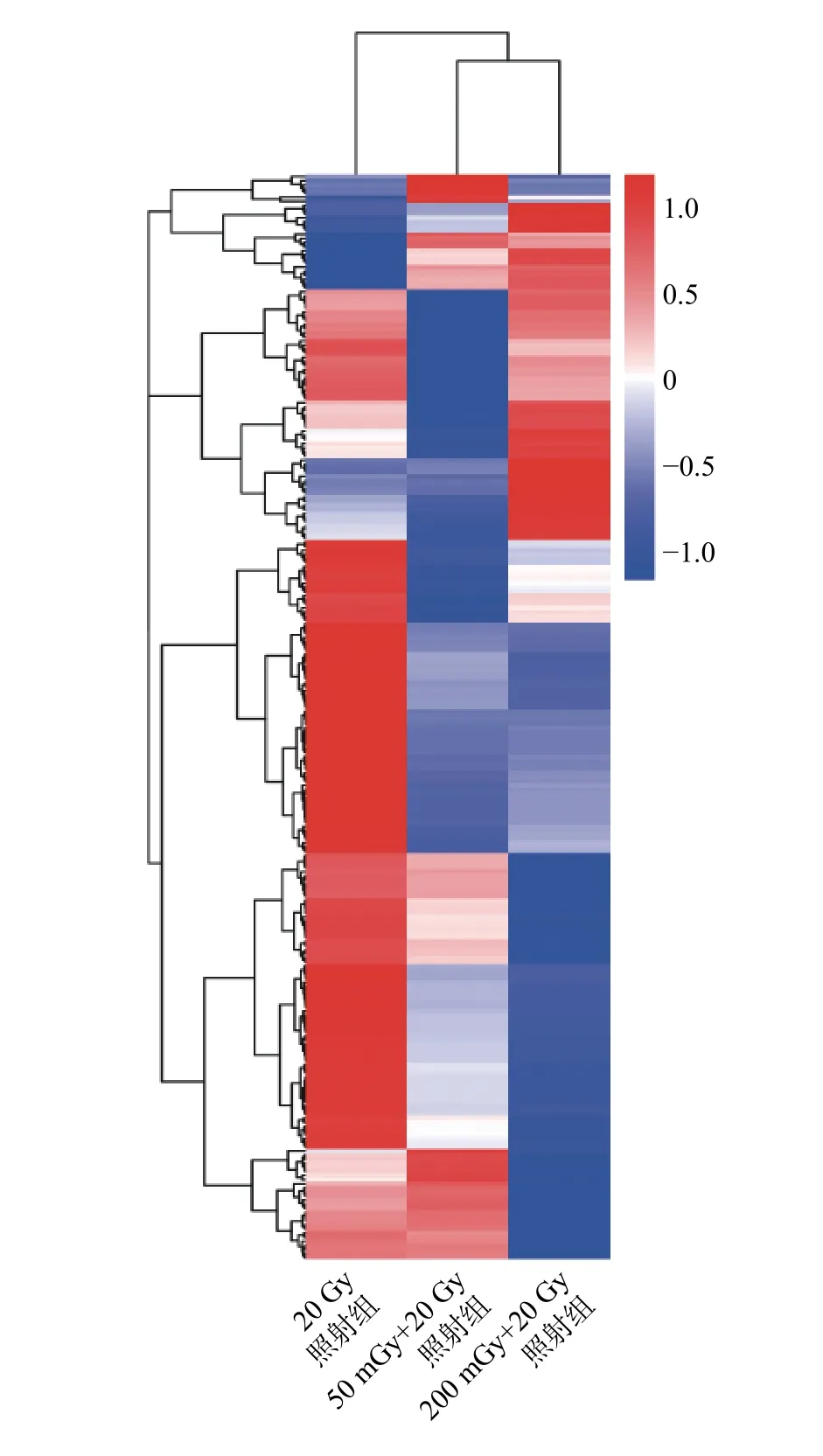
图2 X 射线照射后3 组非小细胞肺癌A549 细胞差异表达miRNA 的聚类分析热图 以log10(TPM+1)值进行聚类分析,红色表示高表达miRNA,蓝色表示低表达miRNA。miRNA 为微RNA;TPM 为transcript per millionFigure 2 The heatmap of unsupervised hierarchical clustering of microRNAs expression in three groups of non-small-cell lung cancer A549 cells after X-ray irradiation
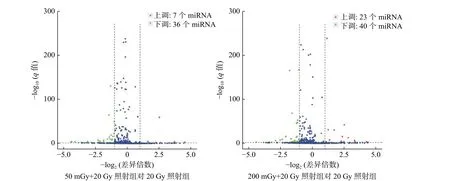
图3 X 射线照射后3 组非小细胞肺癌A549 细胞的差异miRNA 火山图 差异小分子RNA 筛选条件为q<0.01、log2(差异倍数)>1。miRNA 为微RNAFigure 3 The volcano plot of microRNAs expression in three groups of non-small-cell lung cancer A549 cells after X-ray irradiation
2.3 差异表达miRNA 调控靶基因的GO 富集分析
miRNA 靶基因进行GO 功能注释分析结果发现,共同差异表达miRNA 调控靶基因注释功能最多的是生物过程,其次为细胞组分及分子功能(表3)。对miRNA 调控的靶基因进行KEGG 信号通路分析,结果发现,共同差异表达miRNA 调控的靶基因显著富集于溶酶体、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、内吞作用、血管内皮生长因子信号通路、Ras信号通路和Rap1 信号通路等(图4)。
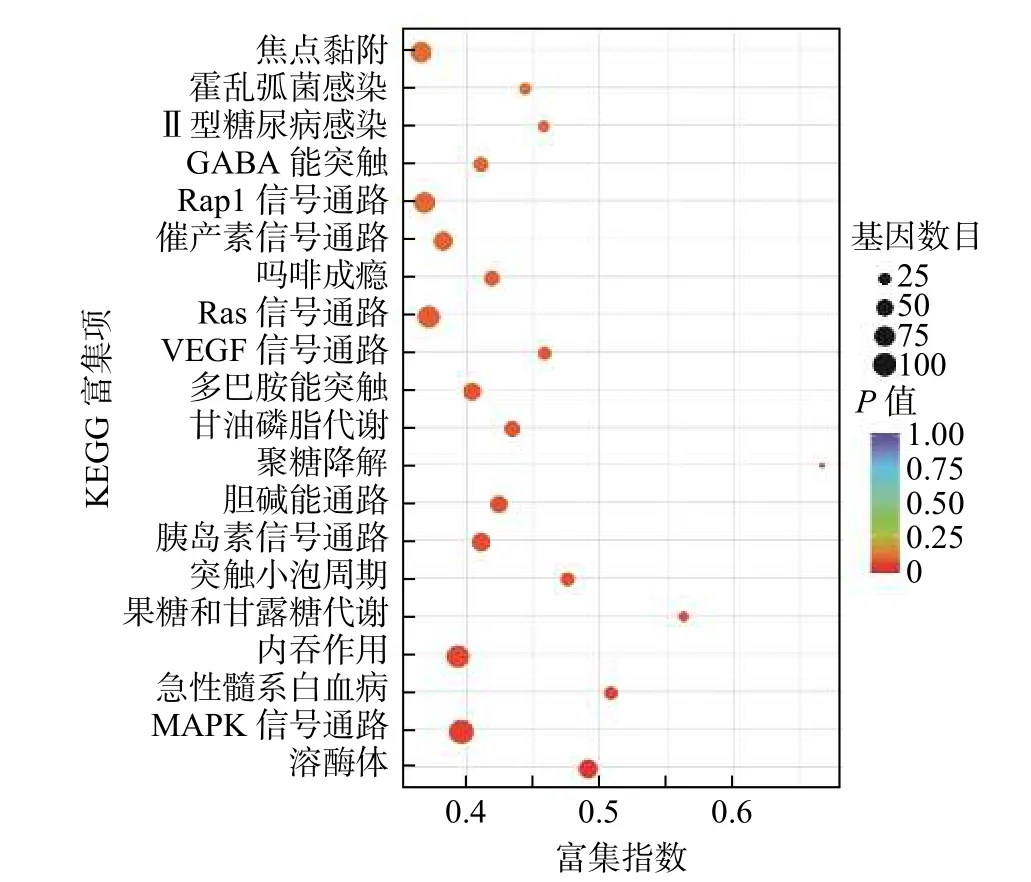
图4 KEGG 分析X 射线照射后非小细胞肺癌A549 细胞差异表达微RNA 调控靶基因的功能信号通路 富集指数为差异表达的基因中位于该通路条目的基因数目与所有有注释基因中位于该通路条目的基因总数的比值,其值越大,表示富集程度越大;P 值越小,表示富集程度越大。KEGG 为京都基因与基因组百科全书;GABA 为γ-氨基丁酸;VEGF 为血管内皮生长因子;MAPK 为丝裂原活化蛋白激酶Figure 4 Kyoto encyclopedia of genes and genomes analysis of functional signaling pathways of target genes regulated by differentially expressed microRNAs in non-small-cell lung cancer A549 cells after X-ray irradiation

表3 X 射线照射后非小细胞肺癌A549 细胞差异表达微RNA 调控靶基因的GO 富集分析(前15 位)Table 3 Gene ontology enrichment analysis of target genes regulated by differentially expressed microRNAs in non-small cell lung cancer A549 cells after X-ray irradiation (TOP 15)
2.4 qRT-PCR 验证差异表达miRNA 的表达水平
miRNA 表达情况与基因芯片结果趋势一致(图5)。50 mGy+20 Gy 照射组和200 mGy+20 Gy照射组共同表达上调的miR-3662 与20 Gy 组相比,差异均有统计学意义(t=10.55、5.97,均P<0.01)。芯片测序结果中下调的9 个miRNA,包括miR-185-3p、 miR-1908-5p、 miR-1307-5p、 miR-182-3p、 miR-92a-3p、 miR-582-5p、 miR-501-3p、miR-138-5P 及miR-1260b,在50 mGy+20 Gy 照射组均下调,且与20 Gy 照射组比较,差异均有统计学意义(t=15.64~39.83,均P<0.01)。200 mGy+20 Gy照射组miR-138-5P、miR-1260b 的表达水平与20 Gy照射组相当,其他7 个miRNA 表达水平均下调,且差异均有统计学意义(t=4.92~26.81,均P<0.05)。
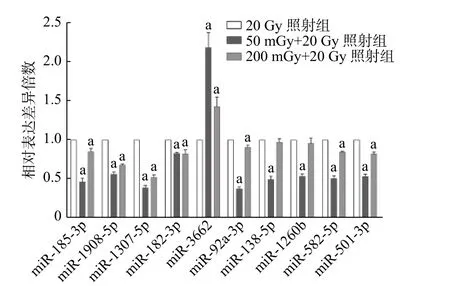
图5 X 射线照射后3 组非小细胞肺癌A549 细胞不同微RNA 的表达水平 a 表示与20 Gy 照射组相比,差异均有统计学意义(t=4.92~39.83,均P<0.05)Figure 5 Expression levels of different microRNAs in three groups of non-small-cell lung cancer A549 cells after X-ray irradiation
3 讨论
随着放射生物学研究领域的发展,低剂量电离辐射诱导的AR 越来越受到重视,并成为研究热点。目前,在动物活体及体外细胞实验均观察到低剂量辐射诱导的细胞凋亡及细胞周期的AR[13-14]。低剂量电离辐射诱导细胞凋亡的AR 涉及的分子生物机制十分复杂,因此,深入探讨低剂量电离辐射诱导细胞凋亡的AR 的规律和机制很有必要。本研究基于小RNA 测序技术筛选与X 射线辐射诱导细胞凋亡AR 相关的miRNA,初步探索辐射诱导细胞凋亡的AR 的可能机制。
据报道,行75 mGy X 射线(12.5 mGy/min)照射后,间隔3~24 h,再进行1.5 Gy(287 mGy/min)照射,可诱导体外EL-4 淋巴瘤细胞凋亡的AR[14]。Chen 等[15]研究发现,50 mGy α 粒子照射后可诱导NSCLC A549 细胞对后续750 mGy α 粒子照射产生放射抗性,即辐射AR。以往的研究结果显示,NSCLC A549 经8 Gy X 射线照射后,细胞凋亡率为4%~5%,为辐射不敏感细胞[16]。在本研究中,20 Gy X 射线照射后A549 细胞凋亡率为5%左右。本研究中初始剂量照射剂量率为0.38 Gy/min,且200 mGy 照射剂量也处于目前低剂量辐射定义的临界点[17]。这提示低剂量辐射诱导A549 细胞凋亡AR 与照射剂量及剂量率可能均有关。
miRNA 参与多种细胞分子功能的调节,细胞在接受电离辐射后,细胞内及血液中miRNA 表达水平均发生变化,这提示miRNA 在辐射生物效应的产生中发挥了重要调节作用,可能作为辐射生物效应产生的生物标志物[3-6]。本研究通过小RNA 测序在50 mGy+20 Gy 照射组和200 mGy+20 Gy 照射组筛选到16 个共同差异表达的miRNA,且qRT-PCR 对部分miRNA 的表达水平进行了验证。有研究结果表明,miR-3662 在肺腺癌中的表达水平升高,并通过调控细胞外信号调节激酶(ERK)和c-Jun 氨基末端激酶(JNK)信号通路抑制细胞增殖和诱导细胞周期阻滞[18]。另有研究结果显示,miR-3662 靶向于在健康肺组织中高表达的基因PTAR1、NPR3 和SEPT10。miR-3662 下调则促进细胞增殖、分化,进而发展为肺腺癌,因此在肺腺癌的诊断中有重要意义[19]。而本研究中miR-3662是在2 组产生凋亡AR 的细胞中唯一共同上调表达的miRNA,这提示miR-3662 可能在X 射线辐射诱导A549 细胞凋亡的AR 中发挥了重要作用。
2 组产生AR 的细胞中共同下调的miRNA 也在肺癌的发生、发展、转移中都发挥了重要的调控作用。例如,miR-182 在NSCLC 中与FBXW7、FBXW11 的表达水平呈负相关,其过表达可促进肿瘤细胞增殖、集落形成、细胞周期进展,同时可抑制肿瘤细胞凋亡[20]。另有研究结果表明,过表达miR-182 可通过调控RECK 基因的表达,增强NSCLC A549 和肺腺癌H1299 细胞的增殖、侵袭和迁移能力,从而促进NSCLC 的进展[21]。本研究中miR-182 在辐射诱导细胞凋亡AR 的NSCLC A549细胞中下调,这提示其可能在辐射诱导细胞凋亡的AR 机制中发挥了负向调节作用。
为进一步研究共同差异表达的miRNA 是否参与了辐射诱导细胞凋亡的AR 的发生,我们对这些miRNA 调控的靶基因进行功能注释及信号通路分析。结果显示,靶基因主要富集在溶酶体、MAPK信号通路、内吞作用、血管内皮生长因子信号通路、Ras 信号通路及Rap1 信号通路等。MAPK 及其家族蛋白质,包括胞外调节蛋白激酶、应激活化蛋白激酶等,广泛存在于哺乳动物细胞并参与细胞分化、增殖和凋亡等过程[22-23]。多项研究结果表明,靶向Ras-MAPK 信号通路的miRNA 在肿瘤发生中发挥重要作用。如miR-382、miR-34a 及miR-124 能通过调节MAPK 信号通路,抑制细胞黏附和细胞周期,并同时活化免疫系统相关通路[24-25]。Mutlu 等[26]发现,miR-564 通过ERK1/2磷酸化调节MAPK 信号通路,使细胞阻滞在G1期。有研究者发现,突变Ras 等位基因的表达可以改变肿瘤细胞的敏感性,并在暴露于电离辐射后增加其存活率。在一些Ras 活性和野生型P53 细胞系中,抑制MEK 可能通过P53 诱导而致放射增敏[27]。而单次高剂量辐射,可通过调节Ras/Raf/MEK/ERK 信号通路诱导细胞周期停滞和凋亡来介导其抗肿瘤作用[28]。本研究中miRNA调控的靶基因显著富集的MAPK、Ras 信号通路等有可能在低剂量辐射诱导细胞凋亡的AR 产生中有重要作用,有待在接下来的研究中进一步阐明。
在本研究中,我们发现低剂量X 射线能诱导NSCLC A549细胞凋亡的AR。并通过小RNA 测序筛选到一组差异表达的miRNA,其靶基因显著富集至MAPK、RAS 等信号通路。这提示筛选出来的miRNA 可能在低剂量辐射诱导的细胞凋亡AR 机制中发挥重要作用,可能成为辐射效应的重要生物靶标,作为生物标志物应用于临床肿瘤放射治疗。本研究不仅对放射生物学的研究具有理论意义,而且对辐射防护和临床医学肿瘤放射治疗具有一定实用价值。未来,我们将对筛选到的miRNA 在辐射诱导的AR中的调控机制进行深入研究,并在动物活体水平上进行验证。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 余小玲负责实验方法的建立和实施、数据的分析、文章的撰写;荣利、方芳负责实验的实施;丁晓文、王洪胜负责数据的分析;谢婷婷负责实验样本的准备、数据的整理;牛东升、王小春、李珏负责课题的设计和指导、论文的修订。

