基于网络药理学的淫羊藿增强免疫功能作用机制研究
梁彪 高家治 徐朝辉 王建东 施展







摘要 目的:通过网络药理学探讨淫羊藿增强免疫功能可能的作用机制。方法:通过中药系统药理学数据库与分析平台(TCMSP)检索淫羊藿的活性成分和靶点。利用Cytoscape 3.7.1软件构建“药物-活性成分-靶点”网络图。通过人类基因数据库(GeneCards)检索免疫抑制的相关靶点,利用STRING数据库进行蛋白质-蛋白质相互作用(PPI)网络分析,利用DAVID平台进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)富集通路分析。结果:筛选出淫羊藿21个有效活性成分,179个潜在靶点。GO生物过程共562条,包括信号转导、炎症反应、凋亡过程等;KEGG信号通路共120条,主要涉及癌症途径、MAPK信号通路、PI3K-AKT信号通路、TNF信号通路等。结论:淫羊藿的活性成分通过作用于AKT1、TP53、IL6、VEGFA等靶点,参与信号转导等生物過程,调控癌症途径、TNF信号通路等多个途径发挥增强免疫功能的作用。
关键词 淫羊藿;免疫功能;网络药理学;作用机制;成分;靶点;富集分析;信号通路
Study on the Mechanism of Herba Epimedii Enhancing Immune Function Based on Network Pharmacology
LIANG Biao,GAO Jiazhi,XU Zhaohui,WANG Jiandong,SHI Zhan
(Putuo Hospital,Shanghai University of Traditional Chinese Medicine,Shanghai 200062,China)
Abstract Objective:To explore the mechanism of Herba Epimedii to enhance immune function based on network pharmacology.Methods:The components and targets of Herba Epimedii were obtained by searching for Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform.Cytoscape 3.7.1 was used to build a network among drug,components and targets(drug-component-target network).Targets for immunosuppression were screened through GeneCards.Protein interaction network analysis was performed by using the STRING database.Gene ontology analysis and Kyoto encyclopedia of genes and genomes signal pathway enrichment analysis were performed by using the DAVID platform.Results:A total of 21 active ingredients and 179 potential targets of Herba Epimedii were screened.There were 562 GO biological process,including signal transduction,inflammatory response,apoptotic process,etc.There were 120 KEGG signaling pathways,including Pathways in cancer,MAPK signaling pathway,PI3K-AKT signaling pathway,TNF signaling pathway.Conclusion:The active ingredients of Herba Epimedii play a role in enhancing immune function by acting on AKT1,TP53,IL6,VEGFA and other targets,participating in biological processes such as signal transduction,regulating cancer pathways,TNF signaling pathways and other pathways.
Keywords Herba Epimedii; Immune function; Network pharmacology; Mechanism; Components; Target; Enrichment analysis; Signaling pathway
中图分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.23.011
淫羊藿又名仙灵脾,是临床常用补益类中药,根据《中华人民共和国药典》记载,淫羊藿具有补肾阳、强筋骨、祛风湿等功效,《神农本草经》记载:“味辛寒。主阴痿绝伤,茎中痛,利小便,益气力,强志……”并将其列为中品。研究表明,淫羊藿可以增强机体的免疫功能,对免疫器官、巨噬细胞、T淋巴细胞等均具有一定的影响[1]。目前关于中药及复方研究方法往往具有一定的局限性,难以更加全面地阐述其药效物质基础和作用机制。本研究运用网络药理学的研究方法,探讨淫羊藿增强免疫功能的潜在作用靶点及相关通路,以期为临床应用和进一步的实验研究提供一定的理论依据。
1 材料与方法
1.1 淫羊藿活性成分和靶点的收集
在中药系统药理学数据库与分析平台[2](Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,https://tcmspw.com/tcmsp.php,TCMSP)中,检索淫羊藿的活性成分及活性成分对应的靶点,时间截止至2020年11月20日。设置口服生物利用度(Oral Bioavailability,OB)≥30%,类药性(Drug Likeness,DL)≥0.18[3]作为筛选条件获得淫羊藿的活性成分,通过Uniprot数据库[4](https://www.uniprot.org)将淫羊藿的靶点进行规范。
1.2 “药物-活性成分-靶点”网络图的构建
将筛选得到的淫羊藿的活性成分和靶点整理成Excel文件,导入CytoScape3.7.1软件[5],構建“药物-活性成分-靶点”网络图,通过分析相关参数,对淫羊藿关键活性成分进行筛选。
1.3 免疫抑制相关靶点的收集及共同靶点的获取 在GeneCards数据库[6](https://www.genecards.org/)中,以“immunosuppression”为检索词进行检索并筛选,得到免疫抑制相关的疾病靶点。在Venny2.1.0在线作图平台(http://bioinfogp.cnb.csic.es/tools/venny/)获取淫羊藿与免疫抑制的共同靶点。
1.4 蛋白质-蛋白质相互作用(PPI)网络图的构建及核心靶点的筛选
将药物与疾病的共同靶点导入STRING数据库[7](https://string-db.org/),选择“multiple proteins”“Homo sapiens”,构建PPI网络图,并根据Degree值大小筛选核心靶点。
1.5 GO富集分析与KEGG通路富集分析
DAVID数据库[8-9](https://david.ncifcrf.gov/)能够对给定基因或蛋白质的生物学意义进行系统分析,将药物与疾病的交集靶点导入DAVID6.8数据库,进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析,进行GO分析时选择BP模块,KEGG分析选择PATHWAY模块。
2 结果
2.1 淫羊藿活性成分和靶点的收集
检索到淫羊藿130个活性成分,经过OB和DL参数初步筛选后共获得23个活性成分,剔除2个(MOL004394、MOL004425)未查询到靶点的活性成分,最终获得21个活性成分。见表1。检索得到对应的511个靶点蛋白,获取179个靶点基因。
2.2 “药物-活性成分-靶点”网络图的构建
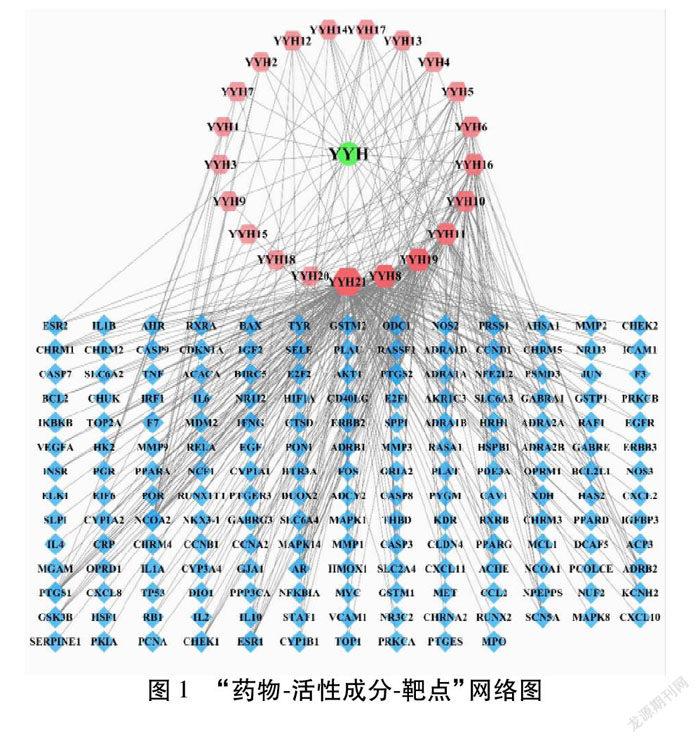
将筛选得到的淫羊藿21个活性成分、179个靶点基因,构建“药物-活性成分-靶点”网络图。见图1。网络图中“节点”(Node)代表属性类型,如化合物、靶点、药物、疾病等,“边”(Edge)代表交互关系,连接度(Degree值)越大,代表其重要性越大。网络图中共包括201个节点,405条边。图中红色节点代表活性成分,绿色节点代表药物,蓝色节点代表靶点基因。
网络分析结果可知,槲皮素、木犀草素等6种活性成分能与24个以上靶点连接,可认为这6种活性成分是淫羊藿的主要活性成分。见表2。
2.3 免疫抑制相关靶点的收集及共同靶点的获取 在GeneCards数据库检索免疫抑制的相关靶点,共检索到3 627个相关靶点,将筛选出来的179个药物靶点与3 627个疾病靶点在Venny2.1.0在线作图平台取交集得到138个共同靶点。见图2。
2.4 PPI网络图的构建及核心靶点的筛选
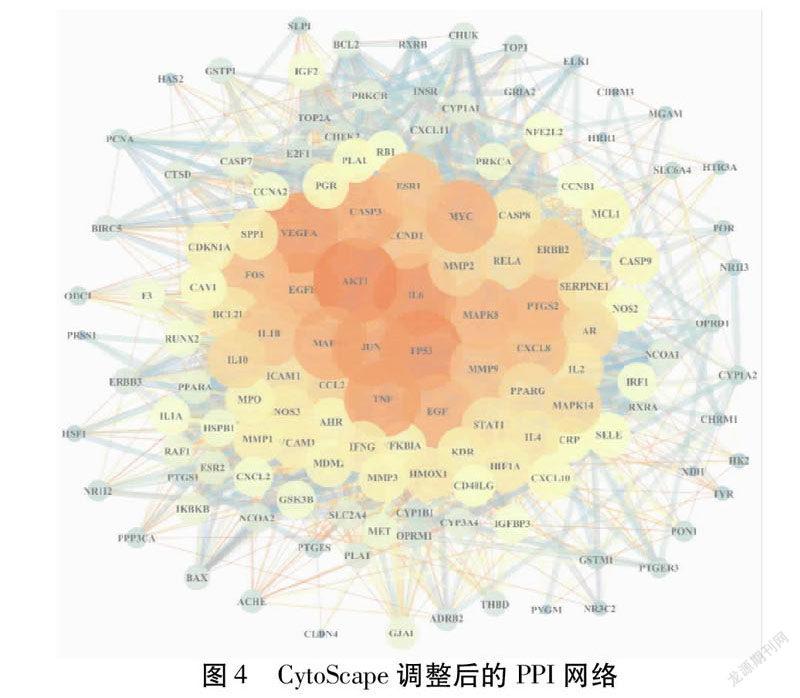
将筛选得到的138个共同靶点导入STRING数据库,置信度设置为>0.4,并剔除游离靶点,获得PPI网络图。见图3。再将STRING数据库中获得的相关数据导入CytoScape3.7.1软件,进一步调整得到PPI网络。见图4。每个节点(Node)代表1个靶点,边(Edge)代表靶点之间存在相互作用关系。根据Degree值的大小设置节点大小;Combined score值越大,边线颜色越粗且越深。研究结果显示,PPI网络图中共有137个节点,2 573条边,平均度值为37.5,大于平均度值的靶点有57个。见表3。Degree值排名前10位的靶点为AKT1、TP53、IL6、VEGFA、JUN、TNF、CASP3、MAPK1、MYC、EGFR,可认为这些靶点是淫羊藿增强免疫功能的潜在核心靶点。
2.5 GO富集分析与KEGG通路富集分析
GO富集分析共有562条结果,KEGG富集分析有120条信号通路。图5展示显著程度前20的GO生物功能富集结果。横轴代表该通路基因占所有基因的比率(Ratio),纵轴代表GO生物过程信息条目。气泡颜色由红到绿代表P值由小变大,P值越大代表显著性越强。气泡越大代表该通路的基因个数(Count值)越多。由图5可知,涉及的主要GO生物过程有RNA聚合酶Ⅱ启动子转录的正调控(Positive Regulation of Transcription from RNA Polymerase Ⅱ Promoter)、信号转导(Signal Transduction)、转录正调控,DNA模板(Positive Regulation of Transcription,DNA-templated)、凋亡过程的负调控(Negative Regulation of Apoptotic Process)、转录,DNA模板(Transcription,DNA-templated)、炎症反应(Inflammatory Response)、对药物的反应(Response to Drug)、基因表达的正调控(Positive Regulation of Gene Expression)、积极调控细胞增殖(Positive Regulation of Cell Proliferation)、凋亡过程(Apoptotic Process)等,表明淫羊藿可通过参与多个生物过程,从而发挥增强免疫功能的作用。KEGG通路富集分析结果见图6,主要包括癌症途径(Pathways in Cancer)、TNF信号通路(TNF Signaling Pathway)、PI3K-AKT信号通路(PI3K-AKT Signaling Pathway)、MAPK信号通路(MAPK Signaling Pathway)、Proteoglycans in cancer、HTLV-I infection、Influenza A、MicroRNAs in cancer等。
2.6 “基因-通路”网络图的构建
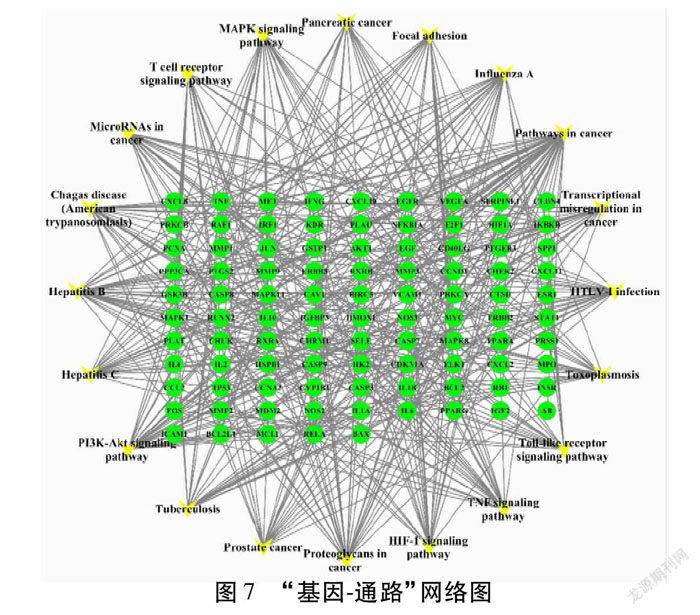
根据KEGG分析结果,将较显著的信号通路与对应的靶点基因构建“基因-通路”网络图。见图7。该网络图中共有20条信号通路,95个靶点基因,471条相互作用关系。Degree值>10的靶点有AKT1、RELA、MAPK1、IKBKB、CHUK、RAF1、MAPK8、TNF、NFKBIA、IL6、TP53等,这些靶点可能是淫羊藿增强免疫功能的关键靶点基因。
3 讨论
免疫功能主要是由机体的免疫系统发挥作用,构成免疫系统的重要组成部分主要由免疫器官(骨髓、脾脏、胸腺等)、免疫细胞(淋巴细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞等)、免疫活性物质(抗体、免疫球蛋白、肿瘤坏死因子等)组成,免疫系统是防御病原体入侵最有效的系统,它能够识别和清除外来病原微生物,并识别和清除体内突变的衰老细胞、死亡细胞及其他有害成分,以维持机体内环境稳定。相关研究表明,某些含多糖类、黄酮类、生物碱类等成分的中药对免疫系统具有双向调节作用,其主要药理作用之一是促进淋巴细胞、单核巨噬细胞、造血干细胞的生理功能,从而增强机体细胞免疫及体液免疫功能[10-12]。中医学认为补益类中药能够增强人体的抵抗力,现代研究证实淫羊藿的有效活性成分对机体主要的免疫器官胸腺和脾脏具有重要的调节作用,通过巨噬细胞、NK细胞等免疫细胞影响特异性和非特异性免疫,通过IL-2、IL-3、IL-6、TNF-α等细胞因子发挥免疫调节作用,此外,淫羊藿对内分泌系统、生殖系统、心脑血管系统等都具有较强的生物学作用[13-14]。
通过网络药理学的研究方法,在TCMSP中共筛选出淫羊藿21种活性成分,在Uniprot数据库中获取179个相关的靶点基因,并构建了“药物-活性成分-靶点”网络图。结果表明,淫羊藿的有效活性成分为槲皮素、木犀草素、山柰酚、C-高赤霉素,1,6-二氢-3,15,16-三甲氧基-,(3β)-、脱水角蛋白、8-(3-甲基丁-2-烯基)-2-苯基色酮等。相关研究表明这些成分都具有抗炎、抗肿瘤、增强免疫功能等作用[15-18]。在GeneCards数据库中检索到3 627个免疫抑制相关靶点,通过与药物靶点取交集得到138个潜在靶点。对PPI网络图进一步分析可知,靶点与靶点之间的相互关系共有2 573种,AKT1、TP53、IL-6、VEGFA、JUN、TNF、CASP3、MAPK1、MYC、EGFR等是淫羊藿增强免疫功能的主要作用靶点。AKT1是称为AKT激酶的3种紧密相关的丝氨酸/苏氨酸蛋白激酶之一,它调节许多过程,包括代谢、增殖、血管生成等[19-20]。肿瘤坏死因子(TNF)是一种调节细胞因子,在免疫系统中对蛋白质的信号传递起着至关重要的作用,可参与多种生理活动,组织免疫细胞之间进行信息交流[21]。IL-6是由间质细胞、造血细胞、上皮细胞等多种细胞产生的具有多效性的细胞因子,通过刺激抗体的产生和效应T细胞的发育进而对获得性免疫应答起到重要的作用[22-23]。
GO富集分析结果表明,淫羊藿可参与RNA聚合酶Ⅱ启动子转录的正调控、信号转导、DNA轉录正调控、凋亡过程的负调控、炎症反应、基因表达的正调控、细胞增殖正调控、凋亡过程等多个生物过程,从而发挥增强免疫功能的作用。KEGG富集分析结果显示,淫羊藿增强免疫功能涉及的主要通路有癌症途径、PI3K/AKT信号通路、TNF信号通路、MAPK信号通路等。PI3K属于磷脂激酶家族,机体内多种因子均能激活PI3K,调控细胞增殖、分化、迁移和凋亡等多种信号转导[24]。研究表明淫羊藿的活性成分淫羊藿苷可通过影响PI3K/AKT信号通路激活抑制A549细胞成活和转移,增强对凋亡的抑制作用[25]。因此,淫羊藿的有效活性成分可通过参与多个生物过程,调控多个信号通路,进而发挥增强免疫功能的作用。
综上所述,本研究运用网络药理学方法探究淫羊藿增强免疫功能的潜在作用机制,总结出淫羊藿增强免疫功能可能的主要靶点及信号通路,也体现了中药多成分、多靶点、多通路的特点,为淫羊藿的临床应用和进一步的实验研究提供了一定的理论依据。
参考文献
[1]孟宁,孔凯,李师翁.淫羊藿属植物化学成分及药理活性研究进展[J].西北植物学报,2010,30(5):1063-1073.
[2]Ru J,Li P,Wang J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014,6:13.
[3]Li J,Zhao P,Li Y,et al.Systems pharmacology-based dissection of mechanisms of Chinese medicinal formula Bufei Yishen as an effective treatment for chronic obstructive pulmonary disease[J].Sci Rep,2015,5:15290.
[4]The UniProt Consortium.UniProt:the universal protein knowledgebase[J].Nucleic Acids Res,2017,45(D1):D158-D169.
[5]Franz M,Lopes CT,Huck G,et al.Cytoscape.js:a graph theory library for visualisation and analysis[J].Bioinformatics,2016,32(2):309-311.
[6]Safran M,Dalah I,Alexander J,et al.GeneCards Version 3:the human gene integrator[J].Database(Oxford),2010,2010:baq020.
[7]Mering C,Huynen M,Jaeggi D,et al.STRING:a database of predicted functional associations between proteins[J].Nucleic Acids Res,2003,31(1):258-261.
[8]Huang DW,Sherman BT,Lempicki RA.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nat Protoc,2009,4(1):44-57.
[9]Huang DW,Sherman BT,Lempicki RA.Bioinformatics enrichment tools:paths toward the comprehensive functional analysis of large gene lists[J].Nucleic Acids Res,2009,37(1):1-13.
[10]周刘华,姚涛,郭爱灵,等.近十年中药免疫双向调节研究进展[J].中国中医基础医学杂志,2020,26(7):1016-1020,1033.
[11]董碧莲,蔡延渠,吕莉,等.中药多糖增强免疫、抗疲劳作用的研究进展[J].中成药,2019,41(5):1119-1124.
[12]陈秋莹,詹剑华.中药免疫调节作用及其研究进展[J].江西医药,2019,54(2):181-184.
[13]纪昕.淫羊藿苷免疫调节作用的研究进展[J].河北医药,2016,38(5):753-756.
[14]贾方,王秋月,李雪,等.淫羊藿苷抗肿瘤的免疫调节作用研究进展[J].辽宁中医杂志,2020,47(9):195-198.
[15]田瑞雪,孙耀宗,姚有昊,等.槲皮素对免疫低下小鼠免疫功能的影响[J].中国现代医药杂志,2019,21(9):13-16.
[16]周亮,乔印玲,王莉,等.木犀草素通过抑制PTEN PI3K-AKT信号通路以及对免疫功能的调节作用介导对肺癌模型大鼠的干预研究[J].天然产物研究与开发,2017,29(12):2128-2133,2140.
[17]于倩,巫冠中.木犀草素抗炎机制的研究进展[J].药学研究,2019,38(2):108-111,119.
[18]李偉瀚,程笑,杨滢霖,等.山柰酚通过抑制神经炎症及保护血脑屏障而改善大鼠脑缺血再灌注神经功能[J].中国药理学与毒理学杂志,2019,33(9):673.
[19]Nicholson KM,Anderson NG.The protein kinase B/Akt signalling pathway in human malignancy[J].Cell Signal,2002,14(5):381-395.
[20]Heron-Milhavet L,Khouya N,Fernandez A,et al.Akt1 and Akt2:differentiating the aktion[J].Histol Histopathol,2011,26(5):651-662.
[21]Doss GP,Agoramoorthy G,Chakraborty C.TNF/TNFR:drug target for autoimmune diseases and immune-mediated inflammatory diseases[J].Front Biosci(Landmark Ed),2014,19:1028-1040.
[22]Rossi JF,Lu ZY,Jourdan M,et al.Interleukin-6 as a therapeutic target[J].Clin Cancer Res,2015,21(6):1248-1257.
[23]Tanaka T,Narazaki M,Kishimoto T.IL-6 in inflammation,immunity,and disease[J].Cold Spring Harb Perspect Biol,2014,6(10):16295.
[24]严匡华,陈龙,严风梦.下调miR-21抑制PI3K/AKT信号通路对白血病细胞增殖凋亡的影响[J].中国免疫学杂志,2018,34(3):441-445.
[25]文艳梅,梁宗安,徐治波,等.淫羊藿苷抑制PI3K/AKT通路对肺腺癌A549细胞存活和转移的影响[J].中国免疫学杂志,2020,36(17):2091-2095.
(2020-12-15收稿 责任编辑:马雪玲,徐颖)

