基于色差原理分析不同产地桑白皮有效成分含量与颜色的相关性
高原 方妍 单梦瑶 董金香
摘 要 目的:研究桑白皮藥材有效成分含量与颜色的相关性,并对不同产地样品进行指纹图谱和聚类分析,为该药材质量控制及品质评价提供依据。方法:分别采用高效液相色谱法(HPLC)和盐酸-镁粉反应比色法测定桑白皮中桑根皮素和总黄酮的含量;肉眼观察桑白皮颜色,采用色差仪测定其色度值(L*、a*、b*)并计算总色差值(E*ab);利用SPSS 21.0软件对桑根皮素和总黄酮的含量与各颜色指标(L*、a*、b*、E*ab)进行Pearson相关性分析。采用HPLC法建立3个不同产地共20批桑白皮药材的指纹图谱,并进行相似度分析。采用SPSS 21.0软件对20批样品进行K-均值聚类分析(基于桑根皮素、总黄酮的含量及颜色指标)和系统聚类分析(基于指纹图谱共有峰相对峰面积)。结果:桑白皮中桑根皮素和总黄酮的平均含量分别为0.096 0~0.618 6 mg/g、0.48%~1.51%,其各颜色指标均呈显著相关(P<0.01)。其中,L*、b*、E*ab值越小,a*值越大,则桑根皮素含量越高;L*、b*、E*ab值越大,a*值越小,则总黄酮含量越高。20批药材样品的指纹图谱与对照图谱的相似度为0.883~0.983;标定了13个共有峰,并指认1号峰为绿原酸。K-均值聚类分析结果显示,20批样品可聚为2类,Ⅰ类以安徽产样品为主,其桑根皮素含量较高、总黄酮含量偏低,颜色较暗、偏黄棕色;Ⅱ类以四川、贵州产样品为主,其桑根皮素含量偏低、总黄酮含量较高,颜色较明亮、偏黄白色。系统聚类分析结果与其较为一致。结论:桑白皮颜色与其桑根皮素、总黄酮含量密切相关,颜色偏黄棕色的桑白皮中桑根皮素含量较高,颜色偏黄白色的桑白皮中总黄酮含量较高。
关键词 桑白皮;颜色;桑根皮素;总黄酮;指纹图谱;色差原理;聚类分析
ABSTRACT OBJECTIVE: To study the correlation between the contents of active ingredients and the color of Morus alba, to establish fingerprint and conduct cluster analysis of samples from different producing areas, so as to provide reference for its quality control and evaluation. METHODS: HPLC and HCl-Mg reaction colorimetry were used to determine the contents of morusin and total flavonoids in M. alba. The color of M. alba was observed by naked eye, and chromaticity values (L*, a*, b*) were measured by color difference meter and color aberration (E*ab)were calculated. Pearson correlation of the contents of morusin and total flavonoids with color indicators (L*, a*, b*, E*ab) were analyzed by SPSS 21.0 software. HPLC method was used to establish the fingerprint of 20 batches of M. alba from 3 different producing areas, and the similarity analysis was carried out. K-means cluster analysis (based on the contents of morusin and total flavonoids and corlor index) and hierarchical cluster analysis (based on relative peak area of common peaks in fingerprint) were performed for 20 batches of samples by SPSS 21.0 software. RESULTS: The average contents of morusin and total flavonoids in M. alba were 0.096 0-0.618 6 mg/g, 0.48%-1.51%, which were significantly correlated with each color index (P<0.01). The smaller L*, b*, E*ab and the larger a*were, the higher the content of morusin was; the higher the value of L*, b*, E*ab and the smaller the value of a*were, the higher the content of total flavonoids was. The similarity between the fingerprints of 20 batches of samples and the control ranged from 0.883 to 0.983; 13 common peaks were demarcated, and No.1 peak was identified as chlorogenic acid. K-means cluster analysis showed that 20 batches of samples could be divided into 2 categories. Category Ⅰ were mainly from Anhui province with higher content of morusin, lower content of total flavonoids, darker and yellowish brown color; category Ⅱ were mainly from Sichuan province and Guizhou province, with lower content of morusin, higher content of total flavonoids, lighter and yellowish white color. The results of hierarchical cluster analysis were consistent with the results. CONCLUSIONS: The color of M. alba is closely related to the contents of morusin and total flavonoids. The content of morusin in yellow-brown M. albais is higher, while the content of total flavonoids in yellow-white M. albais is higher.
KEYWORDS Morus alba; Color; Morusin; Total flavonoids; Fingerprint; Color difference of principle; Cluster analysis
中图分类号 R282 文献标志码 A 文章编号 1001-0408(2021)02-0213-07
DOI 10.6039/j.issn.1001-0408.2021.02.15
桑白皮为桑科植物桑Morus alba L.的干燥根皮,具有泻肺平喘、利水消肿的功效[1-2],主要分布于我国河南、安徽、四川、贵州等地。现代研究表明,桑白皮中含有的桑根皮素(又名“桑辛素”),具有抗肿瘤、镇痛、抗惊厥等药理作用,对人体免疫缺陷病毒1型M组B亚型(HIV-1SF162)感染具有显著的抑制活性[3]。此外,总黄酮类成分为桑白皮中的主要药效成分,具有降血糖、降血脂、镇咳平喘、抗氧化、镇痛抗炎、减轻肝损伤等药理作用[4]。桑白皮因其广泛的药理作用,于2002年被列入原卫生部发布的保健食品类中药名单[5]。
性状鉴定是中药鉴定的主要方法之一[6],桑白皮的传统鉴别是“以根皮色白、皮厚、味甘者为佳”[7]。颜色作为性状鉴别的要素之一,与药材的内在质量关系密切,具有简单、直观的特点,但同时也存在易受多种外界因素(如视觉、光学、生理、心理等因素)的影响而主观性过大的缺点[8],因此建立一种客观、可量化的颜色分析方法对快速鉴定药材质量显得尤为重要。本研究基于色差原理,通过色差仪对桑白皮药材外观颜色进行量化分析(其测定值L*、a*、b*分别代表明暗度、红-绿色度、黄-蓝色度[9]),并探讨药材外观颜色与其主要药效成分(桑根皮素、总黄酮)含量之间的相关性;同时,建立桑白皮药材指纹图谱并进行聚类分析,旨在为其质量控制和品质评价提供依据。
1 材料
1.1 仪器
实验使用的主要仪器包括:Agilent 1260型高效液相色谱(HPLC)仪和L5S型紫外-可见分光光度计(上海仪电分析仪器有限公司)、NH310型电脑色差仪(深圳三恩驰科技有限公司)、EL204型电子天平、MS105型十万分之一电子天平[梅特勒-托利多仪器(上海)有限公司]、FW177型中草药粉碎机(天津市泰斯特仪器有限公司)、KQ-500B型超声波清洗仪(昆山市超声仪器有限公司)等。
1.2 药品与试剂
桑根皮素对照品(批号AF8051823,纯度98%)购自成都埃法生物科技有限公司;桑根酮C对照品(批号18040211,纯度≥98%)购自上海圻明生物科技有限公司;绿原酸对照品(批号110753-201817,纯度96.8%)购自中国食品药品检定研究院;镁粉(批号20120312)购自天津市福晨化学试剂厂;磷酸、甲醇、乙腈均为色谱纯,盐酸、乙醇均为分析纯,水为纯净水。
20批桑白皮药材收集自四川、安徽、贵州等3个产地,经长春中医药大学药学院翁丽丽教授鉴定为桑科植物桑M. alba L.的干燥根皮,其具体信息见表1。
2 方法与结果
2.1 桑根皮素的含量测定
采用HPLC法测定桑白皮药材中桑根皮素的含量。
2.1.1 对照品溶液的配制 精密称取桑根皮素对照品适量,加乙醇溶解制成质量浓度为21.795 2 μg/mL的对照品溶液。
2.1.2 供试品溶液的配制 精密称取桑白皮粉末(过三号筛,下同)0.5 g,置于具塞锥形瓶中,精密加入乙醇25 mL,密塞后称定质量,超声(频率40 kHz,功率500 W)处理30 min,冷却后再次称定质量,用乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.1.3 色谱条件和系统适用性考察 以Agilent 5 TC-C18(250 mm×4.6 mm,5 μm)为色谱柱,乙腈-水(58 ∶ 42,V/V)为流动相,检测波长为270 nm,流速为1 mL/min,柱温为25 ℃,进样量为10 μL。取“2.1.1”“2.1.2”项下桑根皮素对照品和供试品溶液(编号S7)以及空白溶剂(乙醇)进样测定。结果显示,桑根皮素的理论板数大于10 000,分离度大于1.5,且溶剂无干扰,详见图1(空白溶剂图略)。
2.1.4 线性关系考察 分别精密吸取“2.1.1”项下桑根皮素对照品溶液0.062 5、0.125、0.25、0.5、1、2 mL,加乙醇定容至2 mL,摇匀,即得系列线性溶液。取上述系列线性溶液各适量,按“2.1.3”项下色谱条件进样测定,记录色谱图。以质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y=84.565X+1.181 5(r=0.999 9),表明桑根皮素质量浓度在0.681 1~21.795 2 μg/mL范圍内与色谱峰峰面积呈良好的线性关系。
2.1.5 精密度试验 取同一份供试品溶液(编号S7),按“2.1.3”项下色谱条件连续进样测定6次,记录峰面积。结果,桑根皮素峰面积的RSD为0.23%(n=6),表明方法精密度良好。
2.1.6 重复性试验 取桑白皮药材粉末(编号S7)适量,共6份,按“2.1.2”项下方法平行制备供试品溶液,再按“2.1.3”项下色谱条件进样测定,记录峰面积并按外标法计算含量。结果,桑根皮素含量的RSD为0.87%(n=6),表明方法重复性良好。
2.1.7 稳定性试验 取桑白皮药材粉末(编号S7)适量,按“2.1.2”项下方法制备供试品溶液,分别于室温下放置0、2、4、8、10、12、24、48 h时按“2.1.3”项下色谱条件进样测定,记录峰面积。结果,桑根皮素峰面积的RSD为1.36%(n=8),表明供试品溶液在室温下放置48 h内稳定。
2.1.8 加样回收率试验 取已知桑根皮素含量的桑白皮药材粉末(编号S7)适量,共6份,均按1 ∶ 1质量比精密加入桑根皮素对照品溶液适量,然后按“2.1.2”项下方法平行制备供试品溶液,再按“2.1.3”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果,平均加样回收率为96.80%,RSD为1.43%(n=6),表明方法准确度良好,详见表2。
2.1.9 样品中桑根皮素的含量测定 取20批桑白皮药材粉末适量,按“2.1.2”项下方法制备供试品溶液,再按“2.1.3”项下色谱条件进行测定,记录峰面积并按外标法计算含量。每批样品平行测定3次,取平均值。结果,20批桑白皮药材中桑根皮素的平均含量为0.096 0~0.618 6 mg/g,详见表3。
2.2 总黄酮的含量测定
由于桑白皮的黄酮类化合物结构中均存在异戊烯基侧链,故本研究以桑白皮中含量较高且结构中同样存在异戊烯基的药效成分桑根酮C为指标,采用盐酸-镁粉反应比色法测定桑白皮药材中总黄酮的含量[10]。
2.2.1 对照品溶液的配制 精密称取桑根酮C对照品适量,加甲醇制成质量浓度为0.086 mg/mL的对照品溶液。
2.2.2 供试品溶液的配制 精密称取桑白皮药材粉末(过三号筛,下同)0.5 g,置于具塞锥形瓶中,精密加入50 mL甲醇,超声(频率40 kHz,功率500 W)处理60 min,冷却至室温,滤过并转移至50 mL量瓶中,加甲醇定容至刻度,摇匀,即得[10-11]。
2.2.3 显色方法 精密吸取桑根酮C对照品溶液或者供试品溶液3 mL,转移至含有300 mg镁粉的具塞刻度试管中,将试管置于冷水浴(约15 ℃)中,缓慢地精密加入浓盐酸3 mL,时时振摇。待反应至不再产生气泡后,补加甲醇至10 mL,摇匀,于沸水浴中加热1 h,迅速冷却至室温,补加甲醇至10 mL,摇匀,备测。
2.2.4 检测波长的选择 将桑根酮C对照品溶液和供试品溶液分别按“2.2.3”项下方法显色后,在200~600 nm波长范围内扫描。结果,桑根酮C对照品溶液和供试品溶液在484 nm波长处均有最大吸收,故选择该波长作为总黄酮含量的检测波长,详见图2。
2.2.5 线性关系考察 精密移取桑根酮C对照品溶液1.0、2.0、3.0、3.5、4.0、5.0 mL,按“2.2.3”项下方法反应显色后,在484 nm波长处测定吸光度。以桑根酮C质量浓度(X,μg/mL)为横坐标、吸光度(Y)为纵坐标进行线性回归,得回归方程Y=0.015 4X-0.017 6(r=0.999 2),表明桑根酮C质量浓度在8.60~43.00 μg/mL范围内与吸光度呈良好的线性关系。
2.2.6 精密度试验 精密移取同一份供試品溶液(编号S7)3 mL,共6份,按“2.2.3”项下方法显色后,在484 nm波长处测定吸光度。结果,吸光度的RSD为3.58%(n=6),表明方法精密度良好。
2.2.7 重复性试验 精密称取同一批桑白皮粉末(编号S7)适量,共6份,按“2.2.2”项下方法制备供试品溶液;分别精密量取3 mL,按“2.2.3”项下方法显色后,在484 nm波长处测定吸光度,并代入标准曲线方程计算总黄酮含量。结果,总黄酮含量的RSD为4.31%(n=6),表明方法重复性良好。
2.2.8 稳定性试验 精密吸取桑根酮C对照品溶液和供试品溶液(编号S7)各3 mL,按“2.2.3”项下方法显色后,分别于室温下放置0、20、40、60、80、100、120 min时在484 nm波长处测定吸光度。结果,对照品溶液和供试品溶液吸光度的RSD分别为0.83%、0.60%(n=7),表明两种溶液在显色后于室温下放置120 min内稳定。
2.2.9 加样回收率试验 精密称取已知总黄酮含量的桑白皮粉末(编号S7)约0.5 g,共6份,均按1 ∶ 1质量比精密加入桑根酮C对照品溶液适量,然后按“2.2.2”项下方法制备供试品溶液。分别精密量取3 mL,按“2.2.3”项下方法显色后,在484 nm波长处测定吸光度并计算加样回收率。结果,总黄酮的平均加样回收率为98.32%,RSD为2.25%(n=6),表明方法准确度良好,详见表4。
2.2.10 样品中总黄酮的含量测定 取20批桑白皮药材粉末适量,按“2.2.2”项下制备供试品溶液。分别精密量取3 mL,按“2.2.3”项下方法显色后,在484 nm波长处测定吸光度,并代入标准曲线方程计算总黄酮含量。每批样品平行测定3次,取平均值。结果,20批桑白皮药材中总黄酮的平均含量为0.48%~1.51%,详见表5。
2.3 桑白皮药材的颜色测定
采用肉眼观察并以色差仪测定桑白皮药材的颜色。
2.3.1 样品颜色观察 取桑白皮药材适量,置白板上观察颜色,大致按浅黄白色、黄白色、浅黄棕色、黄棕色、棕褐色等5个级别进行记录。
2.3.2 色差仪测定条件 取桑白皮样品粉末(过四号筛,下同)适量,均匀平铺于粉末测试盒内直至装满,盖好盖玻片。色差仪设置D65光源,8度视角,孔径8 mm,LED蓝光激发,仪器误差值小于0.4。用黑白板校正仪器后进行样品测定,记录色度值(L*、a*、b*,其中L*值越大表示颜色越亮/浅、a*值越大表示颜色越偏红、b*值越大表示颜色越偏黄[9]),并计算总色差值(E*ab):E*ab=(L*2+a*2+b*2)1/2。
2.3.3 精密度试验 取桑白皮样品粉末(编号S1)适量,按“2.3.2”项下方法连续测定6次,记录L*、a*、b*值。结果,上述色度值的RSD均小于2%(n=6),表明方法精密度良好。
2.3.4 重复性试验 取桑白皮样品粉末(编号S1)适量,共6份,按“2.3.2”项下方法测定L*、a*、b*值。结果,上述色度值的RSD均小于2%(n=6),表明方法重复性良好。
2.3.5 稳定性试验 取桑白皮样品粉末(编号S1)适量,按“2.3.2”项下方法平铺于粉末测试盒内并盖好盖玻片后,分别在室温下放置0、2、4、6、8、10、12、24 h时进行测定L*、a*、b*值。结果,上述色度值的RSD均小于3%(n=8),表明样品在室温下放置24 h内稳定性良好。
2.3.6 样品的颜色观察和测定 取20批桑白皮药材按“2.3.1”“2.3.2”项下进行颜色观察和色度值测定并计算总色差值。每批样品平行测定3次,取平均值,结果见表6。
2.4 桑白皮药材中有效成分含量与颜色指标的相关性分析
利用SPSS 21.0软件对桑白皮中桑根皮素、总黄酮的含量与颜色指标(L*、a*、b*、E*ab)进行Pearson相关性分析,结果见表7。
由表7可知,桑白皮药材中桑根皮素含量与L*、b*、E*ab值以及总黄酮含量与a*值均呈显著负相关(r<0,P<0.01),桑根皮素含量与a*值以及总黄酮含量与L*、b*、E*ab值则均呈显著正相关(r>0,P<0.01)。这表明在一定程度上,桑白皮L*、b*、E*ab值越小,a*值越大,则其桑根皮素含量越高;L*、b*、E*ab值越大,a*值越小,则总黄酮含量越高。由于L*越大表示颜色越明亮,a*>0表示颜色偏红,b*>0表示颜色偏黄[12-15],根据上述Pearson相关性分析结果可知:(1)桑根皮素含量与黄蓝值相关性最大(r绝对值越大则相关性越大,下同),在78.1%的程度上其颜色偏黄则桑根皮素含量较低;其次与红绿值相关性较大,在75.0%的程度上其颜色偏红则桑根皮素含量较高;最后与颜色明暗程度较相关,在70.0%的程度上其颜色越明亮则桑根皮素含量越低。(2)桑白皮中总黄酮含量与颜色明暗程度相关性最大,在97.0%的程度上颜色越明亮则总黄酮含量越高;其次与红绿值相关性较大,在96.3%的程度上其颜色偏红则总黄酮含量较低;最后与黄蓝值较相关,在95.5%的程度上其颜色偏黄则总黄酮含量较高。
2.5 桑白皮药材的指纹图谱建立
采用HPLC法建立桑白皮药材的指纹图谱。
2.5.1 对照品溶液的制备 精密称取绿原酸对照品适量,加甲醇制成质量浓度为0.014 3 mg/mL的对照品溶液。
2.5.2 供试品溶液的制备 精密称取桑白皮粉末(过三号筛,下同)1 g,置于具塞锥形瓶中,加入70%乙醇25 mL,密塞后称定质量,超声(频率40 kHz,功率500 W)处理30 min,冷却后再次称定质量,用甲醇补足减失的质量,滤过,取续滤液,即得。
2.5.3 色谱条件 色谱柱为Agilent ZORBAX Eclipse Plus C18(250 mm×4.6 mm,5 μm),流动相为乙腈-甲醇[1 ∶ 1(V/V),A相]-0.1%磷酸水溶液(B相),梯度洗脫(0 min,15%A;18 min,34%A;28 min,50%A;38 min,65%A;60 min,80%A);检测波长为320 nm;柱温为40 ℃;流速为1 mL/min;进样量为10 μL[16]。
2.5.4 精密度试验 取同一份供试品溶液(编号S7),按“2.5.3”项下色谱条件连续进样6次,以1号峰(绿原酸)为参照计算各共有峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间和相对峰面积的RSD分别小于0.14%、0.69%(n=6),表明方法精密度良好。
2.5.5 重复性试验 取桑白皮药材粉末(编号S7)适量,共6份,按“2.5.2”项下方法平行制备供试品溶液,再按“2.5.3”项下色谱条件进样测定,以1号峰(绿原酸)为参照计算各共有峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间和相对峰面积的RSD分别小于0.52%、1.95%(n=6),表明方法重复性良好。
2.5.6 稳定性试验 取桑白皮药材粉末(编号S7)适量,按“2.5.2”项下方法平行制备供试品溶液,分别于室温下放置0、4、8、12、24、48 h时按“2.5.3”项下色谱条件进样测定,以1号峰(绿原酸)为参照计算各共有峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间和相对峰面积的RSD均小于0.79%、1.88%(n=6),表明供试品溶液在室温下放置48 h内稳定性较好。
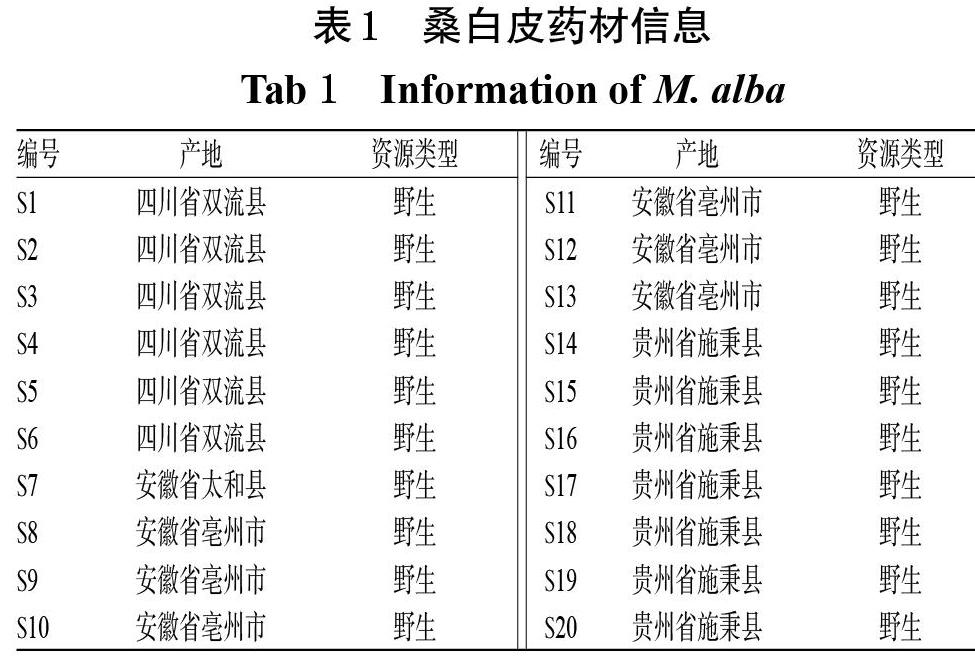
2.5.7 相似度评价及共有峰指认 取20批桑白皮药材样品粉末适量,按“2.5.2”项下方法制备供试品溶液按并“2.5.3”项下色谱条件进样测定,记录色谱图。将所有样品色谱图导入《中药色谱指纹图谱相似度评价系统(2012版)》,生成叠加指纹图谱(见图3);同时以S1为参照,采用中位数法,设置时间窗为0.1,经多点校正后进行匹配,生成对照图谱(R,图略);对两者进行相似度评价。结果,样品S1~S20色谱图与对照色谱(R)的相似度分别为0.962、0.930、0.941、0.975、0.973、0.972、0.948、0.972、0.883、0.952、0.968、0.978、0.975、0.969、0.983、0.928、0.978、0.952、0.906、0.981;共标定13个共有峰,指认1号峰为绿原酸(绿原酸对照品溶液按“2.5.3”项下色谱条件进样测定所得色谱图见图4)。
2.6 不同产地桑白皮药材的聚类分析
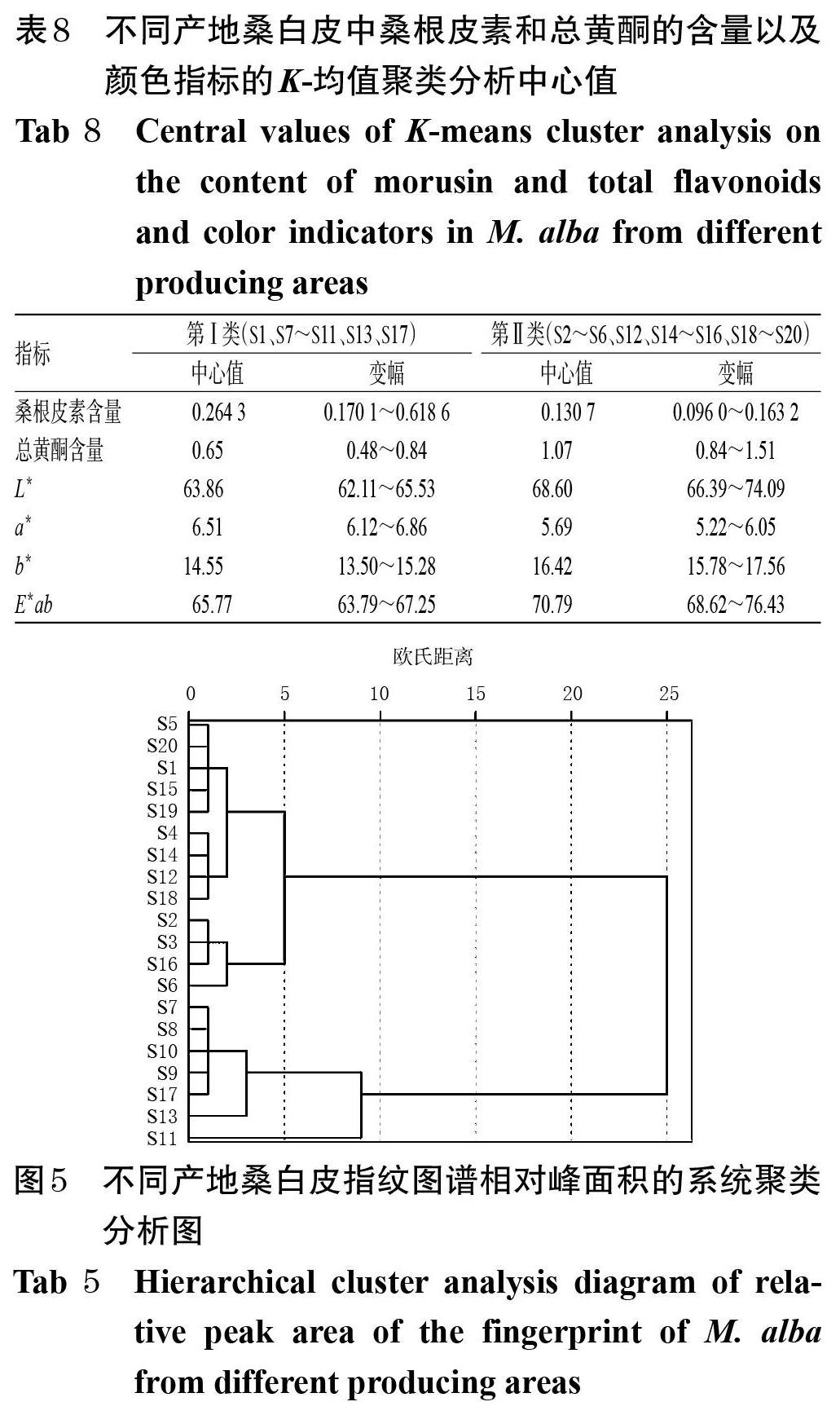
利用SPSS 21.0软件对20批不同产地桑白皮药材样品中桑根皮素和总黄酮的含量、颜色指标进行K-均值聚类分析,对指纹图谱共有峰的相对峰面积进行系统聚类分析,结果见表8、图5。
由系统聚类分析结果可知,当欧氏距离为10时,20批样品可聚为两类:S7~S11、S13、S17聚为一类,以安徽产桑白皮为主,同时K-均值聚类分析结果(该聚类结果同时包含S1)表明其桑根皮素含量较高、总黄酮含量偏低,颜色较暗、偏黄棕色;S1~S6、S12、S14~S16、S18~S20聚为一类,以四川、贵州产桑白皮为主,同时K-均值聚类分析结果(该聚类结果不包含S1)表明其桑根皮素含量偏低、总黄酮含量较高,颜色较明亮、偏黄白色。
3 讨论
随着中药材基原和种类的不断增多,对其进行质量监测和控制显得尤为重要,而颜色作为中药最直观的外在特征之一,与中药质量密不可分[17]。历代关于桑白皮的品质评价均以“色白,皮厚,味甘者为佳”[7]。然而传统辨色方法主观性较强且易受外在因素影响,因此本研究通过色差仪将主观性指标颜色转化为客观性指标(L*、a*、b*),以期通过药材外在表征来快速评价药材质量。
经前期研究发现,不同产地及批次桑白皮中二苯乙烯苷类成分桑皮苷A的含量差异较大,且有文献表明该成分易受温度、光照及pH值影响[18],故本文选择桑白皮的主要药效成分总黄酮及化学性质较为稳定的桑根皮素进行含量测定,并将其与颜色指标L*、a*、b*、E*ab值相关联。结果表明,桑白皮中桑根皮素和总黄酮含量均与L*、a*、b*、E*ab值呈显著相关性。其中,桑根皮素含量与b*值相关性最大,b*值越小则桑根皮素含量越高,即偏黄棕色的样品中桑根皮素含量较高;总黄酮含量与L*值相关性最大,L*值越大则总黄酮含量越高,即偏黄白色的样品中总黄酮含量较高。据文献报道,安徽亳州产桑白皮产量大、色白、皮厚、柔韧、质量好,称为“亳桑皮”,享誉全国[19-20]。本研究中所用产地为安徽的桑白皮整体颜色偏黄棕色,桑根皮素含量较高,总黄酮含量偏低,进一步证实了外观颜色与其质量的相关性。
中药材成分的多样性决定了其质量控制的复杂性,由于产地对其质量和疗效影响较大,且其化学成分与临床药理作用之间的关系尚未明确,通常以多组分联合发挥药效,可见单一成分不能完全代表药材质量,故指纹图谱的建立可以从整体上控制药材质量,弥补了单一成分质量控制具有片面性的不足[21]。本课题组前期观察了不同体积分数的甲醇和乙醇等提取溶剂的提取效果,结果显示,不同提取溶剂对成分溶出影响较大,并以70%乙醇提取所得供试品的成分信息较为丰富;同时,本课题组对回流和超声两种提取方式及不同提取时间也进行了比较,结果显示,超声提取30 min即可提取完全。其次,不同型号色谱柱对指纹图谱的影响也较大,本课题组比较了Agilent TC-C18(2)、Shim-pack C18、Agilent ZORBAX Eclipse Plus-C18等3种色谱柱的分离效果,结果以Agilent ZORBAX Eclipse Plus-C18的效果最佳。此外,本课题组在190~800 nm波长范围内进行全波长扫描,结果发现320 nm波长下得到的图谱信息较丰富且各色谱峰分离较好,故选择320 nm为检测波长,并以该条件下出峰稳定的第1号峰(绿原酸)作为参照峰。
最后,本文对不同产地桑白皮药材进行了聚类分析,基于桑根皮素和总黄酮含量以及颜色指标的K-均值聚类分析结果显示,桑白皮可分为两类,即样品S1、S7~S11、S13、S17聚为一类,其余批次聚为另一类;基于桑白皮指纹图谱相对峰面积进行的系统聚类分析结果显示,样品S7~S11、S13、S17聚为一类,其余批次聚为另一类。由此可知,以不同指标进行聚类分析所得的结果较为一致,即安徽产样品聚为一类,四川、贵州产样品聚为另一类。四川、贵州产样品质量相近的原因可能为这两个地区的地理位置较接近,土壤、气候、生态环境等较为相似;而安徽地处中纬度地带,季风气候明显,降水充沛,与四川、贵州存在一定产地差异。
综上所述,桑白皮有效成分(桑根皮素、总黄酮)的含量与其颜色具有相关性,且不同产地药材的质量存在一定差异。本研究为桑白皮药材的质量控制及评价提供了一定的试验基础,但关于该药材中其他成分与颜色的相关性以及其他产地样品间的差异有待进一步研究。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:298.
[ 2 ] 冯志毅,王小兰,匡海学,等.桑白皮性能功效的本草考证[J].世界科学技术:中医药现代化,2015,17(3):471-475.
[ 3 ] 侯楚祺.抗HIV活性成分桑辛素代谢机制及药-药相互作用研究[D].广州:南方医科大学,2018.
[ 4 ] 杨萍.桑白皮总黄酮研究进展[J].临床合理用药杂志,2018,11(19):180-181.
[ 5 ] 候宝林,施洋,赵俊芳,等.桑白皮化学成分及药理作用研究进展[J].辽宁中医杂志,2020,47(8):212-214.
[ 6 ] 王芸,陈军峰,张磊,等.基于“有效成分-性状”的关联分析评价丹参品质的研究[J].世界科学技术:中医药现代化,2019,21(5):835-843.
[ 7 ] 李玉丽,蒋屏,孙梦林,等.经典名方中桑白皮的本草考证[J].中国实验方剂学杂志,2020,26(18):36-44.
[ 8 ] 宿莹,李翟,侯晓琳,等.基于色差原理分析龙胆有效成分含量与颜色的相关性[J].中国实验方剂学杂志,2019,25(13):151-156.
[ 9 ] 林華坚,张梓豪,孟江,等.干姜及其炮制品色差值与活性成分含量的相关性研究[J].中国药房,2020,31(10):1197-1202.
[10] 段志涛,高英,霍文杰,等.桑白皮中总黄酮含量测定方法研究[J].中国实验方剂学杂志,2013,19(7):133-135.
[11] 杨晶,刘嘉琪,王宝昌,等.桑不同药用部位中黄酮类成分的定量检测[J].中国药房,2014,25(27):2550-2552.
[12] 宿莹,侯晓琳,刘战,等.基于色差原理分析黄柏有效成分含量与颜色的相关性[J].中药材,2019,42(8):1766- 1770.
[13] 张慧慧,孙灵根,黄学思,等.“电子眼”在中药炮制中应用构想[C]//中华中医药学会中药炮制分会.中华中医药学会四大怀药与地道药材研究论坛暨中药炮制分会第二届第五次学术会与第三届会员代表大会论文集.焦作:中华中医药学会中药炮制分会,2007:35-41.
[14] 徐珍珍,史星星,樊旭蕾,等.基于色差原理分析木香有效成分含量与颜色值的相关性[J].中国实验方剂学杂志,2018,24(13):17-21.
[15] CUI YX,LIU RX,LIN ZZ,et al. Quality evaluation based on color grading:quality discrimination of the Chinese medicine Corni Fructus by an E-eye[J]. Sci Rep,2019,9(8):17006-17017.
[16] 陈士林.中药饮片标准汤剂:第2卷[M].北京:科学出版社,2018:325.
[17] 徐曼菲,吴志生,刘晓娜,等.从辨色论质谈中药质量评价方法[J].中国中药杂志,2016,41(2):177-181.
[18] 喻艳,向伟,刘俊池,等. 3种二苯乙烯类化合物的稳定性研究[J].食品工业科技,2016,37(2):148-151、155.
[19] 白华.亳州桑白皮本草考证[C]//中国药学会药学史专业委员会.第十八届全国药学史暨本草学术研讨会学术论文集.合肥:中国药学会药学史专业委员会,2015:135-137.
[20] 谢晋,查良平,彭华胜,等.历代本草中安徽地产药材的品种与分布[J].中国中药杂志,2017,42(9):1623-1627.
[21] 贾毓欣,刘海帆,司明东,等.知母及其不同炮制品的指纹图谱建立与抗氧化活性的谱-效关系研究[J].中国药房,2020,31(22):2706-2712.
(收稿日期:2020-06-23 修回日期:2020-11-28)
(编辑:段思怡)

