Ce改性Fe-Mn磁性吸附剂脱汞及再生特性研究
陶信,周强,尚瑜,狄冠丞,卢平,周佳琦
(南京师范大学能源与机械工程学院,江苏省能源系统过程转化与减排技术工程实验室,江苏南京,210023)
重金属汞是一种危害人体健康、污染环境的剧毒物质,其具有耐久性、易迁移和生物富集等特点。燃煤被认为是世界上最大的人为汞排放源[1−2]。当前,我国正遭受着严峻的汞污染挑战。2015年1月1日,我国实施了最新的《火电厂大气污染物排放标准》,规定汞排放限值为30 μg/m3,2020年我国燃煤汞排放或将进一步严格限制在3 μg/m³[3]。2017年8月16日,旨在消减全球汞排放的《关于汞的水俣公约》正式生效,这标志着汞减排成为具有法律约束效力的国际义务。燃煤烟气中的汞分为颗粒汞(Hgp)、二价汞(Hg2+)和单质汞(Hg0)[4],其中Hgp可以被电除尘器(ESP)或布袋除尘器(FF)除去,Hg2+能够通过湿法脱硫装置(WFGD)脱除,而Hg0因具有挥发性及难溶性,相较于Hgp和Hg2+,难以被脱除。因此,降低汞排放的关键在于控制Hg0的排放。目前,活性炭喷射技术被认为是最成熟可行的脱汞技术[5],但该技术目前仍存在一定的问题[6]:吸附剂的回收和再利用困难、成本高、利用率低。更重要的是,脱汞后的吸附剂停留在飞灰中,容易造成汞的二次释放。为了解决ACI技术的已有问题,实现吸附剂的重复利用,减少碳基吸附剂对飞灰的影响,开发新型可再生脱汞吸附剂已成为当前研究热点。铁−锰(Fe-Mn)基脱汞吸附剂因可磁分离、可再生、低成本、高活性,受到了广泛关注。YANG 等[7]利用共沉淀法制备了Mn/γ-Fe2O3,结果发现该吸附剂具有良好的磁性,其在150 ℃时10 h 内的平均脱汞率可达52%。ZENG等[8]利用共沉淀法制备了FeMnOx磁性脱汞吸附剂,FeMnOx吸附剂具有较高脱汞效率;YANG等[9]制备出的MnOx/-Fe2O3展现出优秀的汞脱除性能和超强的汞吸附能力,并且该吸附剂可在实验后回收利用。然而,Fe-Mn 基吸附剂易发生SO2中毒。ZENG等[8]发现在烟气中通入400×10−6SO2的情况下,FeMnOx吸附剂汞脱除效率从87.6%降为59.7%,主要因为烟气中SO2会与Hg0发生竞争吸附,易占据脱汞活性位点Mn4+。因此,有学者尝试向Fe-Mn吸附剂中掺入第三种过渡金属[10−11],以期提高Fe-Mn 吸附剂的脱汞性能和抗SO2性能。XU 等[12]制备了Fe-Sn-Mn 脱汞吸附剂,发现掺入Sn增大了吸附剂的比表面积,同时Fe-Sn-Mn有着良好的SO2耐受性。过渡金属铈(Ce)已被证实具有一定抗SO2中毒能力[13−16],主要因为其与S 之间拥有更大的亲和力,SO2更容易对CeO2硫酸化,从而保护相邻的活性成分MnO2。然而,利用Ce 对Fe-Mn 磁性吸附剂进行改性的相关研究非常有限,值得深入研究。因此,本文作者提出利用过渡金属Ce 对Fe-Mn 磁性吸附剂进行改性,采用共沉淀法制备磁性脱汞吸附剂Fe6Mn1−xCex,在模拟烟气条件下进行Fe6Mn1−xCex吸附剂的汞吸附及热再生实验,考察Ce 掺杂量、烟气温度、SO2质量浓度和再生次数等对脱汞的影响,利用N2吸附/脱附、振动磁强计(VSM)、X 射线衍射仪(XRD)等手段对吸附剂进行物化特性表征,分析其脱汞与再生特性。本文的研究结果可为燃煤烟气汞脱除及吸附剂再生利用技术的发展提供参考。
1 实验
1.1 吸附剂的制备
利用共同沉淀法制备Fe6Mn1−xCex磁性吸附剂的具体流程如下:分别取0.03 mol FeCl3·6H2O,0.03 mol FeSO4·7H2O 和定量MnSO4·H2O、Ce(NO3)3·6H2O 晶体,溶解于200 mL 去离子水中,使混合溶液中物质的量比n(Fe2+):n(Fe3+):n(Mn2++Ce3+)=3:3:1。随后,滴入NH3·H2O 溶液作为沉淀剂,搅拌2 h,分离沉淀物,置于烘箱中在105 ℃干燥12 h后,于马弗炉中在400 ℃煅烧4 h,经破碎、筛分后,制得磁性吸附剂Fe6Mn1−xCex,其中x为Ce 的添加量(物质的量),x越小,则Ce添加量越小,再生后Fe6Mn1−xCex磁性吸附剂记为Fe6Mn1−xCex-R。
1.2 实验装置
在图1所示的装置系统上完成磁性Fe6Mn1−xCex吸附剂汞吸附及再生实验。使用VM3000在线测汞仪(Mercury Instrument 公司,德国)测定气体中的汞浓度。控制固定床入口汞蒸气初始质量浓度恒定在(33±0.5)μg/m3,配气总流量为2 L/min,载汞N2为300 mL/min。固定床床料为机械干混物(200 mg 吸附剂粉末和2 g 石英砂),吸附时间为2.5 h。脱汞后的吸附剂不取出,在图1所示的固定床上进行热再生,再生气体总流量为2 L/min,由体积分数为79% N2与21% O2组成,再生时间为3 h,温度为500 ℃;Hg程序升温脱附(Hg-TPD)在卧式管式炉上进行,气氛为N2,总气量为2 L/min,升温速率为5 ℃/min。
汞吸附性能评价采用脱汞效率η和单位质量吸附剂累积汞吸附量q表示:
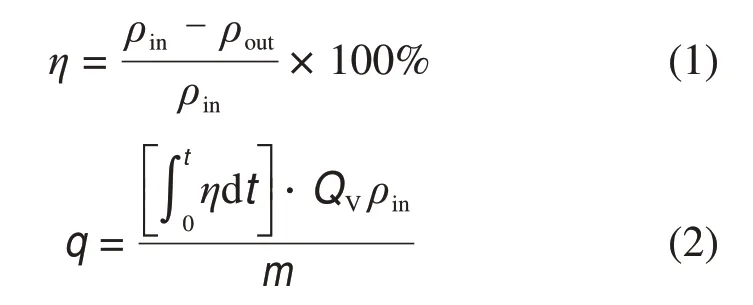
式中:ρin为入口元素汞质量浓度,μg/m3;ρout为出口元素汞质量浓度,μg/m3;q为单位质量吸附剂累积汞吸附量,μg/g;t为时间,min;QV为总气体流量,L/min;m为吸附剂质量,g。
1.3 表征方法
利用N2吸附/脱附法对吸附剂进行比表面积及孔隙结构分析(ASAP-2020M,Micromeritics);吸附剂的磁性利用(MPMS-VSM和MPMS-XL)振动磁强计测出;吸附剂表面的晶体结构由(D8 Advance,Bruker)仪器测定。
2 结果与讨论
2.1 固定床汞脱除实验结果
2.1.1 Ce添加量的影响
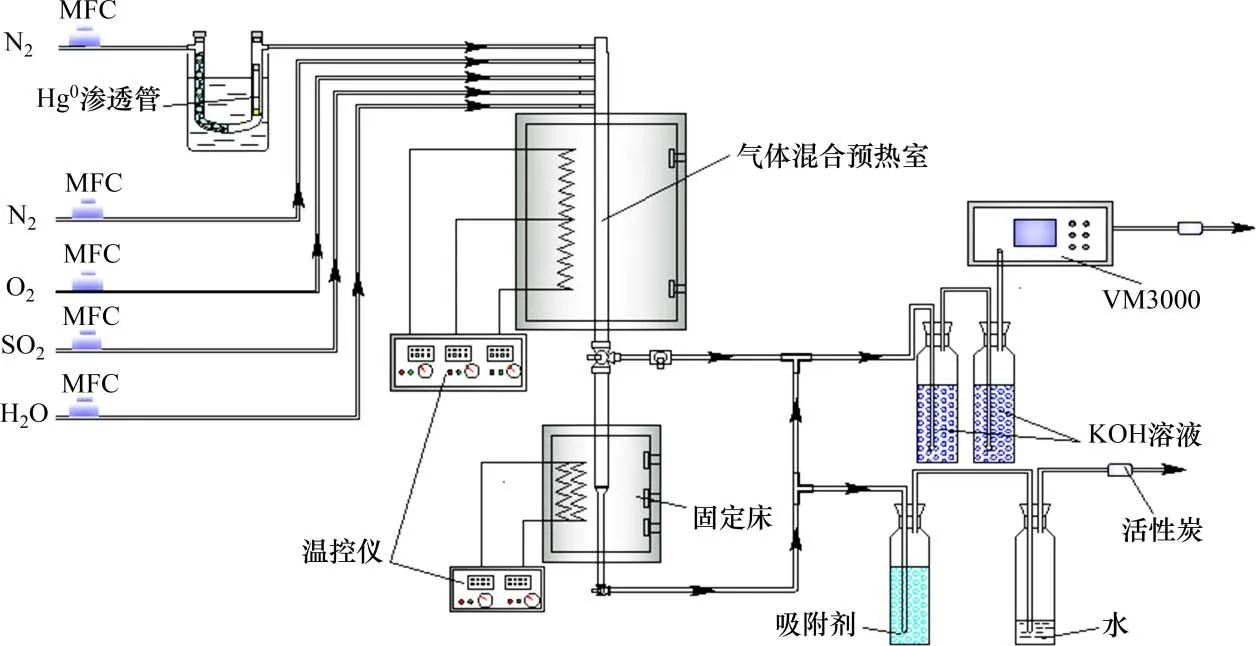
图1 固定床汞吸附/再生试验装置系统Fig.1 Schematic diagram of fixed bed mercury adsorption/regeneration device
图2所示为当温度为150 ℃时Ce添加量对吸附剂脱汞效率的影响。从图2可知:Fe6Mn0.8Ce0.2的脱汞效率最大,Fe6Mn0.5Ce0.5的脱汞效率则最低。可见,添加少量的Ce(x=0.2)可以提高Fe6Mn1−xCex吸附剂的脱汞能力,但是添加过量的Ce 会导致Fe6Mn1−xCex的脱汞性能逐渐降低。图3所示为Ce添加量对单位质量吸附剂汞吸附量(qt)的影响。从图3可以看出:Fe6Mn0.8Ce0.2比Fe6Mn1吸附剂有着更好的脱汞效果,但Ce 含量的增加会导致吸附剂单位质量汞吸附量减小。研究表明[16],Ce 元素的掺入能够分散Hg0活性位点,并提高吸附剂中Mn4+的比例,增强吸附剂的氧化还原能力,但是Fe6Mn1−xCex吸附剂中的脱汞活性位点是Mn氧化物,过量的Ce加入会降低Mn在吸附剂中的比例。因此,过多的Ce掺入导致了吸附剂脱汞性能的降低。
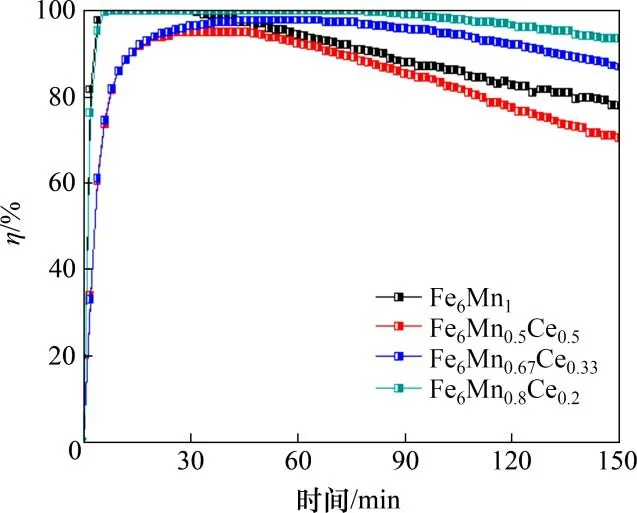
图2 Ce添加量对吸附剂脱汞效率的影响Fig.2 Effect of Ce addition amount on mercury removal efficiency

图3 Ce添加量对单位质量吸附剂汞吸附量的影响Fig.3 Effect of Ce addition amount on mercury adsorption capacity of per unit mass sorbent
2.1.2 烟气温度的影响
实验考察在N2气氛下烟气温度为100,150,200 和250 ℃对吸附剂脱汞的影响,如图4所示。由图4可知:150 ℃时,Fe6Mn0.8Ce0.2的脱汞效率最大,150 min 时依旧维持93.4%的脱汞效率;烟气温度在200 ℃时脱汞效率明显降低,而当烟气温度达到250 ℃时,脱汞效率骤降至29%。图5所示为温度对单位质量吸附剂汞吸附量的影响。由图5可知:当温度为150 ℃时,单位质量吸附剂的汞吸附量最大,达到45.36 μg/g,这主要是因为吸附剂脱汞过程存在物理吸附和化学吸附2 种方式[17−18]。在温度较低时,物理吸附作用较强,化学吸附速率较慢,但是物理吸附对吸附效率的影响较小;温度升高,增强了参与反应物质的活性,提高了Hg0与吸附剂表面活性位点的接触概率,从而促进汞的吸附。Fe6Mn0.8Ce0.2吸附剂脱除Hg0主要是化学吸附,Hg0与吸附剂中的O结合成HgO被吸附,在这个反应过程中,Mn的价态会降低,而吸附剂中由于Ce 氧化物的存在,能够与Mn 氧化物之间通过相互氧化还原转移电子[19],从而实现Mn 活性位点的再生。因此,在一定温度范围内,提高吸附温度能够有效促进汞的脱除。然而,由于物理吸附反应可逆,高温会导致吸附在吸附剂表面的汞脱附出来,过高的温度也会使吸附剂产生烧结现象,破坏其孔隙结构。
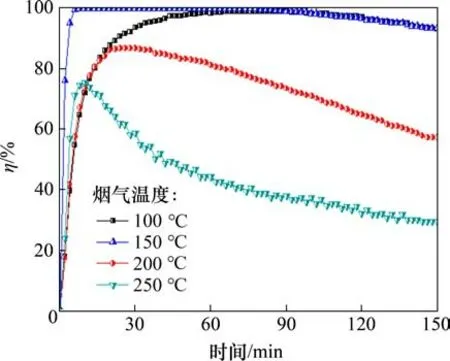
图4 烟气温度对吸附剂脱汞效率的影响Fig.4 Effect of temperature on mercury removal efficiency

图5 温度对单位质量吸附剂汞吸附量的影响Fig.5 Effect of temperature on mercury adsorption amount of per unit mass sorbent
2.1.3 SO2的影响
图6所示为SO2对吸附剂脱汞效率的影响。其中,O2的体积分数为6%,SO2的质量浓度为1 200 mg/m3,温度为150 ℃,平衡气为N2。由图6可知:Fe6Mn1以及Fe6Mn0.8Ce0.2在纯N2气氛下均保持高于75%的脱汞效率,Fe6Mn0.8Ce0.2相较于Fe6Mn1有着更高的脱汞效率。当气体中只加入1 200 mg/m3的SO2后,Fe6Mn1吸附剂在150 min 后脱汞效率只有33.03%,SO2对Fe6Mn1吸附剂有着极大的抑制作用。一方面是因为SO2与Hg0之间物理竞争吸附明显[17,20−24];另一方面,SO2与活性物质MnO2发生反应,在脱汞活性位点上形成硫酸盐类物质,使MnO2失去脱汞活性[25]。然而,虽Fe6Mn0.8Ce0.2的脱汞性能也受到了抑制,但最后还能保持在50%左右的脱汞效率,说明Ce 的掺入提高了Fe6Mn0.8Ce0.2的抗SO2性能,主要因为Ce 是亲硫性金属,SO2更易与Ce 的氧化物反应,从而能够保护Mn活性位点不被SO2毒害。当模拟烟气中同时再加入6%(体积分数)O2后,Fe6Mn1与Fe6Mn0.8Ce0.2的脱汞性能均显著提高,该结果与文献一致[8,25−26]。此时,Fe6Mn0.8Ce0.2的脱汞率接近于N2气氛下的脱汞率,可见在O2存在时,Ce可以提高吸附剂对SO2的耐受性。

图6 SO2对吸附剂脱汞效率的影响Fig.6 Effect of SO2 on mercury removal efficiency
图7和图8所示分别为O2的体积分数为6%时,SO2质量浓度对Fe6Mn0.8Ce0.2吸附剂脱汞效率和单位质量吸附剂汞吸附量的影响。由图7和图8可知:当SO2的质量浓度为1 200 mg/m3时,Fe6Mn0.8Ce0.2的脱汞效率以及单位质量吸附剂汞吸附量最大;当SO2的质量浓度为600 mg/m3和1 200 mg/m3作用下,吸附剂的脱汞效率及单位质量吸附剂汞吸附量相差甚少,而随着SO2质量浓度进一步提升,Fe6Mn0.8Ce0.2的脱汞效率有所降低,但吸附剂在SO2质量浓度为2 400 mg/m3下仍有70%的脱汞效率,说明吸附剂的抗SO2效果良好,具有一个较为宽阔的抗SO2质量浓度区间。
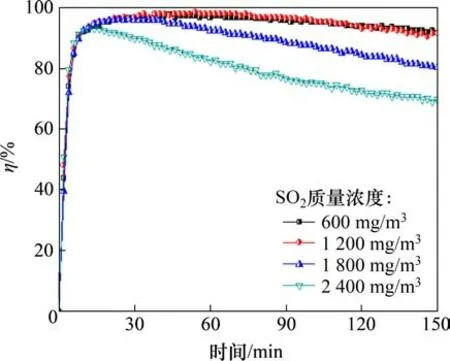
图7 SO2质量浓度对吸附剂脱汞效率的影响Fig.7 Effect of SO2 mass concentration on mercury removal efficiency
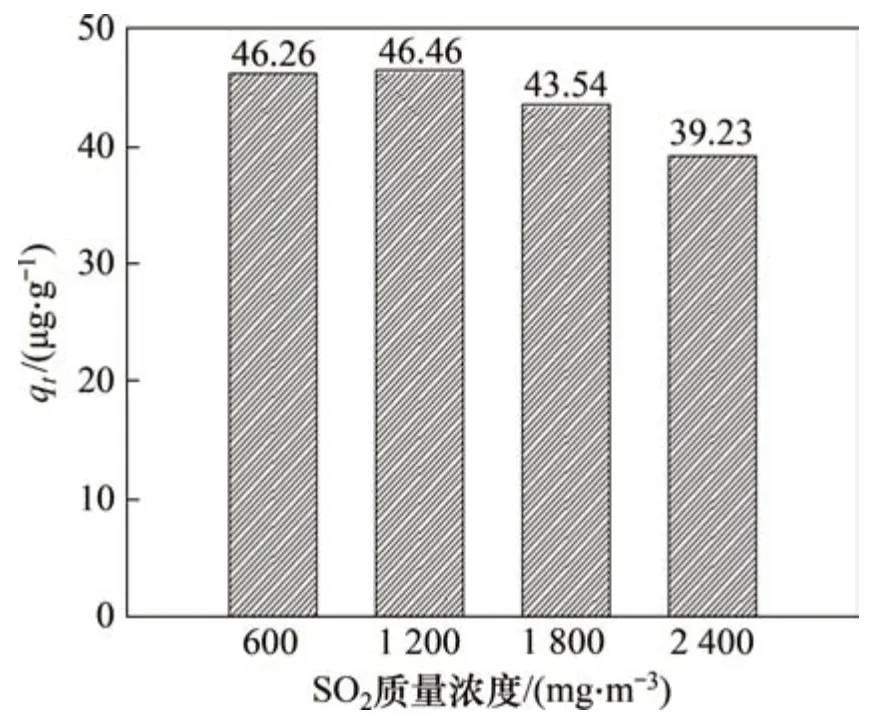
图8 SO2质量浓度对单位质量吸附剂汞吸附量的影响Fig.8 Effect of SO2 mass concentration on mercury adsorption capacity of per unit mass sorbent
2.1.4 Fe6Mn0.8Ce0.2的再生脱汞特性
图9所示为Fe6Mn0.8Ce0.2吸附剂汞程序升温脱附曲线图。从图9可以看出:该曲线仅有1个峰值为380 ℃的峰,该温度下对应的汞化合物形态为HgO[27]。HgO在380 ℃左右会分解生成单质汞,说明Hg 在Fe6Mn0.8Ce0.2表面吸附主要形成了HgO[28]。而在脱附曲线上并未观察到其他峰,说明此过程中只有强吸附得到的HgO,无其他形式的汞相关物质形成,温度高于150 ℃时开始有少量Hg0的逸出,说明存在少量被物理吸附的汞。
图10所示为再生次数对Fe6Mn0.8Ce0.2在N2气氛下脱汞效率的影响。由图10可知:经过5 次连续循环再生,Fe6Mn0.8Ce0.2的脱汞效率均保持在95%以上,表明该吸附剂具有较好的热再生性。主要因为Ce 具有较强的晶格氧贮存能力,再生后仍能保持原有的物相结构和化学活性;再生过程中,吸附剂表面的HgO充分分解,在O2的充分参与下,脱汞活性组分得到了很好的恢复,从而实现了吸附剂的高效再生。
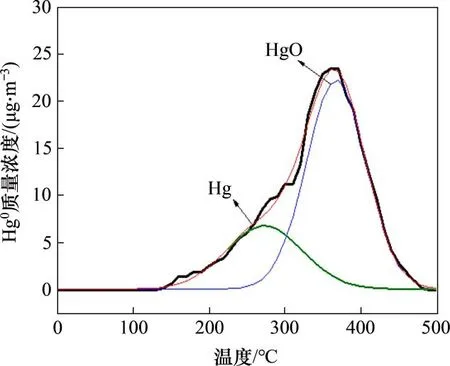
图9 Fe6Mn0.8Ce0.2汞程序升温脱附曲线Fig.9 Mercury temperature programmed desorption curve of Fe6Mn0.8Ce0.2 sorbent

图10 再生次数对脱汞效率的影响Fig.10 Effect of regeneration times on mercury removal efficiency
2.2 吸附剂表征分析
2.2.1 孔隙结构
图11和图12所示分别为吸附剂的N2吸附/脱附等温线与孔径分布(BJH),图12中,dV/dd为单位孔径下的孔容积。从图11可以看出:制备所得的吸附剂有着相似的N2吸附/脱附曲线。在相对压力p/p0较小时,吸附剂体积的缓慢增长说明其微孔非常少,而当p/p0大于0.6 时,吸附剂的体积显著增加,说明了吸附剂中存在中孔和大孔。根据吸附剂的平均孔径可知,吸附剂以中孔吸附为主。
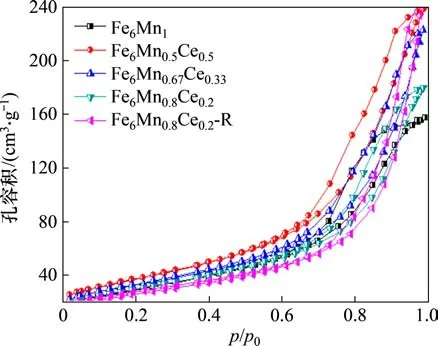
图11 N2吸附/脱附等温线Fig.11 N2 adsorption/desorption isotherm curves
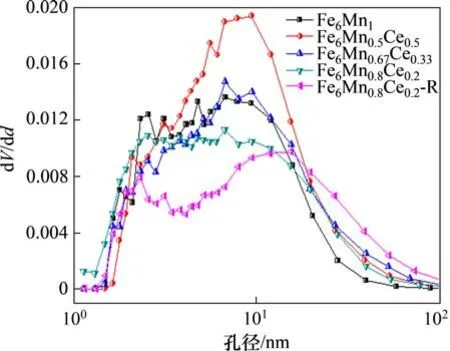
图12 孔径分布(BJH)Fig.12 Pore size distribution(BJH)
表1所示为吸附剂的孔隙结构参数。从表1可以看出:Ce元素的掺入提高了吸附剂的比表面积、平均孔径和孔容积,且吸附剂的比表面积随着Ce添加量增加而增加;但从2.1.1节可知,Ce的量增加并不能增加吸附剂的脱汞效率。可见,Ce 元素的掺入可以优化吸附剂的孔隙机构,但是Ce 含量的增加降低了脱汞活性组分Mn的含量,从而导致吸附剂的脱汞效率反而减小。5 次再生后的Fe6Mn0.8Ce0.2吸附剂,其比表面积略有降低,而平均孔径和总孔容积均比再生前的大。
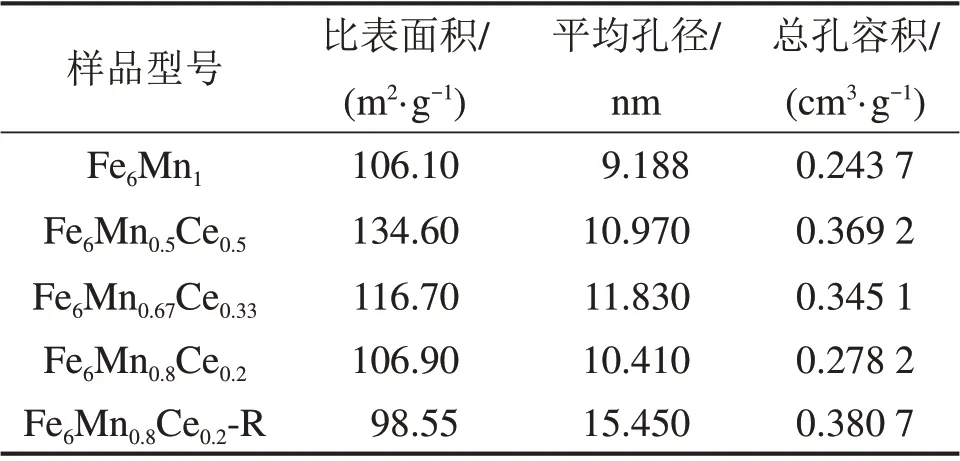
表1 吸附剂的孔隙结构参数Table 1 Pore structure parameters of sorbent
2.2.2 磁性分析(VSM)
图13所示为吸附剂的磁滞回线(VSM)谱图。从图13可以看出: Fe6Mn1,Fe6Mn0.8Ce0.2和Fe6Mn0.8Ce0.2-R的比饱和磁化强度分别为51.1,45.8和42.8 A·m2/kg,3 种吸附剂均表现出超顺磁性,矫顽力最小,磁化滞后可以忽略不计。Ce 的加入使得Fe6Mn1吸附剂的磁性略有降低,而经过5次热再生后的Fe6Mn0.8Ce0.2-R 磁力状态与Fe6Mn0.8Ce0.2的接近,这也意味着热再生不会影响吸附剂的磁性。磁化特性保证了磁性Fe6Mn0.8Ce0.2吸附剂暴露于外部磁场后不被永久磁化。因此,当磁场被移除时,吸附剂颗粒可以重新分散而不聚集,而热再生后的吸附剂磁性并未发生较大的变化,保证了吸附剂再生后分离回收的可能。
2.2.3 XRD分析
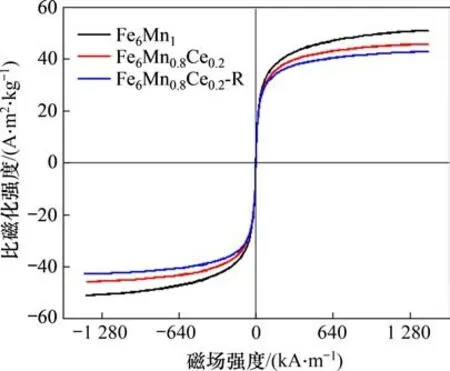
图13 吸附剂的VSM图Fig.13 VSM diagram of sorbent
图14所示为Fe6Mn1−xCex的XRD图谱。从图14可以发现吸附剂中存在多晶结构。当峰值位于2θ为29.8°,35.5°,43.6°,56.7°和64.4°时,其对应的物质为Fe3O4。图14中未发现明显的有关Ce 和Mn的晶体结构,可能是Ce与Mn已经全部掺入到吸附剂中,因此,吸附剂的磁性主要由Fe3O4提供[29]。而MnO2则是吸附剂中脱汞的主要活性物质,CeO2在得失电子中能够更好地提升吸附剂的氧化还原能力。不同Ce 掺杂量的吸附剂中的晶体结构和氧化物种类没有明显的区别,可能是因为Ce 的含量比较小;Fe6Mn0.8Ce0.2经过汞吸附−再生循环后,XRD 图谱显示吸附剂前后没有明显变化,但经过再生后的吸附剂又恢复了极高的脱汞能力,说明在再生过程中Ce 和Mn 的氧化物发生了氧化还原反应,补充了高价锰的含量,为持续脱汞提供了支持。

图14 吸附剂的XRD图谱Fig.14 XRD patterns of sorbent
3 结论
1)在150 ℃时,Fe6Mn0.8Ce0.2拥有最强的脱汞能力,Ce 掺入可优化吸附剂的孔隙结构,但过量的Ce 添加会降低脱汞活性组分Mn 的含量,导致Fe6Mn1−xCex的脱汞性能降低。
2)Ce的掺入提高了Fe6Mn0.8Ce0.2的抗SO2性能,在SO2与O2同时存在时,Fe6Mn0.8Ce0.2的抗SO2能力得到显著增强。
3)Fe6Mn0.8Ce0.2具有良好磁性与再生性能,再生后物化特性变化较小,5次再生循环脱汞均获得较高脱汞效率,脱汞产物为HgO。

