健康成人粪便中双歧杆菌的分离鉴定及其发酵乳体内特性研究
张旭东,庄伟清,李忠磊,刘 蔷,刘洪岐,陈代杰,邵 雷,谭 俊*
(1.上海医药工业研究院,上海 201203;2.上海交通大学 药学院,上海 200240;3.上海健康医学院协同科研中心,上海 201318)
双歧杆菌(Bifidobacterium)是1899年由法国学者TISSIER从母乳喂养的婴儿粪便中分离出的一种厌氧的革兰氏阳性杆菌[1],被广泛应用于牛奶、酸乳、婴儿配方奶粉、谷物类食品、奶酪和膳食补充剂等食品中[2],其在调节肠道菌群[3]、改善肠道炎症[4-5]、抗衰老[6]、抗肿瘤[7]和降血脂抗肥胖[8-9]等方面发挥着重要作用。如双歧杆菌在人体肠道内可产生大量的醋酸,同时生成乳酸和甲酸,造成肠道内的低pH环境,抑制有害菌和致病菌的生长,并促进大肠蠕动,防止下痢和便秘,促进人体代谢机能[10]。
双歧杆菌是人和动物肠道的优势菌群,影响着人类胃肠道的健康[11]。双歧杆菌从出生一次性获得,并终生携带,但随着年龄增长菌群数量会发生变化,呈先减少后稳定趋势[12]。成年人肠道内双歧杆菌数量处于稳定状态,老人或胃肠道病人的双歧杆菌水平较低甚至缺乏[13]。通过服用益生菌活菌产品来补充双歧杆菌数量是一种不错的选择,但是双歧杆菌必须保证一定的摄入量才能在人体肠道中定殖并发挥其功能[14],有研究报道[15-16],双歧杆菌的活菌制剂需要达到一定的活菌数才能发挥益生作用,维持益生功能的最低活菌浓度应不低于107CFU/mL。
本研究为筛选出一株具有潜在益生功能的菌株,采用MRS培养基,结合菌落形态观察和16S rDNA基因序列同源性分析,从健康的成人粪便中分离双歧杆菌。通过7 L发酵罐发酵试验筛选优良菌株,并利用该菌株制备发酵乳,研究其在小鼠体内的特性,为双歧杆菌产品的开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
粪便样品:采集上海地区健康成人(18~25岁)6人、性别随机、无肠胃病史、1月内未服用过抗生素药品、益生菌的新鲜粪便,立即加入装有无菌水的烧杯中,用无菌纱布封口转移至超净工作台中,备用,室温放置不超过2 h。
1.1.2 化学试剂
蛋白胨、牛肉粉、酵母粉(均为生化试剂):安琪酵母股份有限公司;脱脂奶粉:恒天然集团有限公司;氯化钠、无水乙酸钠(均为分析纯):连云港冠苏实业有限公司;氢氧化钠(分析纯):济南英出化工科技有限公司;葡萄糖、碳酸钠(均为分析纯):西王药业有限公司;L-半胱氨酸盐酸盐(分析纯):河南盛之德商贸有限公司;MgSO4·7H2O、MnSO4·4H2O、柠檬酸三铵(均为分析纯):国药集团化学试剂有限公司;TB GreenTMPremix ExTaqTMII:日本Takara公司;粪便基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司。
1.1.3 培养基[17]
MRS培养基:蛋白胨10.0 g/L,牛肉粉5.0 g/L,酵母粉4.0 g/L,葡萄糖20.0 g/L,吐温80 1 mL,K2HPO4·7H2O 2.0 g/L,CH2COONa·3H2O 5.0 g/L,柠檬酸三铵2.0 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,琼脂粉15.0 g/L,pH 6.2。115 ℃高压蒸汽灭菌20 min。
斜面培养基:蛋白胨3.0 g/L,酵母粉12.5 g/L,葡萄糖6.0 g/L,氯化钠5.0 g/L,无水乙酸钠3.0 g/L,L-半胱氨酸盐酸盐0.55 g/L,琼脂粉18.0 g/L,pH 6.8。121 ℃灭菌20 min。
种子培养基:即斜面培养基中不加琼脂。
发酵培养基:脱脂奶粉80.0 g/L,酵母粉5.0 g/L,碳酸钠3.8 g/L,pH 6.8。115 ℃高压灭菌20 min。
GAM培养基:上海士锋生物科技有限公司;BBL培养基:杭州百思生物科技有限公司。
1.1.4 实验动物
健康雄性无特定病原体(specefic pathogen free,SPF)级美国癌症研究所(institute of cancer research,ICR)小鼠(6~8周龄,质量(18±2)g):上海杰思捷实验动物有限公司。实验小鼠饲养于恒温恒湿环境中,自由饮食和饮水,定期灭菌消毒饲养笼。实验过程中,保持环境温度,室内光照/黑暗每12 h循环,饲养温度21~25 ℃,相对湿度40%~70%。整个实验过程中,相关手术操作均严格遵守动物伦理学原则。
1.2 仪器与设备
BIOTECH-7BG发酵系统:上海保兴生物设备工程有限公司;Concept400M厌氧培养箱:英国Ruskinn公司;AllegraTM 25R低温高速离心机:美国BECKMAN公司;E100光学显微镜:日本Nikon公司;DYY-8C电泳仪:北京市六一仪器厂;SPX-150B-Z生化培养箱:上海博讯实业有限公司;CA-500血液自动分析仪:山东兰桥医学科技有限公司;T100梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:伯乐生命医学产品有限公司;Nano Drop紫外分光光度计:美国Thermo scientific公司。
1.3 方法
1.3.1 菌株的分离和纯化
称取粪便4.0 g于20 mL无菌生理盐水中,使用涡旋混合器充分均化,2 000 r/min下离心10 min并悬浮用作人肠道细菌混合物。将细菌混合物用无菌水进行梯度稀释(10-3、10-4、10-5、10-6、10-7),将稀释液涂布于MRS固体培养基,37 ℃厌氧培养48~72 h。
挑选大量光滑、边缘水润、白色或乳白色的疑似菌落镜检,将出现明显分叉的菌落在GAM固体培养基进行划线,37 ℃厌氧培养24 h,挑选出严格厌氧条件下生长的菌落,进行革兰氏染色观察,选取革兰氏阳性菌落,进一步分离、纯化,直至镜检显示为纯菌。
1.3.2 菌株的分子生物学鉴定
提取分离菌株的DNA,以其为模板,采用特异性引物Lm26F/Lm3R对菌株的16S rDNA序列进行PCR扩增[18],PCR扩增产物经1%琼脂糖凝胶电泳检测后,送至上海生物工程技术服务有限公司进行序列分析。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA软件中的邻接(neighbor joining,NJ)法构建系统发育树,判定细菌种类,将细菌划分到属或种。
1.3.3 发酵乳的制备
取1支工作种子冻存管,取200 μL种子液到新鲜茄子瓶斜面上,涂抹均匀后置于37 ℃厌氧培养箱中培养24 h。用无菌接种铲将斜面上的全部菌苔刮落到新鲜的300 mL种子液体培养基中,置于37 ℃厌氧培养箱中培养24 h。按5%(V/V)的接种量将种子液接种于发酵培养基中,装液量6 L/7 L,发酵罐温度37 ℃,转速200 r/min,发酵过程pH控制为6.5,当补碱瓶中碱液补完后,再继续培养至发酵液pH降至5.5时发酵结束,将发酵液灌装至无菌瓶里保存。
1.3.4 发酵乳的活菌检测
采用平皿浇筑法[19]检测发酵乳中的活菌数:选择合适稀释度的菌液,分别取1 mL加入无菌平皿里,然后将室温的BBL培养基倒入培养皿中,立即混匀至平板凝固。每个稀释度重复3次,37 ℃倒置厌氧培养24 h,待菌落长好后,计数并计算出原菌液的活菌数,计算公式如下:
每毫升原菌液活菌数(CFU/mL)=同一稀释度3个平皿菌落平均数×稀释倍数。
1.3.5 优势菌株DD98的传代稳定性实验
将长双歧杆菌DD98在新鲜斜面上连续传代5次,将不同传代次数的菌株分别采用MRS液体培养基进行摇瓶发酵(37 ℃厌氧培养24 h),并对发酵液进行活菌计数,考察菌种的传代稳定性。
1.3.6 小鼠灌胃方案
90只小鼠随机分为3组,每组30只,一周适应性饲养后,分别灌胃生理盐水、发酵培养基和DD98发酵乳,灌胃剂量为0.2 mL/只,每天1次,共给药20 d。在灌胃第0(未灌胃)、5、10、15和20天以及停止灌胃15 d,即第35天时,每组随机选取5只小鼠,处死,解剖取脏器、粪便。此外,对第0、10、20和35天小鼠进行眼球取血用于血常规检测。
1.3.7 荧光定量PCR法检测肠道菌群
在无菌环境下解剖小鼠,冰上操作收集其肠道内已成型粪便3~4粒或结肠内容物200~250 mg,保存在-80 ℃超低温冰箱。分别使用粪便基因DNA提取试剂盒、Nano Drop紫外分光光度计对肠道内容物进行提取、纯化和浓度测定,并使用无菌水进行稀释。根据文献[20-23]方法,设计双歧杆菌属(Bifidobacterium)、肠球菌属(Enterococcus)、乳杆菌属(Lactobacillus)和大肠杆菌(Escherichia coli)的特异性引物(见表1),使用荧光定量PCR测定各肠道微生物菌群信使核糖核酸(messenger ribonucleic acid,mRNA),荧光定量RCR反应体系(10 μL):SYBR Green Mixture 5 μL,DNA模板1.0 μL,上游引物0.4 μL,下游引物0.4 μL,ROX Reference Dye 0.2 μL,双蒸水(ddH2O)3.0 μL。荧光定量RCR反应条件:95 ℃,30 s,循环1次;95 ℃,5 s,循环40次;65 ℃,5 s,循环40次。
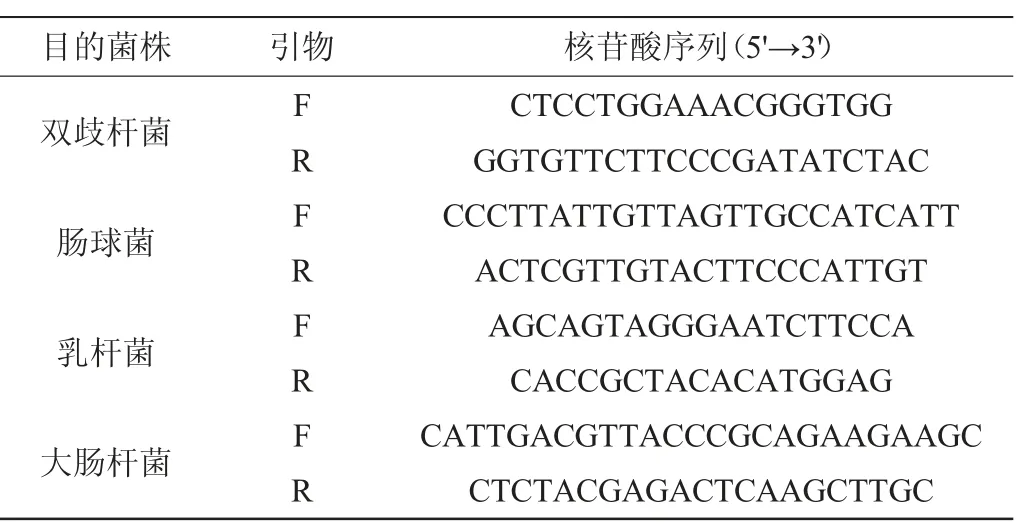
表1 本研究所用引物Table 1 Primers used in the study
1.3.8 脏器指数的测定[24-26]
各组小鼠解剖腹部后,摘取其脏器(心、肝、脾、肺、肾),用滤纸吸残血,称质量,计算脏器指数,计算公式如下:
脏器指数=各脏器质量/小鼠体质量
1.3.9 血常规检测[27-28]
采用阻抗法,在CA-500血液自动分析仪上进行血常规检测。共检测8种血常规指标,包括白细胞计数(white blood cell count,WBC)、红细胞计数(white blood cell count,RBC)、血红蛋白(hemoglobin,HGB)、血细胞比容(haematocrit,HCT)、红细胞平均体积(meancorpuscularvolume,MCV)、红细胞平均血红蛋白含量(mean corpuscular hemoglobin,MCH)、红细胞平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、血小板(platelet,PLT)。
1.3.10 数据分析
实验数据表示为“平均值±标准偏差”,使用SPSS 21.0软件统计分析实验数据,并进行相应显著差异分析。
2 结果与分析
2.1 菌株的分离及形态观察
经严格厌氧环境培养,成功分离到3株疑似双歧杆菌菌株,编号分别为P-1、P-2和P-3,3株分离菌株的菌落形态及细胞形态见图1。由图1可知,3株菌株的菌落形态无明显差异,质地柔软、边缘整齐、表面光滑、有白色或乳白色的凸起。3株菌革兰氏染色的结果均为蓝紫色,说明均为革兰氏阳性菌,与双歧杆菌染色结果一致,显微镜下观察到明显的“V/Y”分支。
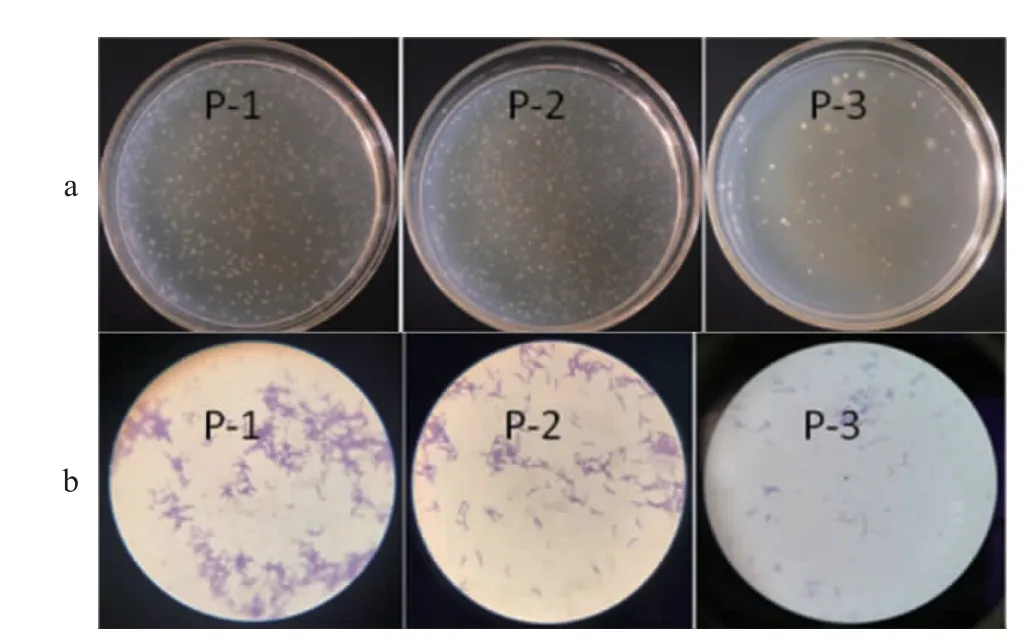
图1 菌株P-1、P-2和P-3的菌落(a)及细胞(b)形态Fig.1 Colonial (a) and cell (b) morphology of strains P-1,P-2 and P-3
2.2 分离菌株的分子生物学鉴定
3株分离菌株的系统发育树见图2。
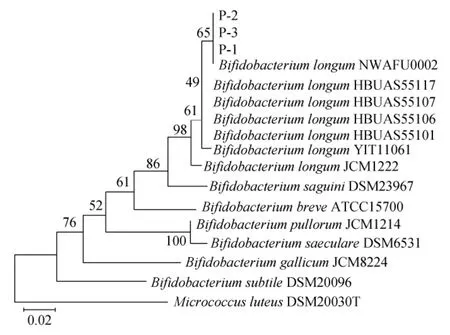
图2 基于16S rDNA基因序列菌株P-1、P-2和P-3的系统发育树Fig.2 Phylogenetic tree of strains P-1,P-2 and P-3 based on 16S rDNA gene sequences
由图2可知,菌株P-1、P-2和P-3均与长双歧杆菌(Bifidobacterium longum)NWAFU002聚于一支,亲缘关系最接近,由此可初步确定这3株菌株均为长双歧杆菌(Bifidobacterium longum)。
2.3 分离菌株发酵能力比较
菌株P-1、P-2和P-3在发酵培养基中发酵后,测定发酵乳中的活菌数,结果见图3。由图3可知,菌株P-2制备的发酵乳中长双歧杆菌活菌数最高,可达2.08×109CFU/mL,而且其发酵乳活菌数在消亡期的下降速度较慢。因此,选择菌株P-2为优势菌株,命名为DD98,保藏于实验室,用于后续实验。
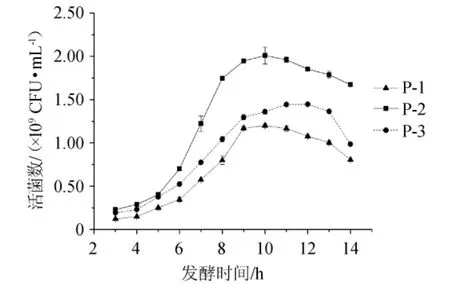
图3 菌株P-1、P-2和P-3制备的发酵乳中活菌数检测结果Fig.3 Detection results of viable counts in fermented milk prepared by strains P-1,P-2 and P-3
2.4 菌株DD98遗传稳定性研究
将长双歧杆菌DD98接种于新鲜斜面上连续传代5次,分别进行摇瓶发酵验证,活菌计数分别为2.17×109CFU/mL、2.06×109CFU/mL、2.12×109CFU/mL、2.23×109CFU/mL、2.11×109CFU/mL,结果表明,菌株DD98具有较好的遗传稳定性。
2.5 菌株DD98发酵乳体内特性研究
2.5.1 荧光定量PCR法分析小鼠肠道菌群
各组小鼠双歧杆菌、乳杆菌、肠球菌、大肠杆菌mRNA表达量见图4。由图4A和4B可知,正常小鼠每日连续灌胃DD98发酵乳,在第5、10、15、20天测得的双歧杆菌、乳杆菌mRNA表达量均显著高于灌胃生理盐水或发酵培养基组(P<0.05),说明菌株DD98发酵乳可以增加正常小鼠胃肠道内有益菌的表达。另外,当小鼠停止灌胃15 d后,灌胃菌株DD98发酵乳的正常小鼠在第35天测得的双歧杆菌的表达量仍显著高于灌胃生理盐水或培养基组(P<0.05),说明长期饮用菌株DD98发酵乳有利于胃肠道内双歧杆菌数目的维持;当小鼠停止灌胃15 d后,灌胃菌株DD98发酵乳的正常小鼠在第35天测得的乳杆菌mRNA表达量与灌胃生理盐水或培养基的组无显著性差异(P>0.05),说明暂停使用DD98发酵乳后,乳杆菌的表达恢复到了原先的水平。由图4C和4D可知,正常小鼠每日连续灌胃菌株DD98发酵乳,在第5、10、15、20天测得的肠球菌、大肠杆菌mRNA表达量均显著低于灌胃生理盐水或培养基组(P<0.05),说明菌株DD98发酵乳可以减少正常小鼠胃肠道内有害菌的表达。另外,当小鼠停止灌胃15 d后,灌胃菌株DD98发酵乳的正常小鼠在第35天测得的肠球菌、大肠杆菌mRNA表达量与灌胃生理盐水或发酵培养基组无显著性差异(P>0.05),说明暂停使用菌株DD98发酵乳后,肠球菌、大肠杆菌的表达恢复到了原先的水平。
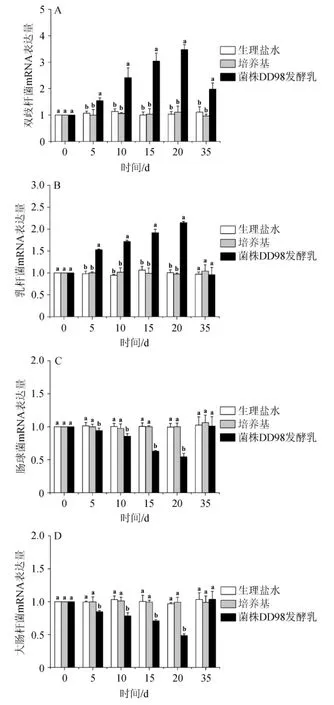
图4 各组小鼠双歧杆菌(A)、乳杆菌(B)、小鼠肠球菌(C)、大肠杆菌(D)mRNA表达量Fig.4 Expression quantity of mRNA of Bifidobacterium (A), Lactobacillus(B),Enterococcus(C)and Enterobacter(D)of mice in each group
2.5.2 体质量及脏器指数分析
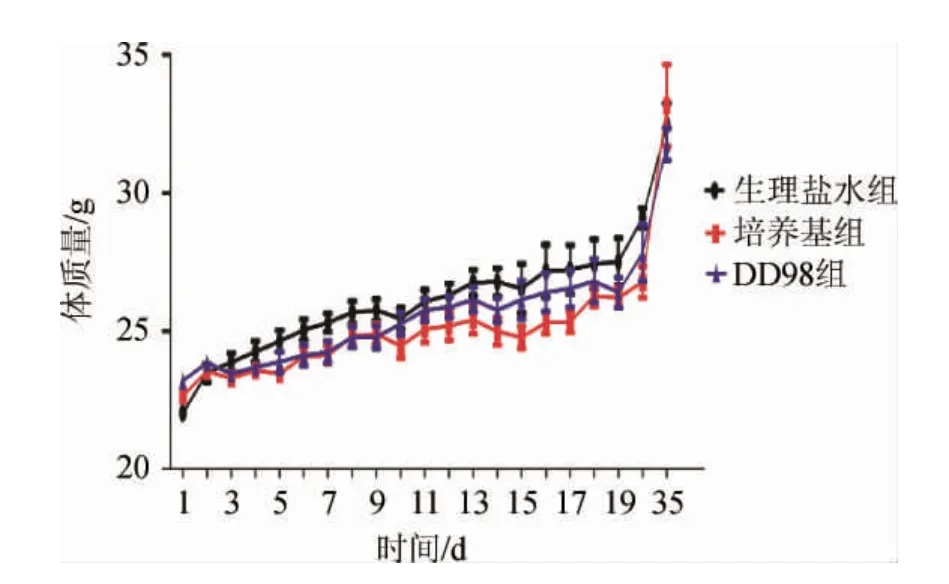
图5 各组小鼠体质量变化Fig.5 Changes of body mass of mice in each group
各组小鼠体质量变化见图5。由图5可知,随着时间的推移,灌胃生理盐水或发酵培养基或菌株DD98发酵乳的小鼠体质量均呈上升趋势且三组小鼠的体质量无显著性差异(P>0.05),说明灌胃菌株DD98发酵乳不会影响小鼠生长。
各组小鼠脏器指数见表2。由表2可知,连续灌胃菌株DD98发酵乳0、5、10 d后,正常小鼠脏器指数与连续灌胃20 d的生理盐水或发酵培养基的正常小鼠的脏器指数无显著性差异(P>0.05);而在第15天和第20天,与灌胃生理盐水或发酵培养基的小鼠相比有显著性差异(P<0.05)。停止灌胃15 d,即第35天,灌胃菌株DD98发酵乳的小鼠也与灌胃生理盐水或发酵培养基的小鼠的脏器指数无显著性差异(P>0.05),说明长期灌胃菌株DD98发酵乳有利于小鼠脏器的生长,对小鼠生长是有益的。
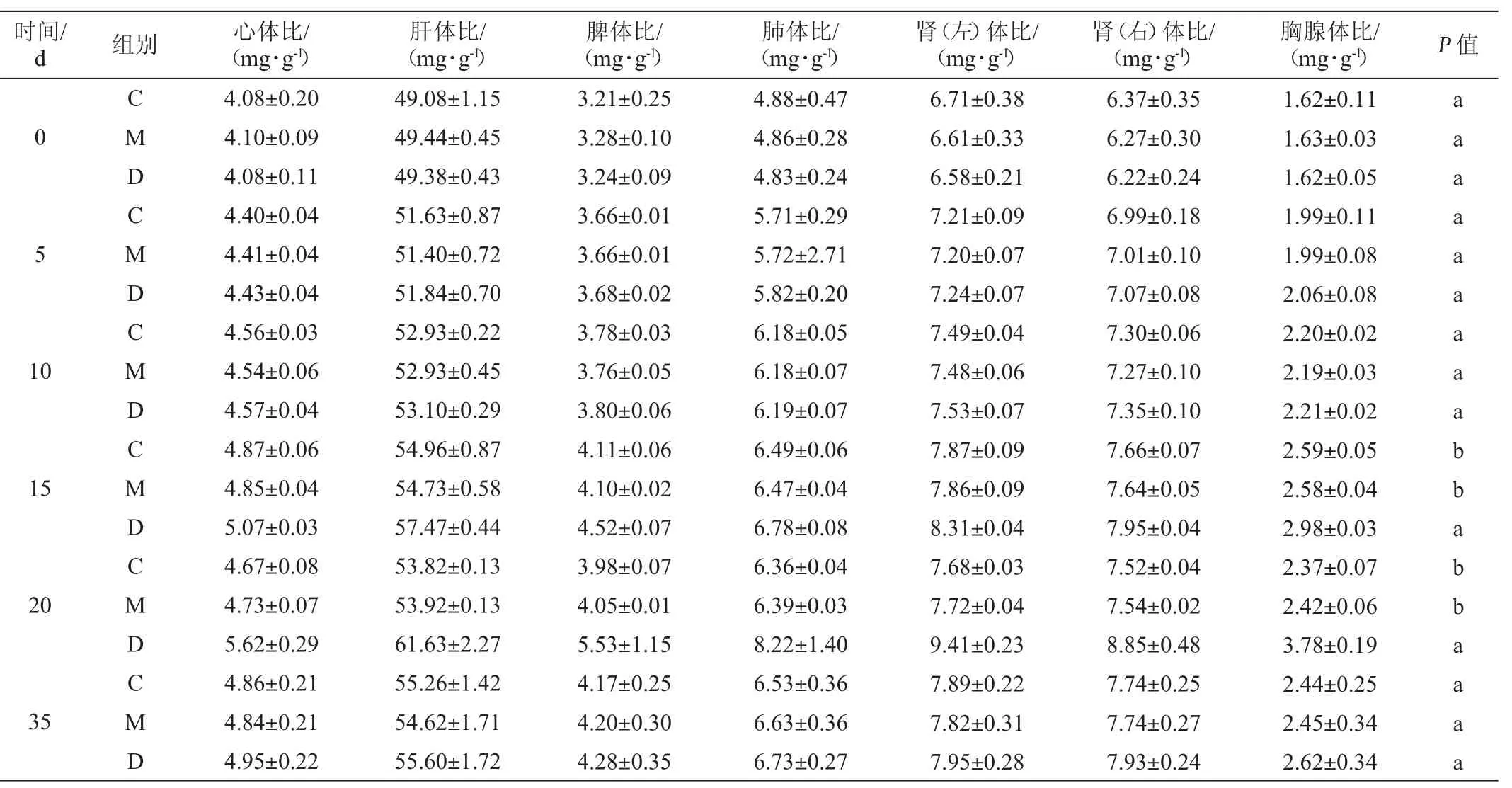
表2 各组小鼠脏器指数测定结果Table 2 Determination results of visceral coefficients in different groups of mice
2.5.3 血常规分析
各组小鼠血常规值见表3。由表3可知,连续灌胃20 d,灌胃菌株DD98发酵乳组正常小鼠血常规各项指标值与连续灌胃20 d的生理盐水或发酵培养基的正常小鼠无显著性差异(P>0.05)。停止灌胃15 d,即第35天,灌胃菌株DD98发酵乳组小鼠也与灌胃生理盐水或发酵培养基的小鼠的血常规的各项指标无显著性差异(P>0.05),说明服用菌株DD98发酵乳不会对正常小鼠产生不良反应。

表3 各组小鼠血常规值测定结果Table 3 Determination results of blood routine index of mice in different groups of mice
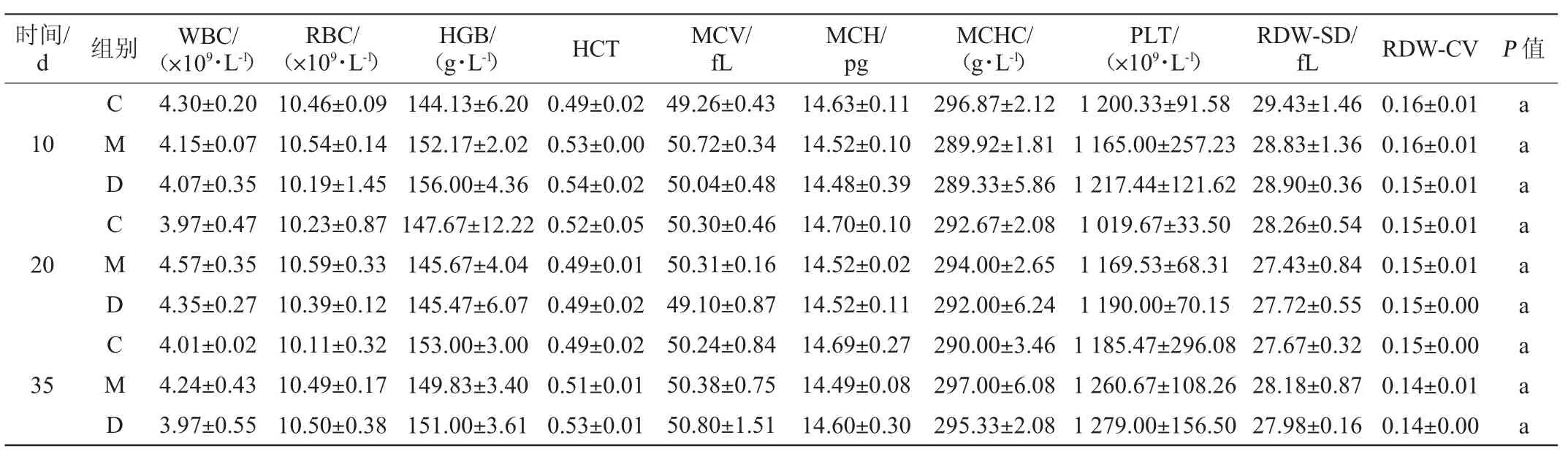
续表
3 结论
本研究采用MRS培养基,结合菌落形态观察和16SrDNA基因序列同源性分析,从健康的成人粪便中分离到3株长双歧杆菌(P-1、P-2、P-3)并鉴定,其中,菌株P-2发酵能力较强,活菌数最高,遗传稳定较好,被命名为DD98。将菌株DD98作为长双歧杆菌产品开发的优势菌株,用于菌株DD98发酵乳研究。通过正常小鼠体内特性研究发现,服用菌株DD98发酵乳能显著增加小鼠胃肠道内有益菌、减少有害菌的表达(P<0.05),具有调节肠道菌群的作用。此外,能维持小鼠正常的体质量、血常规指数,有利于小鼠脏器的生长,这对菌株DD98产品的开发奠定了基础。

