舍曲林在抑郁症大鼠模型抗抑郁中的作用及大鼠海马凋亡信号通路相关蛋白的差异性表达
王爱芹,褚延乐,赵明军,冯砚国,张瑞岭*
1.新乡医学院 第二附属医院,河南 新乡 453002;2.郑州大学第二附属医院 药学部,郑州450014
抑郁症是一种临床常见的以心境低落,并伴随认知功能障碍、快感缺乏、精神运动延迟等为主要临床特征的心理疾病,严重者会出现绝望、幻觉等症状和自杀倾向[1]。有研究[2]指出,Toll样受体4(TLR4)作为重要的天然免疫系统信号通路,参与了抑郁症脑损伤的病理生理变化。舍曲林是临床广泛应用于抗抑郁治疗的一种5 羟色胺(5-HT)再摄取抑制剂(SSRIs),治疗抑郁症效果明确,但其具体的作用机制尚不明确。
1 材料与方法
1.1 材料
动物:54 只健康成年雄性SD 清洁级大鼠,2~3月龄,体重200~250 g,均由我院医学科研实验动物中心提供(合格证号:201900700032)。实验前先对大鼠进行旷场实验,通过行为实验对大鼠进行筛选分组,记录5 min 内的水平运动和垂直运动评分,纳入得分接近的大鼠,排除其余大鼠。所有入选的实验大鼠均在室温25~28 ℃、相对湿度45%~55%的环境中适应性饲养7 d,标准饮食,自由饮水,12/12 h 明/暗光照。所有实验动物的处理均符合动物伦理委员会的动物伦理学要求。
1.2 药物及试剂
盐酸舍曲林片(辉瑞制药有限公司,国药准字H10980141,50 mg)。兔 抗 鼠Bcl-2、Bax、TLR4、MyD88 多克隆抗体(美国Santa 公司),兔抗鼠Caspase3、Caspase9 多克隆抗体(美国Abcam 公司)。HRP 标记的羊抗兔IgG 二抗(武汉博士德公司),RNA 提取试剂盒、PCR 试剂盒(宝生物工程有限公司),RIPA 组织细胞快速裂解液(上海基尔顿生物科技有限公司),BCA 总蛋白定量试剂盒(德国Thermo Scientific 公司),ECL 高灵敏度化学发光检测试剂盒(北京康为试剂生物科技有限公司),TRIZOL Reagent(Invitrogen)、M-MLV cDNA 合成试剂盒(赛兰博生物有限公司)等。
1.3 仪器
HTT700T 透射电子显微镜(日本日立公司),CLIPSE 50i 型显微镜及摄像系统(日本Nikon 公司),MRl812 型台式高速低温离心机(法国JOUAN公司),全自动凝胶成像系统(Eppendorf 公司),MK3型酶标仪(芬兰雷勃酶标仪公司),UV-2550 型紫外分光广度仪(13 本岛津公司),DYY-IIl27B 垂直电泳槽及稳压稳流电泳仪(北京六一仪器厂),5810R 型台式高速冷冻离心机(Eppendorf),PCR System 扩增仪2700(Applied Biosystems 公司),荧光定量PCR仪ABI 7300(ABI 公司)等。
1.4 方法
1.4.1 实验大鼠分组及模型制备
54 只大鼠进行旷场实验(OFT)后应用随机数字表法随机分为对照组、模型组和舍曲林组,各18只。对照组不给予任何处理,模型组和舍曲林组应用21 d 慢性不可预见性温和刺激(CUMS)法建立抑郁症大鼠模型,具体方法为:21 d 内给予大鼠禁水24 h、禁食24 h、12 ℃冷水浴5 min、制动3 h、45 ℃环境5 min、30 V 电压电击足底(每次10 s,间隙1 min,共计20 次)、悬吊5 min、100 dB 电铃声5 min、大卵圆钳夹尾近体侧1/3 处1 min 等9 种不同刺激,1 种/d,使用2 次,随机安排,注意不连续使用同种刺激。通过比较造模第21 天与基线OFT、糖水偏好实验(SPT)和体质量监测结果验证模型是否建造成功,若大鼠出现持续的快感消失、精神运动性抑制、情绪减退等常见的人类抑郁症患者行为特征,说明建抑郁症模型造模成功。本研究中以大鼠自发活动距离低于基线2 s、糖水偏好度降低超过2 s 且体质量偏低超过2 s 3 个标准同时满足则表示建模成功。舍曲林组大鼠从建模开始第2 天起每日8 时至9 时给予盐酸舍曲林片腹腔注射,将人与大鼠按照体表面积换算后按照10 mg/kg 剂量给药,连续注射3 周。对照组和模型组大鼠给予同等体积生理盐水腹腔注射,连续注射3 周。
1.4.2 行为学评价
1)旷场实验(OFT)。自制100 cm×100 cm×42 cm 大小敞口木箱,内壁全部涂黑,将底部划分为等面积25 格。将大鼠置于敞箱的中间格位置,观察记录大鼠5 min 内的水平运动穿越格子数,记录水平运动得分(1 格记1 分,大鼠至少3 爪进入方格才记分),同时记录大鼠的直立次数,记垂直运动得分(大鼠两前爪腾空或攀附箱壁至双足放下记1 次,记1 分)。水平运动评分可反映大鼠活动度和兴奋性,垂直运动评分可反映大鼠对陌生环境的探究能力和好奇心。
2)糖水偏好实验(SPT)。实验前先将1 瓶纯水和1 瓶含1%蔗糖水放在笼中,12 h 后将两瓶水位置调换,大鼠自由饮用24 h。不禁食但禁水24 h 后在每个笼中放置150 mL 纯水和150 mL 1%蔗糖水,2 h 后调换两瓶水,记录4 h 内大鼠纯水和蔗糖水摄入量,计算糖水偏好度(糖水消耗量与总液体消耗量比率)。
3)鼠悬尾实验(TST)。在大鼠尾端2 cm 处系悬挂装置绳,将大鼠吊起悬空(距离地面约50 cm),用胶带固定好,避免实验过程中因挣扎而脱落。记录大鼠适应1 min 后5 min 内悬挂状态下的不动时间。该实验目的在于检测在可变性行为状态下时大鼠的绝望程度。
4)强迫游泳实验(FST)。将大鼠置于高20 cm,边长15 cm,装有温水的玻璃器皿中,视频记录大鼠6 min 内的行为变化情况,适应2 min 后记录大鼠4 min 内身体悬浮的不动时间。
1.4.3 Nissl 染色
各组分别取9 只大鼠在建模前和建模后行为学指标检测后进行取材和染色。大鼠腹腔注射40 mg/kg 剂量的质量分数10%水合氯醛麻醉。开胸,心脏暴露,经左心室主动脉插管,生理盐水100 mL 进行快速灌注冲洗,之后滴注500 mL 质量分数4%多聚甲醛,先快后慢,时间约1 h。开颅取脑组织浸泡固定在质量分数4%多聚甲醛中,时间4~6 h,之后4 ℃下梯度蔗糖渗透沉底,切片,厚度约25 μm,取背侧海马最大部位10 张连续脑片,PBS 接片。在涂明胶的载玻片上贴上奶片,晾干后置于氯仿中,5 min 后将其置于体积分数100%丙酮中保留15 min。对载玻片采用梯度乙醇脱水,在焦油紫染液中染色20 min,蒸馏水洗涤,梯度乙醇处理,之后置于体积分数100%氯仿中5 min,应用分化剂处理2~3 min。在梯度乙醇中脱水,之后置于二甲苯中1 min,拨片封闭、晾干后在显微镜下观察大鼠海马组织神经元形态学变化,并拍照记录。
1.4.4 Western blot 检测大鼠海马细胞凋亡信号通路相关蛋白含量
取海马组织加入RIPA 裂解液,用匀浆器在冰上研磨,4 ℃下12 000 r/min 离心15 min,离心半径10 cm,分离血清。用Bradford 法测定蛋白浓度,定蛋白浓度为2 μg/μL,95 ℃下水浴5 min。取蛋白样品15 μg,每孔上样20 μL,经SDS-PAGE 电泳分离、转膜,5%牛血清白蛋白封闭60 min。分别加入特异性 一 抗(Bcl-2、Bax、TLR4、MyD88、Caspase3、Caspase9),4 ℃下孵育过夜。TBST 洗膜3 次,每次5 min,加入相应的二抗,室温下孵育60 min,洗膜3次,每次5 min。加入ECL 发光液曝光显影。用Image J进行图像分析,蛋白水平用目的蛋白与内参β-actin 灰度比值表示。
1.4.5 qRT-PCR 法检测大鼠海马细胞凋亡信号通路相关蛋白mRNA 表达水平
取各组大鼠海马组织100 mg,用Trizol 法进行总RNA 提取。琼脂糖凝胶电泳检查RNA 完整性,紫外分光光度计测定RNA 浓度,A280/A260 比值在1.8~2.0 范围内为合格。取5 μgRNA 为模板,按照M-MLV cDNA 合成试剂盒说明书进行反转录cDNA,反转录反应42 ℃5 min,反转录酶失活反应95 ℃2 min,4 ℃终止反应。引物来自上海生工工程有限公司。PCR反应体积为:10 μL SYBR Green,7 μL DECP水,0.5 μL PrimerF,0.5 μL Primer R,2 μL模板,共计20 μL。每样本做3 个复孔,PCR 反应条件:95 ℃预变性2 min;95 ℃60 s,58 ℃25 s,72 ℃30 s,循环次数45 s,各基因表达水平应用相对定量2-ΔΔCt表示。
1.5 统计学分析
本研究数据资料的统计学分析和处理均应用SPSS 23.0 软件包进行。用表示计量资料,比较应用单因素方差分析t检验。P<0.05表示差异存在统计学意义。
2 结果
2.1 大鼠行为学指标评价结果比较
对照组、模型组和舍曲林组建模前大鼠SPT 偏好度、OFT 水平得分和垂直得分、TST 时间、FST 时间比较差异均无统计学意义(P>0.05)。建模后模型组SPT 偏好度显著降低,OBT 水平运动得分和垂直运动得分均显著减小,TST 和FST 时间均显著延长,与建模前比较差异均存在统计学意义(P<0.05);对照组上述行为学变化指标与建模前比较均无明显变化(P>0.05);建模后舍曲林组SPT 偏好度、OBT 水平运动得分和垂直运动得分及TST 和FST 不动时间与模型组比较差异均有统计学意义(P<0.05),见表1。
表1 3 组大鼠行为学指标评价结果比较()
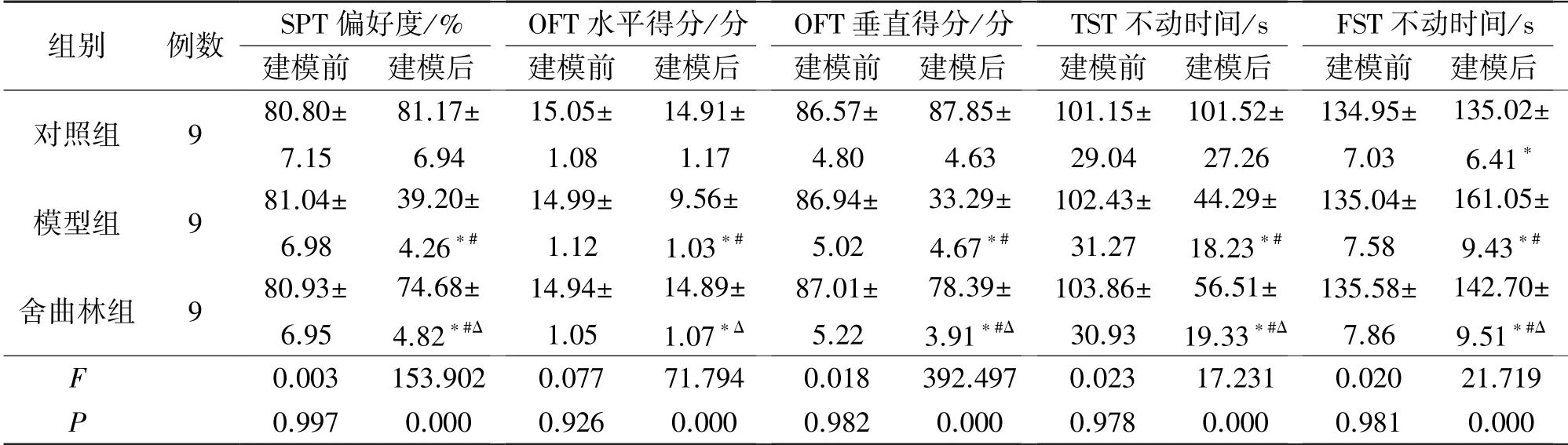
表1 3 组大鼠行为学指标评价结果比较()
注:与建模前比较,*P<0.05;与对照组比较,#P<0.05;与模型组比较,ΔP<0.05
2.2 大鼠海马CA1 区神经元形态学变化
对照组海马CA1 区锥体细胞神经元排列整齐,形态规则,胞体为锥状,胞浆中清晰可见尼氏质;模型组海马CA1 区锥体细胞神经元细胞肿胀,排列稀疏,数量减少,细胞间隙增大,很多细胞胞浆中尼氏小体深染,数目减少,清晰度降低,出现大量核固缩、空泡、坏死等现象;舍曲林组海马CA1 区锥体细胞形态学较模型组有不同程度改善,神经元数量增加,细胞排列较为整齐,尼氏小体数量较模型组增加,固缩、空泡、坏死等现象都明显减少。
2.3 大鼠海马凋亡信号通路相关蛋白含量比较
建模后模型组脑组织TLR4、MyD88 及Bax、Bcl-2、Caspase-3、Caspase-9 蛋白含量较建模前均明显升高,Bcl-2 显著降低。而舍曲林组与模型组比较TLR4、MyD88 及Bax、Caspase-3、Caspase-9 mRNA 表达水平明显降低,Bcl-2 则显著升高(P<0.05),见表2。
表2 3 组大鼠海马凋亡信号通路相关蛋白含量比较(,相对表达量/β-actin)
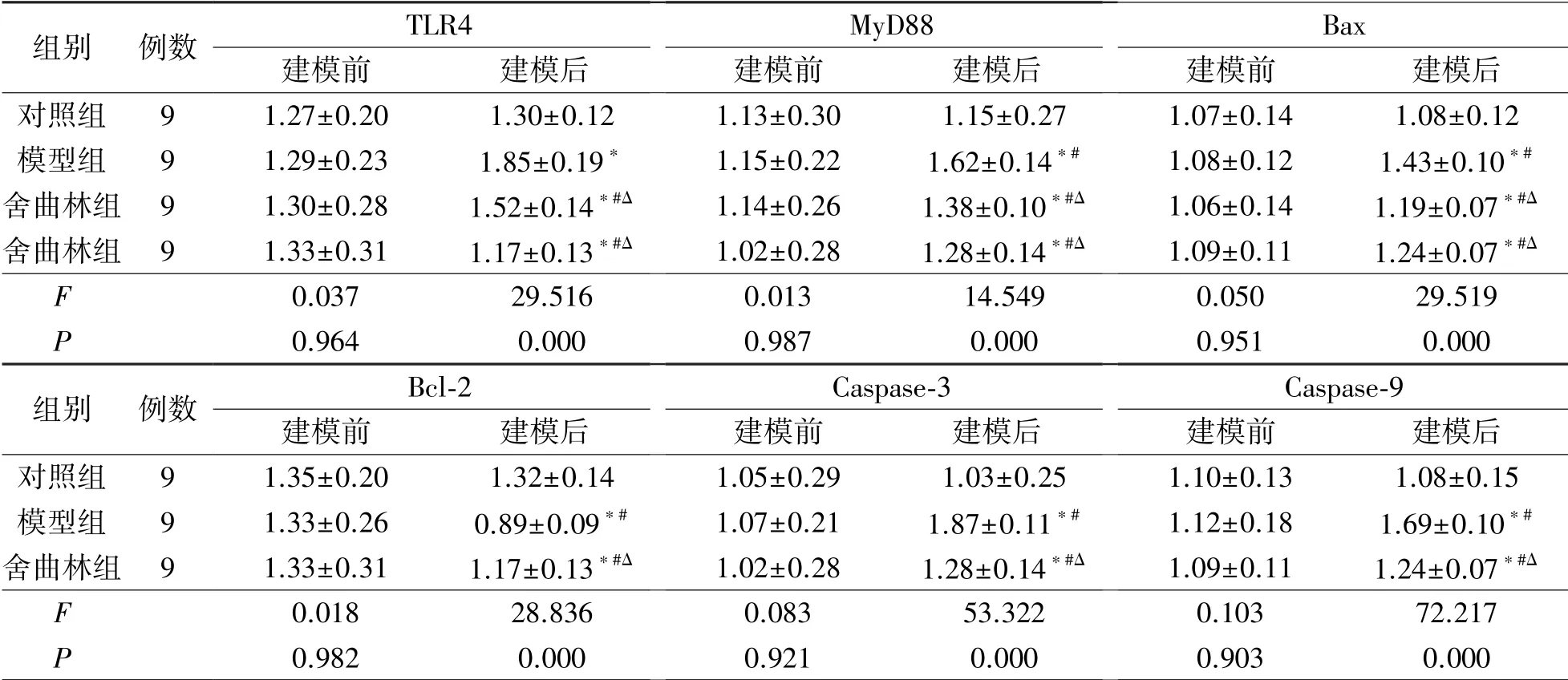
表2 3 组大鼠海马凋亡信号通路相关蛋白含量比较(,相对表达量/β-actin)
注:与建模前比较,*P<0.05;与对照组比较,#P<0.05;与模型组比较,ΔP<0.05
2.4 3 组大鼠海马凋亡信号通路相关蛋白mRNA表达水平比较
建模后模型组脑组织TLR4、MyD88 及Bax、Bcl-2、Caspase-3、Caspase-9mRNA 表达水平较建模前均明显升高,Bcl-2 显著降低(P<0.05),而舍曲林组与模型组比较TLR4、MyD88 及Bax、Caspase-3、Caspase-9 蛋白含量明显降低,Bcl-2 则显著升高(P<0.05),见表3。
表3 3 组大鼠海马凋亡信号通路相关mRNA 表达比较(,2-ΔΔCt)
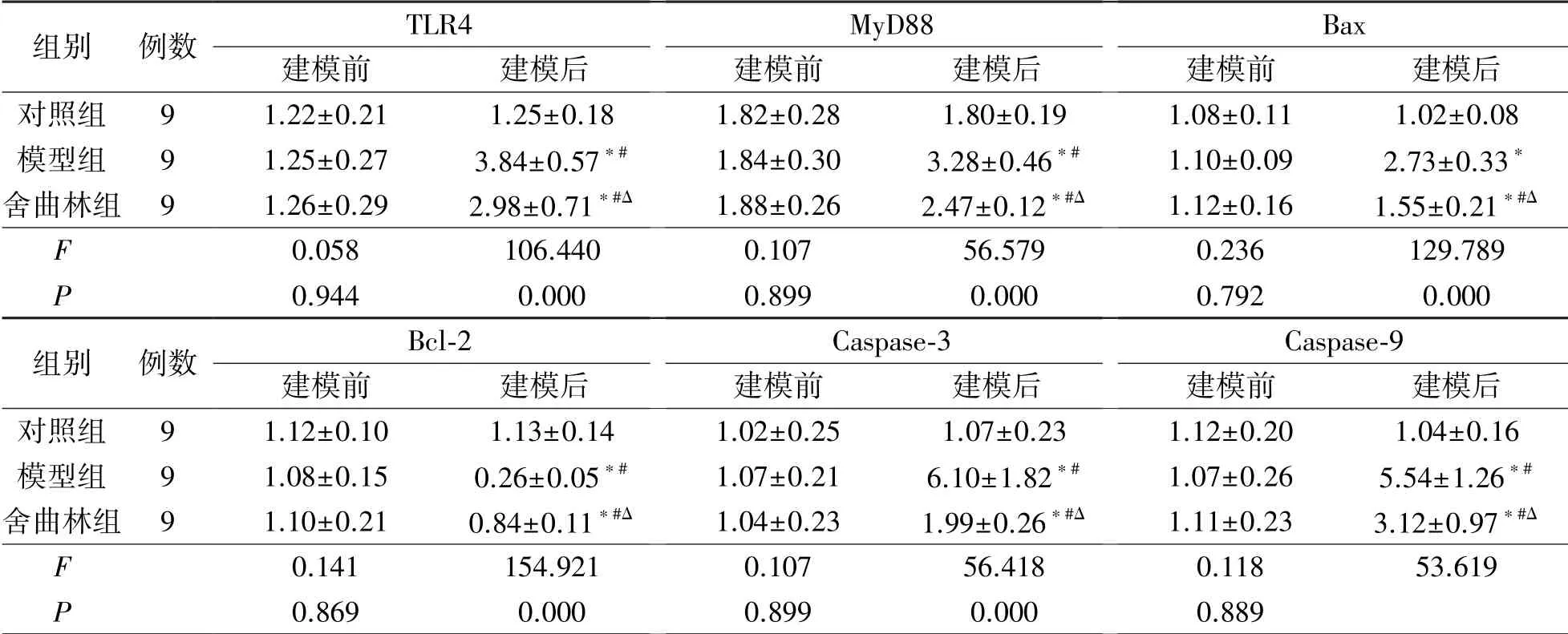
表3 3 组大鼠海马凋亡信号通路相关mRNA 表达比较(,2-ΔΔCt)
注:与建模前比较,*P<0.05;与对照组比较,#P<0.05;与模型组比较,ΔP<0.05
3 讨论
CUMS 法模型是应用不可预见的轻度应激因子长时间对大鼠产生持续性刺激而引发大鼠抑郁症状,与人类抑郁症的发生发展机理很接近[3]。本实验中,我们对模型组和舍曲林组大鼠应用CUMS 法检测抑郁症模型,行为学试验证实大鼠处于抑郁状态,表现出快感缺乏、兴趣减低等与临床抑郁症相似的症状,模型建立成功。SPT 偏好度是指1%糖水偏嗜度,其可反应动物活动度;OFT 实验是评价大鼠在新环境中紧张度、探究行为、自主行为的一种行为学评价方法,水平运动能反映动物活动度,垂直运动能反映大鼠对新环境的好奇程度;TST 实验目的在于检测在可变性行为状态下时大鼠的绝望程度;FST又称绝望实验,能反映出大鼠在不可逃避的应激下的抑郁反应[4-5]。本研究结果显示,对照组大鼠建模前后上述行为学检测指标均无明显变化。模型组SPT 偏好度显著降低,OBT 水平运动得分和垂直运动得分均显著减小,TST 和FST 时间均显著延长。舍曲林组大鼠经治疗后上述指标较模型组均有明显改善,提示模型组和舍曲林大鼠均出现不同程度的精神活动下降、快感缺乏、兴奋降低及一系列绝望行为等抑郁症状。而经过舍曲林抗抑郁治疗后这些症状有显著改善,即舍曲林对CUMS 模型大鼠的抑郁症状有改善作用,与既往研究结论一致[6]。
目前,抑郁症的发生机制尚不完全明确,研究[7]显示,抑郁症动物模型海马神经元存在明显的萎缩、凋亡、胞体肿胀和神经营养低下等特点。海马是大脑中枢系统中重要的与学习、情绪和记忆等行为功能有密切关系的区域,也是慢性应激刺激最易损伤的靶区域。本研究Nissl 染色结果显示,模型组大鼠海马CA1 区域神经元表现出数量减小、排列紊乱、细胞肿胀、间隙增加、尼氏小体数量减少或消失等病理改变,对照组神经元密集、排列整齐、胞浆中尼式小体清晰可见,而舍曲林组CA1 区神经元的海马结构异常处于模型组和对照组之间,相比模型组明显减轻。由此可见,抑郁症大鼠海马萎缩,神经元大量减少且形态学改变明显,同时经舍曲林治疗后大鼠海马神经元损伤的病理变化有显著缓解,与以往研究结果一致[8]。
细胞凋亡是各种基因调控下机体为维护内环境稳定而发生的受胞内和胞外途径作用的程序化细胞死亡过程。国内外研究[9]显示,抑郁症引起的海马损伤与细胞死亡信号通路的异常活化有关,引起通路中凋亡相关蛋白的异常表达。线粒体通透性改变是细胞凋亡发生的先导。Bcl-2 家族是目前公认的与细胞凋亡密切相关的基因,其控制着线粒体内外膜通透性,主要包括促凋亡蛋白Bax 和抗凋亡蛋白Bcl-2,二者比例能引起线粒体通透性改变,决定细胞是否发生凋亡[10]。Caspase 家族在细胞凋亡信号转导级联反应中发挥着关键作用,其参与了凋亡启动和整个过程的调控。Caspase-3 是死亡蛋白酶,是凋亡的主要执行者,可激活各种凋亡刺激因子,在caspase 级联反应中处于核心位置;caspase-9 是凋亡启动因子[11]。此外,抗凋亡基因Bcl-2 能通过与凋亡启动因子直接结合来抑制caspase-3 激活,Caspase-3 激活的抑制也会反馈性抑制促凋亡蛋白Bax 激活,从而能抑制细胞凋亡的发生[12]。Toll 样受体(TLR)是公认的与天然免疫系统密切相关的信号通路,其最突出的生物学功能是促进细胞因子合成分泌,促进抗原提呈细胞成熟,引发炎症反应。TLR4 在信号转导中主要存在两条途径:髓样分因子88(MyD88)依赖信号途径和β 干扰素结构域衔接蛋白依赖性途径。在前一途径中,TLR 可通过C 端TIR 结构域与接头分子MyD88 结合来激活下游白介素1 受体相关激酶家族,最终使核转录因子κB(NF-κB)激活。活化的NF-κB 与海马神经细胞凋亡密切相关,其会进入细胞核内启动肿瘤坏死因子α 等炎症介质,对细胞凋亡产生促进性作用,导致脑损伤发生[13-14]。本研究结果显示,建模后模型组脑组织TLR4、MyD88 及Bax、Caspase-3、Caspase-9 蛋白含量和mRNA 表达水平较建模前均明显升高,Bcl-2 显著降低,而舍曲林组与模型组比较TLR4、MyD88 及Bax、Caspase-3、Caspase-9 蛋白含量和mRNA 表达水平明显降低,Bcl-2 则显著升高(P<0.05)。提示抑郁症大鼠海马神经元凋亡可能与Bax、Bcl-2、Caspase9、Caspase3 和TLR4、MyD88 等凋亡信号通路相关蛋白异常表达有关,与郭郁等[13]的研究一致,而舍曲林的抗抑郁作用可能与其对这些蛋白表达的调控有关,有关其具体的作用机制仍需进一步探讨。
综上所述,舍曲林能明显改善慢性应激抑郁症大鼠抑郁样行为,减轻大鼠神经元损伤和凋亡。其作用机制可能与其对凋亡信号通路Bax、Caspase-3、Caspase-9 蛋白异常表达的调节和对TLR4/MyD88通路活化的抑制作用有关。

