秦岭太白山不同林带土壤微生物呼吸速率及其影响因素
胡 汗,马寰菲,白红英,郭垚鑫,任成杰,赵发珠,*
1 陕西省地表系统与环境承载力重点实验室,西安 710127
2 西北大学城市与环境学院,西安 710127
3 西北大学生命科学学院,西安 710127
4 西北农林科技大学,杨凌 712100
土壤呼吸(RS)是陆地生态系统碳循环的重要环节,也是土壤碳库向大气输出碳的主要途径[1]。通过土壤呼吸,土壤每年向大气排放的碳达到68—98 Pg[2],大约是全球化石燃料燃烧所排放的碳的10倍[3]。而森林土壤作为陆地生态系统中最大的有机碳库(约800—1200 Pg C),其含量约占全球土壤碳库的40%[4-5],大约是大气碳库的1.2倍,植被碳库的2倍,在全球的碳循环中起到关键作用[6-7]。因此,即使森林的土壤呼吸发生微小的变化,都会对大气中CO2含量和全球的碳平衡产生重大影响[8-9]。降低森林土壤的有机碳排放,增加其固碳能力无疑是研究者目前面对的重要课题[10-11]。
土壤呼吸主要由微生物呼吸和根系呼吸产生[12]。研究表明,根系呼吸提供的CO2在土壤呼吸中占30%—50%[13],但是由于抑制根系呼吸会导致植被冠层光合作用的减弱[14],并且微生物呼吸对温度等环境因子的变化更为敏感,因此降低土壤的碳排放的关键在于抑制土壤微生物呼吸。微生物作为土壤中最活跃的部分,其呼吸作用具有非常明显的时间与空间上的差异性[15]。较多研究结果表明微生物呼吸是由土壤温度、土壤湿度、土壤类型等诸多因素的共同控制[16-17]。例如,Stielstra[18]认为土壤温度和湿度是影响微生物呼吸的重要因子;Liu[19]的研究表明土壤中微生物群落结构的差异会影响微生物呼吸的大小。并且Sinsabaugh[20]的研究证实微生物所分泌的胞外酶是影响微生物呼吸的一个重要因素。但是胞外酶种类繁多,性质迥异,不同类型的胞外酶只能催化其特定的底物水解[21],并且酶活性对温度的敏感性较高,温度对酶活性的影响也会辐射到微生物呼吸上[22]。例如,β-N-乙酰氨基葡萄糖酶(β-N-Acetyl-glucosaminidas,简称NAG)是用于催化几丁质水解的末端反应,而在15—35 ℃上其活性持续增加,从而几丁质在35 ℃时会得到最充分的水解;而β-葡萄糖苷酶(β-glucosidase,简称BG)则用于催化结构性的葡萄聚糖水解的末端反应,其活性在25 ℃相对较高,从而葡萄聚糖在25 ℃时水解较为充分[23]。尽管目前对于微生物呼吸变化及其影响因素在众多生态系统已有所研究报导[24-25],然而在森林生态系统中关于胞外酶变化引起的微生物呼吸及控制温度等气候因子后对于微生物呼吸大小的研究鲜见。因此,通过对不同植被带的土壤进行长期室内培养,阐明土壤微生物呼吸在温度上的变化规律及其调控因子,探究不同温度下胞外酶对土壤微生物呼吸的潜在影响,从而揭示在胞外酶驱动下的土壤碳循环特征,为准确预测全球未来气候变化趋势提供理论基础。
太白山作为秦岭的主峰,是我国南北气候分界线,也是长江与黄河两大水系的分水岭。太白山生物多样性丰富、植被固碳功能潜力巨大,是我国森林生态系统的典型代表,为开展森林土壤呼吸的研究提供天然的实验平台[26];同时太白山拥有着完整的植被带梯度,特别是海拔1500—2800 m的土壤均为灰棕壤,这也为研究土壤呼吸的空间异质性提供有利条件[27]。本研究选取太白山北坡的不同海拔梯度的植被带(锐齿栎林Quercusalienavar.acuteserrata、辽东栎林Quercusliaotungensis、红桦林Betulaalbo-sinensis、牛皮桦Betulaalbo-sinensisvar.septen-trionalis)的0—10 cm表层土壤,在不同的温度下(15、25、35)分别进行恒温恒湿培养,本研究目标是(1)阐明土壤微生物呼吸在温度上的变化规律及其调控因子;(2)土壤微生物量、胞外酶在不同温度下随着培养时间的变化趋势;(3)探究在不同温度下胞外酶和微生物量对土壤微生物呼吸的潜在影响。
2 材料与方法
2.1 研究区概况以及土壤取样
研究地位于陕西省秦岭腹地太白山(107°22′—107°51′E,33°49′—34°05′N)。太白山是秦岭的最高峰,最高海拔3771.2 m,属于温带季风气候,植被类型丰富,具有完整的植被垂直带谱,年平均温度13 ℃,北坡年平均降雨量694.2 mm,主要集中在夏季[27]。我们选取4个沿海拔梯度分布完整、林带明显的不同典型垂直植被林带,分别是属于落叶阔叶林带的锐齿栎(1800 m以下)和辽东栎(1800—2200 m)与属于落叶小叶林带的红桦林(2200—2500 m)和牛皮桦林(2500—2700 m),且该样地土壤类型均为以灰棕壤为主[26]。
于2018年7月在太白山北坡选取锐齿栎林、辽东栎林、红桦林、牛皮桦林植被带上地形、地貌、坡度、坡向基本一致的典型样地(表1)。在每个海拔高度设置3个25 m×25 m的地块,每个地块位于其优势乔木种附近。具体取样步骤如下:在每一块地的弃土层被清除后,用内径5 cm的螺旋钻采集10个“S”形相同深度(0—10 cm)的土样,然后将10个复样均匀混合,组成一个土样。在4个海拔高度共采集了12个土壤样本,每个样本通过2 mm 的筛网,以清除植物根系和其他碎片。每次使用螺旋钻后,用无菌纸擦去螺旋钻和筛网上的残留物,以避免样品污染。取完所有样品后,将每个土壤样品分为4个部分:第一部分土壤样品立即送至实验室测定土壤湿度;第二部分存储在带冰袋的便携式培养箱中,然后送至实验室,调节至其原始湿度后,在RXM-280A培养箱中以其原位海拔的温度进行预培养;第三部分储存在4 ℃冰箱中进行微生物生物量分析;剩余部分在室温下风干,以确定土壤的基本理化性质。
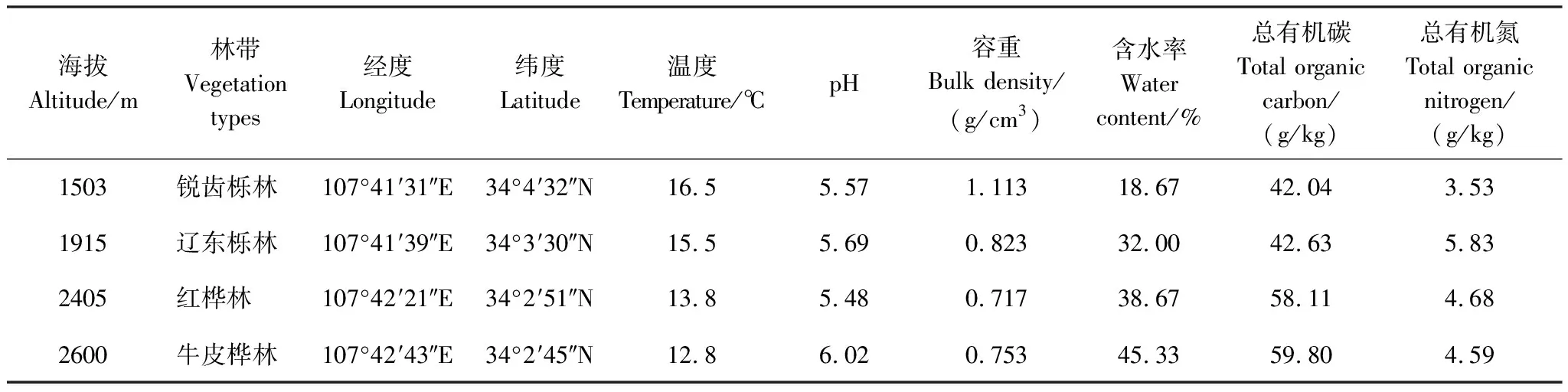
表1 取样地土壤理化性质
2.2 土壤微生物呼吸及其相关环境因子的测定
将土壤在RXM-280A培养箱中以土壤各自的原位海拔的温度(表1)进行预培养7 d,然后将土壤以500 g一份,每个林带称取18份,共72份,置于培养瓶中。将其均分为3组,调节至60%田间持水量,分别置于15、25、35 ℃下的RXM-280A培养箱进行培养,每个林带每组有6份,包括测量瓶与取样瓶(3组重复)。使用Li-8100碳通量测量仪在8点—10点测量土壤呼吸,于1—20 d每天测量一次,于20—47 d每3天测量1次,于47—72 d每5天测量1次。
在1 d、20 d和72 d从取样瓶中取出土壤,测量相关环境因子指标。土壤湿度是通过对在105 ℃下干燥至恒定质量的土壤样品进行称重来测定的;土壤温度通过便携式温度探针测定;土壤pH值是使用Metrohm702自动酸碱滴定仪在1:2.5土壤:水悬浮液以电位法测定;采用环刀法测定土壤容重;使用氯仿熏蒸-K2SO4提取和过硫酸钾消化法估算土壤微生物生物量碳、氮、磷(MBC、MBN、MBP);采用微孔板荧光法测量土壤中β-N-乙酰氨基葡萄糖酶(β-N-Acetyl-glucosaminidase,EC 3.2.1.52,NAG)、β-葡萄糖苷酶(β-glucosidase,EC 3.2.1.21,BG)、β-木糖苷酶(β-D-xyloside xylohydrolase,EC 3.2.1.37,BX)、纤维二糖水解酶(Cellobiohydrolase,EC 3.2.1.91,CBH)、酸性磷酸酶(Acid phosphatase,EC 3.1.3.2,ACP)、亮氨酸氨基肽酶(Leucine arylamidase,LAP)的活性。
2.3 数据分析
微生物量与胞外酶在不同培养时间下的差异性是通过单因素方差分析(One-way ANOVA)所得。在不同温度下的土壤呼吸与微生物量和胞外酶的相关性是采取逐步回归方程进行分析。以上分析均在SPSS中完成。
为了探究微生物呼吸对变暖的响应,我们使用以下方程式计算Q10的值,它表示温度升高10 ℃,微生物呼吸速率的相对变化的比例[28]:
式中,Ch和Cl分别表示在高温(Th)和在低温(Tl)时微生物累积呼吸量。
为了探索不同林带的土壤微生物在不同温度下,随着培养时间的增长,如何调节元素利用效率,我们使用以下方程式计算了TerN和TerP,它将测定的胞外酶活性和微生物量联系起来以阐明土壤当前的养分限制[29-31]:
式中,BG表示β-葡萄糖苷酶的酶活性,LAP表示亮氨酸氨基肽酶的酶活性,NAG表示β-N-乙酰氨基葡萄糖酶的酶活性,ACP表示酸性磷酸酶的酶活性,MBC、MBN、MBP分别表示微生物量碳、微生物量氮、微生物量磷的量。n0表示lnBG对ln(NAG+LAP)的标准主轴回归分析(Standardized major axis,SMA)所得的方程的截距,p0表示lnBG对ln ACP的标准主轴回归分析所得的方程的截距。标准主轴回归分析是在Rstudio中完成。
3 结果讨论
3.1 不同海拔与温度对土壤微生物呼吸的影响
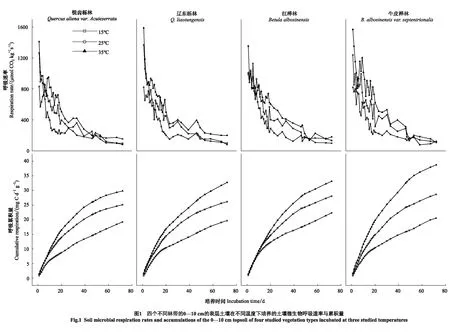
如图1所示,在不同的温度与海拔下,土壤微生物呼吸速率随着培养时间的增加而减少,呼吸累积量随着培养时间的增加而增大。微生物呼吸的初始速率在四个林带上无显著性差异;在不同的温度上出现显著性差异(P<0.05),微生物初始呼吸速率出现35 ℃>25 ℃>15 ℃的现象。在1—20 d期间,微生物呼吸速率处于波动状态,并在波动中快速下降;在20—72 d期间,微生物呼吸速率随着培养时间缓慢下降,然后趋于平稳。在20 d与72 d时的微生物呼吸速率相比于初始值平均下降了68%与90%。锐齿栎林、辽东栎林和红桦林在46 d的时候出现在15 ℃与25 ℃下微生物呼吸速率相等的现象,而牛皮桦林是在49 d时出现;红桦林与牛皮桦林出现25 ℃和35 ℃下的微生物呼吸速率相等的现象的时间是53 d,锐齿栎林在58 d时出现,辽东栎林未出现该现象。从相同的温度看,四个林带的72 d的呼吸累积量都出现35 ℃>25 ℃>15 ℃的现象;从相同的林带看,15 ℃与25 ℃的72 d的呼吸累积量无显著性差异,35 ℃上出现显著性差异(P<0.05),呼吸累积量出现35 ℃>25 ℃>15 ℃的现象。
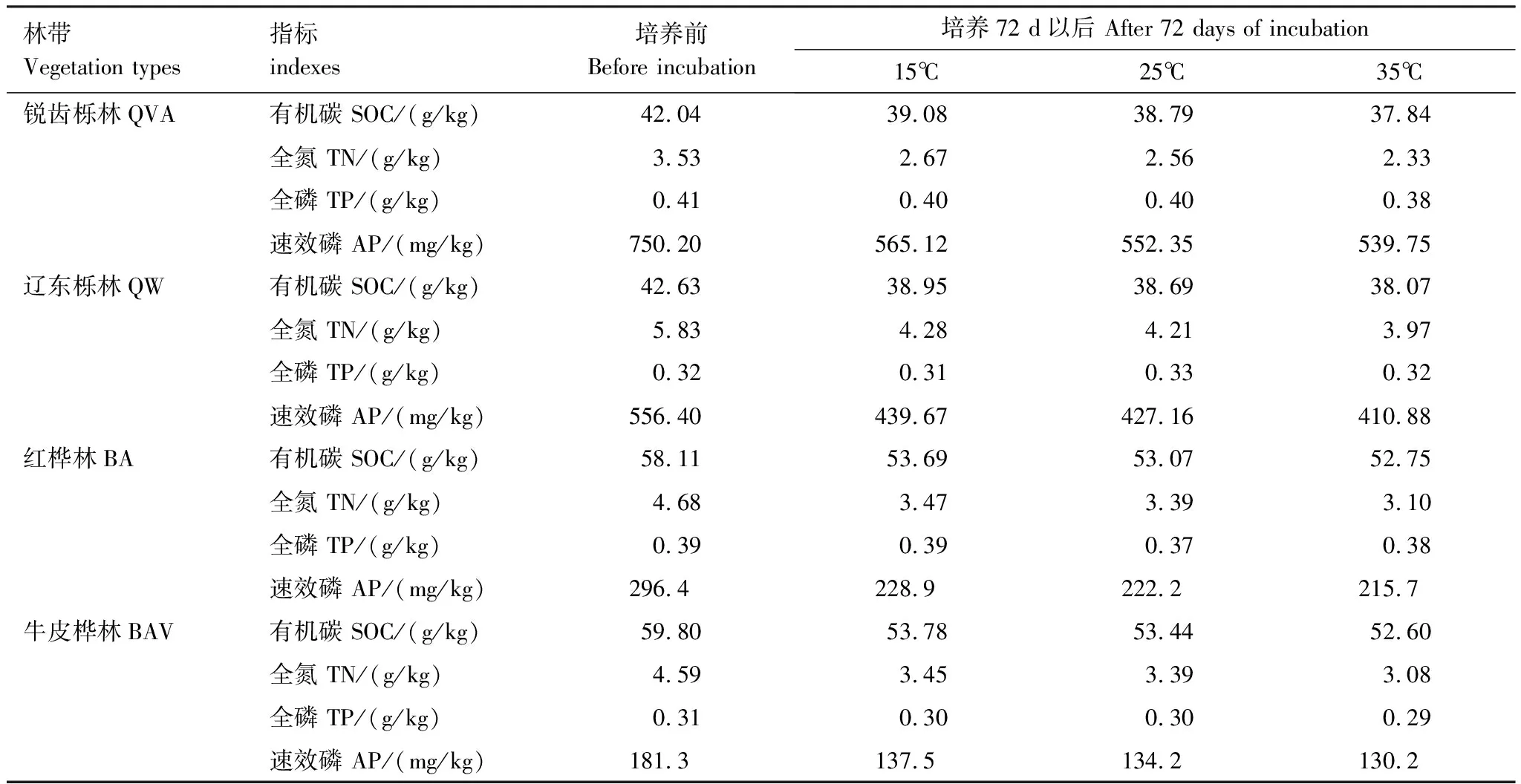
由表2可知,在相同的海拔中,T1Q10(T1表示15 ℃与25 ℃的温差)与T2Q10(T2表示25 ℃与35 ℃的温差)存在显著性差异(P<0.05),出现T2Q10 表2 4个不同林带土壤微生物呼吸温度敏感系数Q10 由表3可知,4个不同林带的土壤经过15、25、35℃条件下72 d的培养,其有机碳相较于初始土壤有机碳含量,平均下降了8.34%、9.09%、10.50%,其中牛皮桦林下降最明显;其全氮相较于初始土壤全氮含量,平均下降了25.41%、27.24%、33.14%;全磷基本没有变化;速效磷与其初始值相比,平均下降了30.35%、33.94%、38.06%。 表3 不同林带土壤基础指标在培养前后的变化 随着培养时间的增加,MBC、MBN和MBP在15 ℃时出现单峰趋势(先增加后下降),而在25 ℃下,除去锐齿栎林与辽东栎林的MBN,其余也均呈现单峰趋势。在35 ℃下,锐齿栎林和辽东栎林的MBC、MBP和牛皮桦的MBP外,其余均表现为下降趋势。 与MBC初始值相比较,20 d的MBC在15 ℃与25 ℃下平均上升101.8%、38.9%,而在35℃下平均下降3.8%;72 d的MBC在三个温度下都处于下降状态,温度由低到高分别下平均下降47.9%、56.9%、54.4%。与MBN初始值相比较,20 d的MBN在15 ℃与25 ℃下平均上升41.3%、15.9%,而在35 ℃下平均下降25.9%;72 d的MBN在15 ℃、25 ℃和35 ℃下,各自平均下降53.3%、49.6%、57.3%。与MBP初始值相比较,20 d的MBP在15 ℃与25 ℃下平均上升117.9%、50.1%,而在35 ℃下平均下降1.6%;72 d的MBP在15 ℃、25 ℃和35 ℃下,各自平均下降58.4%、54.7%、62.2%。(图2) 图2 不同培养阶段中不同林带的土壤微生物量碳氮 在相同培养时间和相同温度下,不同的胞外酶活性也表现出不同的趋势。在20 d时,6种胞外酶在15 ℃下,相比较于其各自的初始值在1.22—6.99倍之间;在25 ℃下,各林带平均增长了1.26—19.3倍;而35 ℃下,其最大增幅达40.49倍,最小增幅有-23.2%;其中,NAG、LAP、ACP增幅比较明显。而72 d的6种胞外酶相比较于其各自的初始值,在15 ℃下分别平均增长了1.55—6.82倍;而在25 ℃与35 ℃时,6种胞外酶的增幅在1.06—6.57倍之间。在整个培养过程中,NAG的增幅最大,CBH的增幅最小(图3)。 图3 不同培养阶段中不同林带的土壤中的胞外酶活性 由表4可知,在15 ℃下,MBP对微生物呼吸速率极显著相关(P<0.01),BG对其显著相关(P<0.05)。在25 ℃下,微生物呼吸速率的最大影响因子是MBP(P<0.01),其次是BG(P<0.05)。在35 ℃下,BG与MBC同时对微生物呼吸有极显著影响(P<0.01),MBP也存在显著相关(P<0.05)。在锐齿栎林和辽东栎林中,BG对微生物呼吸速率极显著相关(P<0.01),其中BX对锐齿栎林的微生物呼吸速率也存在显著相关(P<0.05)。而在红桦林与牛皮桦林中,ACP是对微生物呼吸速率的唯一极显著影响因子(P<0.01)。 表4 微生物量和胞外酶活性对土壤微生物呼吸的逐步回归方程 由表5、表6可知,随着培养时间的延长,TerN在15℃和25℃下存在先增加后下降的趋势,在35℃下呈现持续上升的趋势;TerP在15℃下出现持续上升的趋势,在25℃下出现先上升后下降的趋势,在35℃下出现先下降后上升的趋势。 表5 不同温度下土壤酶活性关系的标准化主轴分析 表6 不同温度下不同林带的不同培养时间时间的TerN和TerP 本研究发现,高温在短期内会促进土壤微生物呼吸,但是在长期培养会减缓土壤微生物呼吸。大量研究发现[32-34],在自然培养过程中,增温在短期内会促进土壤呼吸。但是在长期增温实验中,土壤呼吸出现了不同的趋势,如Melillo对美国Harward森林的土壤实验中出现在增温在前6年促进土壤呼吸,在后4年抑制土壤呼吸的现象[35];而他在美国Corvallis原始森林的实验中发现增温一直在促进土壤呼吸[36]。在本实验中,出现高温培养与低温培养的土壤呼吸速率相等的现象是在50 d左右出现,相比于Melillo的实验时间有极大的提前,可能主要原因是本实验为恒温恒湿且无外源碳的输入情况下进行的,碳被消耗无法得到补充,而上述实验是处于自然界中的增温培养实验,有大量的外源碳输入,次要原因是研究区样地与上述实验的培养地存在极大的空间上的差异。土壤有机碳、全氮、速效磷在培养72 d以后都出现了明显的下降趋势,并且出现了高温培养比低温培养下降幅度更大的现象,这与土壤呼吸速率的趋势相符合,出现该现象可能的原因是高温使得土壤酶处于较高的活性,加速了对土壤中氮磷元素的吸收以供微生物生长繁殖,因此土壤有机碳中被分解以供给其能量[36]。有研究认为[37-38],土壤中的碳有不同的存在形式,不稳定的有机碳与比较稳定的碳化合物在转化的过程中都会在酶的作用下成小分子碳(如葡糖糖多糖等),从而被微生物吸收利用产生CO2。高温使大量活性较高、不稳定的大分子有机碳在培养前期被消耗,所以表现出高温在前期促进土壤呼吸。而随着培养时间的增加,土壤中的易被分解的组分被消耗,难矿化的组分不断累积,反而使高温培养的土壤中活性碳与惰性碳的比值不如低温培养,从而表现出高温会在长期减缓土壤呼吸速率。而对于不同林带而言,土壤呼吸速率无显著性差异(P>0.05)。而根据施政[39]与刘贤德[40]等观点,在自然中温度的变化是土壤呼吸速率在空间上的变化的唯一的显著的主导因子。由于本研究已经控制温度,消除了温度变化的影响,所以上述现象,与施政等研究结果并不矛盾。土壤全磷在经过72 d的培养之后含量几乎不变,可能是由于磷元素只是在土壤中作不同磷组分之间的转化,并没有以气体的形式散失。 较多对温带或亚热带的土壤的研究认为,Q10随着温度的升高而降低[41-42],这与本研究的实验结果相符合;也有研究认为,Q10随着温度的升高而升高,这些研究大部分出自与高纬度地区[43];还有研究认为,Q10与温度的变化无明显影响[44],出现差异的现象可能是与土壤类型、凋落物的输入或者微生物群落的差异有关。在本研究中,T1Q10与T2Q10的平均值分别是2.39和2.17,符合Raich[45]在全球文献综述中报道的中值(2.40),也在Coucheney E[46]和Xu Z[47]等人在现场和实验室测量的Q10值的范围之内。但是本研究中的Q10可能会被高估,因为根据Zhu[48]等人的观点:恒定温度下的Q10值高于日变化温度。而且在长期培养过程中,由于缺乏新鲜的碳输入,土壤微生物群落组成发生了变化。在培养过程中土壤中不稳定碳的耗竭增加了有机碳的惰性,从而导致基于C质温假设的Q10值增加。尽管如此,Q10也不是恒定的[49],有些研究可以表明通过使用周期性变化的温度可以克服恒温的缺点[50-51]。因此,未来在评价土壤微生物呼吸的Q10时,应采用周期性变化的温度进行实验。 本研究发现,土壤微生物呼吸的变化受到微生物量与胞外酶的影响,而微生物与胞外酶在不同的培养时间与不同温度上有明显差异。MBC、MBN与MBP在15℃与25℃培养过程中出现单峰趋势(先增加后降低),增加的原因可能是1—20 d微生物利用土壤中的养分进行生长繁殖,降低的原因可能在20—72 d中土壤中养分在持续不断的消耗,导致微生物大量死亡或休眠。Anderson[52]认为呼吸反映了整个微生物群落的活性,包括休眠和未休眠状态的微生物群体。土壤中微生物大部分处于休眠状态,只有一小部分对呼吸有贡献。而我们的结果表明在35℃中,MBC、MBN与MBP在培养过程中出现下降趋势,可能是由于土壤微生物不能适应高温的环境,大量的微生物在培养开始的前20 d就已经逐渐死亡或进入了休眠状态。 有研究认为[38],土壤中的碳可以分为3个部分,最活跃的碳的代表成分是不稳定或可溶解的碳化合物(糖或氨基酸);比较稳定的碳的代表成分是非木质化的纤维素和半纤维素;稳定的碳的代表成分是木质素。一般木质素需要成百上千年才能被完全分解[53],所以本实验未将木质素视为可以被微生物分解利用的碳源,而不稳定或可溶性碳化合物基本不需要酶就可以直接被为微生物利用,所以酶主要影响的是以纤维素和半纤维素为代表的不能直接被微生物利用但是可以在酶作用下被分解为可被微生物利用的碳源。 通过表4可以看出,BG是影响土壤呼吸最显著的胞外酶。而ACP在红桦林与牛皮桦林中对微生物呼吸极显著相关,可能的原因是红桦林和牛皮桦林的土壤速效磷过少。BG和CBH参与了对土壤中纤维素的降解,CBH主要用于将纤维素水解成纤维二糖,BG作用于已经被CBH分解后的有机物(如纤维二糖),将其水解成微生物可用碳源(如葡萄糖多糖)[54]。在15℃与25℃下,BG的活性随着培养时间的增加而增加,而MBC呈现单峰趋势;在35℃时,BG出现单峰趋势,与MBC的持续下降的趋势并不符合。换言之,在微生物量碳减少的情况下,BG的活性仍然在增加,说明了在72 d时,由BG分解纤维素所得的碳已经成为不满足微生物生长繁殖所需。木聚糖(半纤维素的构成)是一种较难分解的碳源,主要由BX参与进行分解[54]。在本研究中,BX在15℃下出现持续上升趋势,说明了在15℃下由BX分解半纤维素所得的碳已经成为不满足微生物生长繁殖所需;而在25℃和35℃下,在72 d与20 d相比较,BX没有明显的变化,说明了在25℃和35℃中,72 d时由BX分解半纤维素所得的碳已经成为微生物重要的碳源之一。 Sinsabaugh等人曾提出Metabolic Theory of Ecology理论,微生物可以通过释放过量元素和调节其生理能力(如元素利用效率)来保留限制元素,从而更好的将其生物量与环境资源想匹配[55-56]。微生物代谢从净养分固定(养分限制)到净养分矿化(能量限制)的转换可以用阈值元素比(Ter)来描述,Ter值偏高代表着更高的能量利用效率,Ter值偏低代表着更高的养分利用效率[20]。NAG与LAP参与了土壤的N循环,NAG在甲壳质和其他b-1,4-连接的葡萄糖胺聚合物的降解中起着重要作用,类似于BG在纤维素降解中的作用,而LAP作用于多肽N末端的亮氨酸和其他疏水氨基酸[57-58]。TerN在15℃和25℃下存在变化非常明显的先增加后下降的趋势,表明了在15℃和25℃的培养过程中,氮的利用效率先下降后上升。即在培养前期,N是限制土壤微生物生长的因素,而在后期微生物可以用的N比C更为富余。而在35℃下,TerN一直在上升且变化范围较大,说明N的利用效率在一直下降,即可认为土壤一直处于N限制中。而且TerN(20 d)/TerN(1 d)远大于TerN(72 d)/TerN(20 d),说明了土壤中大部分易吸收、易分解的N在1—20 d里已经被利用,出现该现象可能的原因是NAG作为N分解的终端酶之一,在35℃下已具备很高的活性[59]。ACP参与了土壤的P循环,主要参与了磷酸多糖与磷酸酯的水解,为微生物提供可利用的磷源[60]。TerP虽然在15℃下出现持续上升的趋势,但是变化范围较小,3个时间段的TerP比较接近,TerP(20 d)/TerP(1 d)稍小于TerP(72 d)/TerP(20 d),说明了土壤中的P是在逐渐的、平缓的被ACP所分解,因此可以认为不存在P限制;TerP在25℃下出现先上升后下降的趋势,且变化范围较大,即可以认为在培养前期,P是限制土壤微生物生长的因素,而在后期P相较于C有较多富余,出现该现象可能的原因是25℃下微生物量更大,需要吸收更多的P来维持其生长繁殖;TerP在35℃下出现先下降后上升的趋势,而且TerP(72 d)与TerP(1 d)相差不大,表明P一直不是限制微生物生长的因素,且20 d时有明显的富余,出现该现象可能的原因是ACP在35℃下已具备很高的活性[61],可以为微生物生长繁殖提供足够的P。在本研究中,由于室内培养和野外系统之间的环境存在较大差异,可能会出现测量出的微生物量偏高和酶活性偏低[30],在一定程度上降低了关于不同温度下影响土壤呼吸的因素讨论的效力。其原因可能是由于室内培养保持了合适且恒定的温度与湿度,使得土壤微生物迅速生长繁殖,加快了土壤有机碳的消耗。并且由于目标土壤不存在与外界的能量、养分的交流,因此在随着培养时间的延长,室内培养相较于野外培养存在着土壤微生物种群的变化更迭更加频繁的问题[62]。 (1)在无碳源输入的恒温恒湿培养中,高温在短期内会促进土壤微生物呼吸,而在长期会减缓土壤微生物呼吸。对于太白山(温带森林)的土壤而言,Q10随着温度的升高而降低。 (2)在培养过程中,土壤有机碳和全氮一直减少,15 ℃和25 ℃下微生物量先增多后减少,35 ℃下微生物量一直减少,BG是影响土壤呼吸最显著的胞外酶。 (3)培养72 d以后,由BG所分解的碳已不能满足微生物生长繁殖所需;在25℃和35℃下,由BX所分解的碳已成为生物生长繁殖重要碳源之一。 (4)在15℃和25℃下,N是培养前期限制土壤呼吸的因素,C是后期限制因素;在35℃下,N一直是限制土壤呼吸的因素。 (5)在15℃和35℃下,土壤呼吸不存在P限制;在25℃的培养前期,P是限制土壤呼吸的因子,而在培养后期不存在P限制。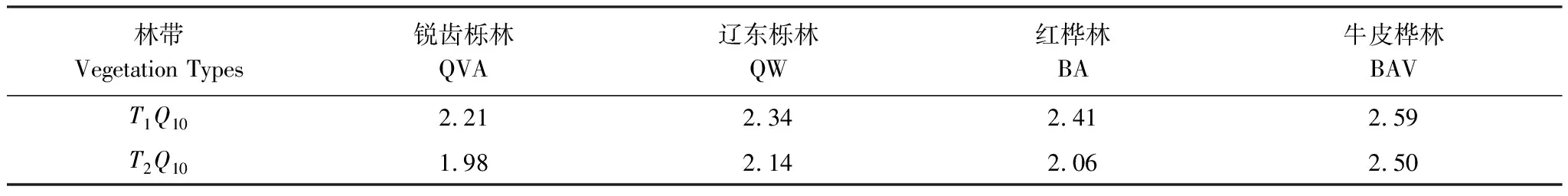
3.2 土壤理化性质与胞外酶在不同培养时间的差异

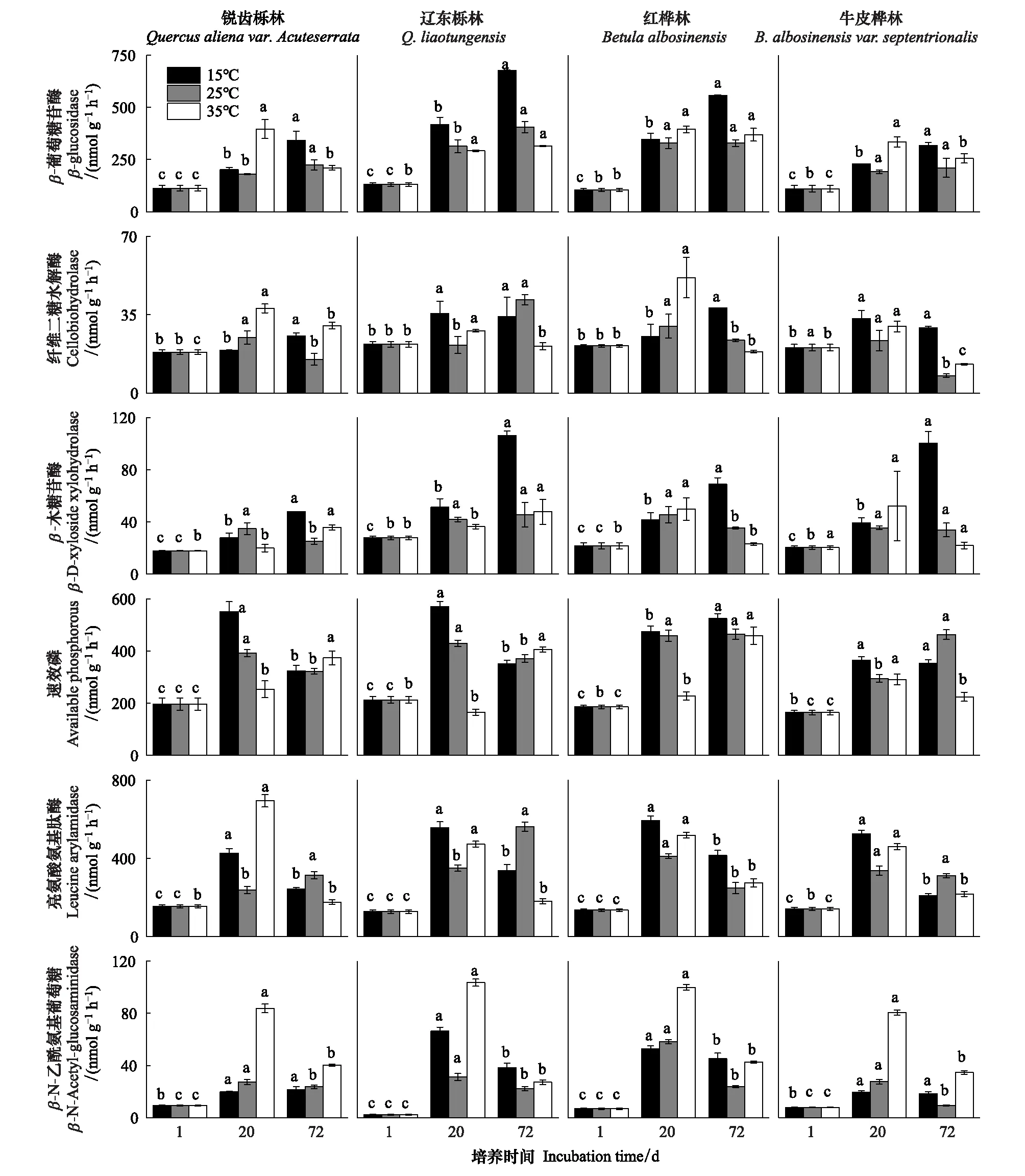
3.3 微生物量与胞外酶对微生物呼吸的影响
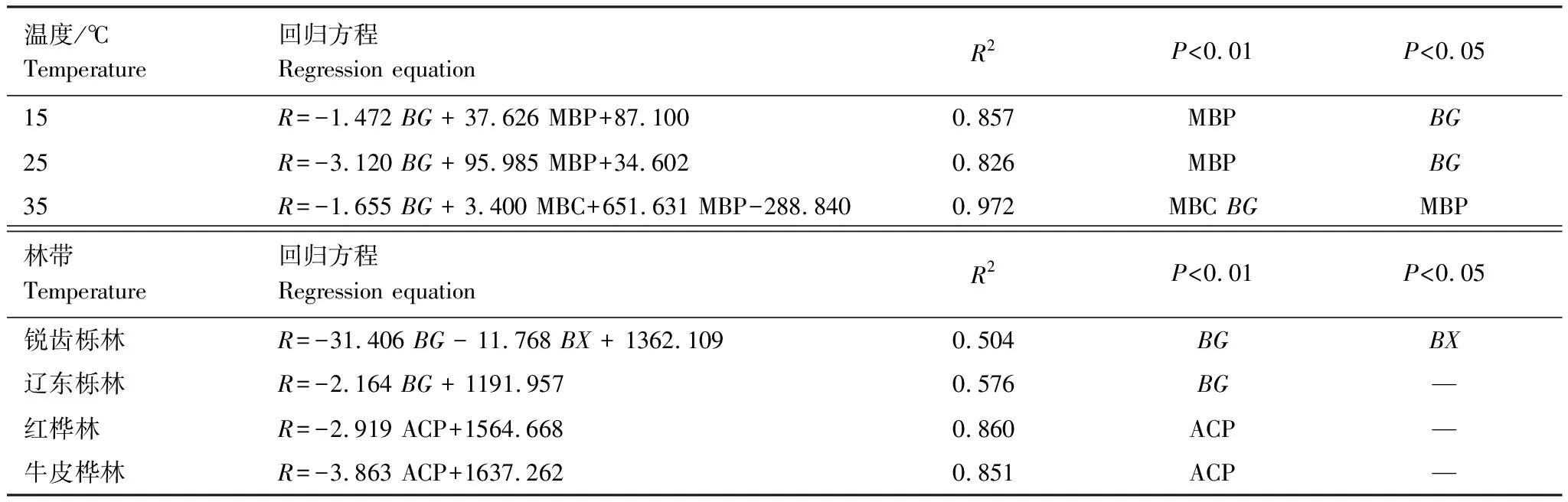

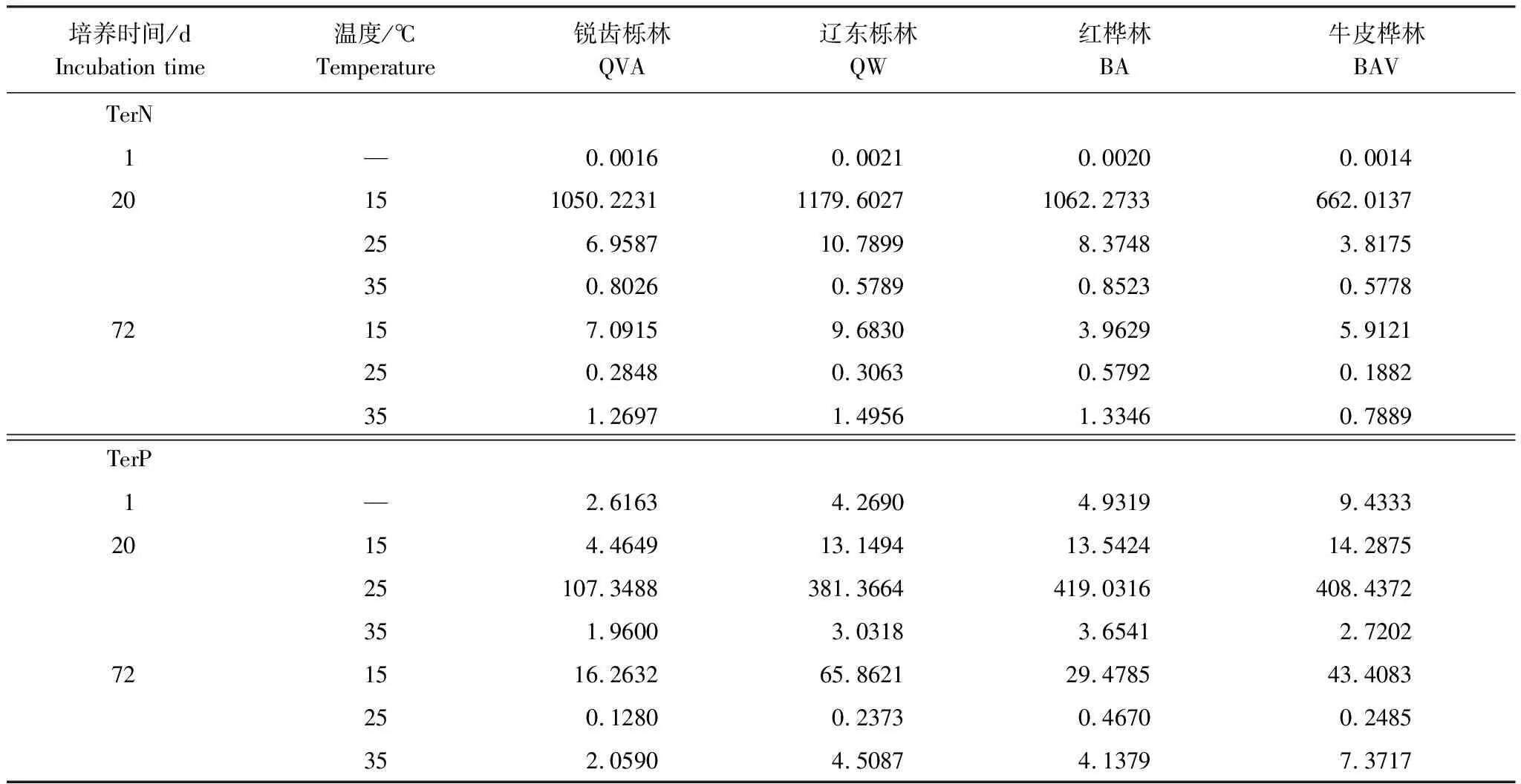
4 讨论
4.1 土壤呼吸、土壤理化性质与Q10在不同林带与温度上的差异性
4.2 微生物量与胞外酶对土壤呼吸的影响
5 结论

