草果提取物对大肠杆菌和沙门氏菌抑菌机理研究
唐志凌,赵明明,陈靖潼,高璐瑶,陈文学,李远颂
(1.海南大学 食品科学与工程学院,海口 570228;2.海南大学 研究生处,海口 570228)
草果(Amomumtsao-ko)为姜科豆蔻属多年生草本植物,主产于我国的云南、广西、贵州等地[1]。草果具有特殊辛香味,并能去除腥味,现今多将草果用于烹调肉类食品,是日常生活中必备的调味香料,被人们誉为食品调味中的“五香之一”[2]。研究表明,在草果中检测出痕量硒,适当补硒有益人体健康,因此经常食用草果对人体有一定的营养保健功效[3]。同时草果也是我国一种传统的中药材,可改善疟疾、咳嗽、积食等症状[4]。草果挥发油有较好的抗氧化性,对于清除羟自由基和超氧阴离子自由基有着十分显著的效果[5-6]。此外,草果提取物还具有抑菌效果,Cui Qi等[7]研究表明草果提取物具有较强的广谱抗菌活性;谢小梅等[8]通过对草果挥发油的深入研究发现其对产黄青霉、黑曲霉等真菌具有良好的杀菌效果。
由于微生物活动和氧化等作用,肉制品很容易腐败变质。目前,为了防止肉制品的腐败变质,保持其新鲜度,常常在其中添加化学防腐剂,但长时间研究表明,有些化学防腐剂具有诱癌性、致畸性、低毒性以及某些潜在的危害[9]。天然防腐剂因安全、高效等优点在食品行业受到广泛关注。从植物中提取有效成分抑菌防腐已成为研究的热点,而香辛料是其主要来源之一。食源大肠杆菌(Escherichiacoli)与沙门氏菌(Salmonellatyphimurium)是食品安全领域中最常见的致病菌[10],草果多用于肉制品的调味。本研究在对草果抑菌物质提取工艺进行优化并初步探讨其抑菌活性的基础上[11],进一步探索草果提取物对大肠杆菌和沙门氏菌的抑菌机理,为草果提取物应用于肉制品的防腐保鲜提供了理论支持。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonellatyphimurium):海南大学食品科学与工程学院提供;牛肉膏、蛋白胨、琼脂、无菌磷酸盐缓冲液(PBS):北京索莱宝科技有限公司;氯化钠、氢氧化钠、无水乙醇、丙酮:广州化学试剂厂。
1.2 仪器与设备
AR124N型电子天平;SPX-288智能型生化培养箱;XB-HP型中药粉碎机;SHA-2型水浴全温振荡器;GGT7型旋转蒸发仪;GI54DS型高压灭菌锅;SW-CJ-1FD 型无菌超净工作台;Christ Alphal型细胞冷冻干燥机;S-3000型扫描式电子显微镜;TU1810 型紫外可见分光光度计;CR22N型落地式高速冷冻离心机。
1.3 实验方法
1.3.1 草果抑菌活性物质的提取
草果的产地和提取方法使得提取物的成分组成产生差异[12]。本实验参考彭美芳等[13]的提取方法,将草果粉浸泡、超声后得到草果粗提物,然后采用乙酸乙酯萃取法,得到抑菌效果最佳的草果乙酸乙酯萃取物。
1.3.2 菌种活化
将大肠杆菌、沙门氏菌在培养基中传代活化后,培养18~24 h,采用麦氏比浊法调整菌液浓度为106~107CFU/mL待用[14]。
1.3.3 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定
采用肉汤稀释法测定最小抑菌浓度。抑制液的配制采用二倍梯度稀释法[15],制成终浓度分别为20,10,5,2.5,1.25,0.625,0.3125 mg/mL的含药培养基。将供试菌接种至含药培养基上,同时设置空白组。倒置培养24 h后,观察。以完全不长菌的最小稀释浓度确定为草果萃取物对大肠杆菌、沙门氏菌作用的MIC。参考潘旭迟等[16]的方法,继续培养24 h后,以完全不长菌的最小稀释浓度确定为草果萃取物对大肠杆菌、沙门氏菌作用的MBC。
1.3.4 生长曲线的测定
采用紫外分光光度法测定大肠杆菌和沙门氏菌的生长曲线[17]。将供试菌接种至液体培养基中,加入抑菌物质,调至各自最小抑菌浓度,同时设置空白组和阴性对照组。恒温培养24 h,每2 h取样,测定样品在600 nm下的OD值。以时间和OD值为横、纵坐标绘制对应的生长曲线。
1.3.5 细胞形态的观察
采用扫描电镜法观察两种细胞微观形态的变化。在培养至各自对数期的菌悬液中加入终浓度为1×MIC的草果提取物, 并设置空白组和阴性对照组。放置于最适温度,在180 r/min摇床中培养, 分别取培养至4,8 h的菌悬液, 低温离心10 min后,各自收集菌体。再依次使用无菌磷酸盐缓冲液(PBS, pH 7.2)和乙醇溶液梯度洗脱3次。最后通过细胞冻干机低温冻干后取样镀金, 在电子显微镜上放大8000倍观察细胞微观形态。
1.3.6 碱性磷酸酶(AKP)的测定
将供试菌分别接种至液体培养基中,加入草果提取物,调至各自最小抑菌浓度,同时设置空白组和阴性对照组。在水浴振荡器培养8 h,每隔2 h取样,按照AKP试剂盒的要求测定不同样品在520 nm波长下的OD值,并计算出对应的AKP活力。
2 结果与分析
2.1 草果提取物对大肠杆菌和沙门氏菌的MIC和MBC
由表1可知,草果提取物对大肠杆菌和沙门氏菌均有较好的抑菌效果,且抑菌效果随草果提取物浓度的上升而增强。当草果提取物浓度为0.625 mg/mL时,大肠杆菌难以生长;当草果提取物浓度为1.25 mg/mL时,沙门氏菌无法生长,表明草果提取物对大肠杆菌和沙门氏菌的最小抑菌浓度分别为0.625,1.25 mg/mL,且丙酮对大肠杆菌和沙门氏菌的生长在此次实验条件下影响较小。另外,草果提取物对大肠杆菌和沙门氏菌的最小杀菌浓度分别为0.625,1.25 mg/mL,与其各自最小抑菌浓度相同。说明草果提取物对细菌的抑制作用较为明显,且这种抑制作用在短时间内可以保持稳定。

表1 大肠杆菌和沙门氏菌的生长情况Table 1 The growth situations of Escherichia coli and Salmonella typhimurium
2.2 草果提取物对大肠杆菌和沙门氏菌生长的影响
草果提取物分别作用大肠杆菌和沙门氏菌24 h,研究其对细菌生长的影响,结果见图1和图2。

图1 草果提取物对大肠杆菌生长的影响Fig.1 Effects of Amomum tsao-ko extracts on the growth of Escherichia coli
由图1可知,添加水和丙酮组的细菌生长呈现出明显的S形曲线,并OD值分别在14 h和24 h时达到1.287和1.118。丙酮组细菌生长较慢于空白组,但对于细菌最终生长结果并无显著影响,因此可说明在本实验中丙酮对于大肠杆菌的影响较小。添加终浓度为1×MIC草果提取物的实验组,在4~16 h内生长较为缓慢,OD值无明显上升;在16~24 h期间OD值略有上浮,但幅度较小,随后趋向平稳状态,最终OD值仅达到0.408,并显著低于对照组。实验结果表明,加入终浓度为1×MIC的草果提取物能够有效抑制大肠杆菌的生长。
由图2可知,添加水和丙酮组的沙门氏菌生长状态同大肠杆菌相似,说明在本实验中丙酮对沙门氏菌的影响较小。相比于大肠杆菌,沙门氏菌添加终浓度为1×MIC草果提取物的实验组在数值上较高,在6~18 h内生长较为缓慢;在18~24 h期间OD值略有上升,达到0.686。实验结果说明,终浓度为1×MIC的草果提取物同样对沙门氏菌的生长有着良好的抑制效果,但对大肠杆菌的抑菌效果更好。

图2 草果提取物对沙门氏菌生长的影响Fig.2 Effects of Amomum tsao-ko extracts on the growth of Salmonella typhimurium
2.3 草果提取物对大肠杆菌和沙门氏菌细胞形态的影响
水、丙酮和草果提取物分别作用大肠杆菌、沙门氏菌4 h和8 h后,观察电子显微镜下细胞形态的变化,扫描电镜图见图3(大肠杆菌)和图4(沙门氏菌)。



图3 大肠杆菌的扫描电镜图(8000×)Fig.3 The scanning electron microscopy of Escherichia coli注:A1为空白组(4 h);A2为空白组(8 h);B1为丙酮组(4 h);B2为丙酮组(8 h);C1为实验组(4 h);C2为实验组(8 h)。



图4 沙门氏菌的扫描电镜图(8000×)Fig.4 The scanning electron microscopy of Salmonella typhimurium注:D1为空白组(4 h);D2为空白组(8 h);E1为丙酮组(4 h);E2为丙酮组(8 h);F1为实验组(4 h);F2为实验组(8 h)。
由图3和图4可知,扫描电镜下,空白组(A1、A2;D1、D2)的大肠杆菌和沙门氏菌细胞形态完整,菌体饱满,表面较为光滑,细胞无明显破损且无内容物外泄现象。丙酮组(B1、B2;E1、E2)的大肠杆菌和沙门氏菌培养4 h后,细菌形态完整,细胞边界较为清晰;培养8 h后,大肠杆菌出现局部黏连,但多数细胞仍能保持完整形态,无明显破损,表面光滑;而沙门氏菌经丙酮组处理8 h与处理4 h无显著差异,细菌形态并未产生异常变化。实验组(C1、C2)的大肠杆菌在草果提取物处理4 h后,细菌形态与空白组和丙酮组无显著差异;而在处理8 h后,细菌细胞出现大面积黏连和破损,菌体收缩,表面粗糙,细胞边界模糊,部分细胞呈现严重破裂,造成细胞内容物外泄,而较为黏稠的细胞内容物使得细胞的黏连和重叠现象严重。实验组(F1、F2)的沙门氏菌在经草果提取物处理4 h后,细胞形态变化不明显,绝大多数细胞仍呈现出完整且光滑的细菌表面;在处理8 h后,沙门氏菌与大肠杆菌表现相似,也出现菌体黏连和断裂现象,细菌菌体呈现不同程度的扭曲,表面粗糙,细胞边界不明显。部分细菌破裂成块状,外泄的细胞内容物导致其与其他破裂的细菌黏合在一起,呈现大面积的细菌体堆叠。由大肠杆菌和沙门氏菌所得结果可知,1×MIC的草果提取物在处理大肠杆菌和沙门氏菌8 h后,能够显著破坏这两种细菌细胞的正常形态,导致细胞受到破坏且使得细胞内容物外泄。
2.4 草果提取物对大肠杆菌和沙门氏菌AKP活力的影响
水、丙酮和草果提取物连续作用大肠杆菌8 h,检测胞外AKP含量,结果见图5。

图5 大肠杆菌的胞外AKP含量Fig.5 The extracellular AKP content of Escherichia coli
AKP酶存在于细胞壁与细胞膜之间,正常情况下,当细菌的细胞壁完整未受到损伤时,AKP酶不会泄露到环境中去。因此,检测细菌生长环境的AKP酶含量可以间接表明细胞壁是否受到损伤[18]。由图5可知,空白组和丙酮组的胞外AKP酶含量随着时间的推移增长缓慢。而添加了1×MIC草果提取物的大肠杆菌实验组,其胞外AKP酶的含量随时间的增长呈明显上升趋势,且在各时间点远大于对照组的AKP含量。在6~8 h时,胞外AKP含量迅速增加,说明此时细胞壁已经受到了损伤,细胞壁的完整度被破坏。结合大肠杆菌扫描电镜图分析,草果提取物对大肠杆菌细胞壁通透性的改变主要从6~8 h开始。可能是大分子物质穿过细胞壁,使得细胞壁形成孔洞,最终演变成塌陷,细菌细胞逐渐萎缩[19]。
水、丙酮和草果提取物连续作用沙门氏菌8 h,检测胞外AKP含量,结果见图6。
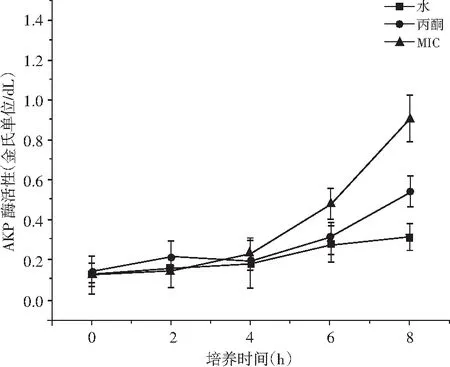
图6 沙门氏菌的胞外AKP含量Fig.6 The extracellular AKP content of Salmonella typhimurium
由图6同样可以明显观察到添加了草果提取物的实验组在6~8 h内上升幅度最大。但与大肠杆菌整体呈现上升趋势不同的是,沙门氏菌在实验的前4 h内,无论是实验组、空白组还是丙酮组,3组的胞外AKP酶含量基本保持不变。而从4 h开始,添加了草果提取物的实验组,其胞外AKP酶含量开始显著升高。说明终浓度为1×MIC的草果提取物对沙门氏菌细胞壁的破坏作用主要发生在4 h之后,且效果显著。
3 结论与讨论
本实验从细胞层面上进行研究,初步探究了草果提取物对大肠杆菌和沙门氏菌两种常见致病菌的抑菌机理。结果表明,草果提取物对大肠杆菌和沙门氏菌有较好的抑制作用,其最小抑菌浓度分别为0.625,1.25 mg/mL,且最小杀菌浓度也均为0.625,1.25 mg/mL。草果提取物能够使大肠杆菌和沙门氏菌的细胞形态遭到破坏,细胞壁的通透性增加,从而抑制细菌的生长繁殖。
草果提取物既可加强肉制品的风味,又有显著的抑菌效果,在未来开发天然防腐剂等方面具有巨大的潜力。本实验已初步探索了草果提取物对大肠杆菌和沙门氏菌这两种食品中常见致病菌的抑菌机理,表明草果提取物在食品加工防腐等方面应用价值较大。当前,对草果提取物抑菌机制的研究尚不充分,未来期望进一步探明草果提取物对不同致病菌的抑菌活性和抑菌机理,并扩大草果提取物在食品贮藏和加工领域的使用范围。

