外周血不同预处理方法及储存时长对RNA 质量的影响
张佳怡,徐倩南,刘希玲,李成涛,2
1.司法鉴定科学研究院 上海市法医学重点实验室 司法部司法鉴定重点实验室 上海市司法鉴定专业技术服务平台,上海 200063;2.内蒙古医科大学法医学教研室,内蒙古 呼和浩特 010030;3.南方医科大学法医学院,广东 广州 510515;4.四川大学华西基础医学与法医学院,四川 成都610041
近年来,通过研究信使RNA(messenger RNA,mRNA)、微RNA(microRNA,miRNA)和环状RNA(circular RNA,circRNA)等具有组织特异性和不同发育阶段表达特异性的生物学遗传标记,发现了RNA 在法医物证学中独特的应用价值,如基于高通量测序技术和微阵列技术筛选具有特异性表达的基因,并结合实时荧光定量逆转录聚合酶链反应,分析体液斑的生物成分,进一步鉴定体液的组织来源[1];也可应用于年龄推断[2]、死亡时间推断[3]和损伤形成时间推断[4]等方面。然而,RNA 相关实验研究的结果与样本RNA 的质量密切相关。
外周血是法医物证学日常检案及研究中较为常见的生物学检材。尽管高质量的RNA 可通过立即从新鲜外周血中抽提得到,但在实际检案中,外周血样本多不具备立即抽提的条件。因此,如何保存外周血样本从而获得高质量的RNA 至关重要。目前常用的RNA 抽提前血样保存的方法主要有低温冻存、PAXgene 全血RNA 管保存、样本中添加RNA 保存液等[5]。低温冻存是目前较为普遍的一种血样处理方法,使用乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)抗凝管采集并储存外周血,过程简便、无须额外处理且可避免外源性因素的影响,但外周血中RNA 容易受内源性因素[如大量存在的核糖核酸酶(ribonuclease,RNase)[6]]的影响,在收集和储存过程中RNA 易发生降解。有研究[7]证实,使用PAXgene全血RNA 管保存能够显著提高从血样中分离出的RNA 质量,但PAXgene 全血RNA 管过于昂贵,样本的收集成本过高。在血样中添加RNA 保存液的方法可在采样地点即进行简单处理,既减少了外源性因素的影响,使外周血中的RNA 得到保护,也降低了RNase对外周血中RNA 的影响。
目前,有关RNA 质量影响因素的研究主要包括提取方法[8-9]、储存温度[10]、冻融次数[11]等方面。KIM等[8]对冷冻血液使用TRIzol法、PAXgene全血RNA 管法和NucleoSpin 法抽提RNA 并对其质量进行比较,结果显示,使用TRIzol 法抽提得到的RNA 纯度和完整性不能完全满足RNA 测序等实验要求,而试剂盒抽提的RNA 质量均能达到要求。何松哲等[10]对外周血样本的保存方式及反复冻融对总RNA 的影响进行了研究,将样本置于37 ℃、25 ℃、4 ℃、-20 ℃及-80 ℃条件下,储存时长设置为1、3、5 和7 d,冻融1~3 次,分别提取总RNA,结果表明,储存温度、储存时长和冻融次数对总RNA 浓度及纯度均有明显影响。但目前有关样本预处理方法和储存时长的研究较少。因此,本研究选取8 种不同的外周血预处理方法和6 个储存时长,采用试剂盒法从外周血中提取总RNA,分析不同预处理方法和样本储存时长对RNA 质量的影响,筛选出能够获得足量高质量RNA 的预处理方法和最佳储存时长。
1 材料与方法
1.1 主要仪器和试剂
Centrifuge 5430 小型高速离心机(德国Eppendorf公司),MX-F 固定式混匀仪(美国Scilogex 公司),QubitTM2.0 荧光计(美国Thermo Fisher Scientific 公司),Epoch 微孔板分光光度计(美国BioTek 公司),2100 生物分析仪(美国Agilent 公司)。EDTA 抗凝管(河北鑫乐医疗器械科技股份有限公司),PAXgene全血RNA 管(美国BD 公司),无核酸酶离心管和枪头(美国Axygen 公司)。
Quick-RNATMMiniprep Plus 试剂盒和DNA/RNA ShieldTM样本保存液(美国Zymo Research 公司),RNA 6000 Nano 试剂盒(美国Agilent 公司),QubitTMRNA HS Assay 试剂盒、TRIzolTM试剂、RNAlaterTM稳定保存液(美国Thermo Fisher Scientific 公司),异丙醇、无水乙醇(国药集团化学试剂有限公司)。
1.2 样本采集
选择3 名健康无关个体,年龄为24~26 岁。每个个体使用静脉采血针与5 mL EDTA 抗凝管抽取外周血共25 mL,使用静脉采血针与10 mL PAXgene 全血RNA 管抽取外周血2.5 mL,所有采血管均颠倒10 次充分混匀。
本研究已获得司法鉴定科学研究院伦理委员会批准(批准号为2019-08-01)。样本采集均遵循知情同意原则并签署知情同意书。
PAXgene RNA 采血管室温下放置6 h,-20 ℃冰箱中放置24 h 后转入-80 ℃冰箱中保存,使用时取出室温下静置,直至完全融化后颠倒混匀。
将EDTA 抗凝管内的外周血取1 mL 于1.5 mL 无核酸酶离心管中,用不同的预处理方法进行处理,每份样本每种方法重复实验3 次,室温平衡20 min 后置于-80 ℃冰箱中保存。
以上操作均为无菌操作,所用物品均进行无RNase 处理。
1.3 样本预处理
1.3.1 外周血加DNA/RNA ShieldTM法
每份样本取0.8 mL 均分装在2 个1.5 mL 无核酸酶离心管中(每管0.4 mL 外周血),按外周血与DNA/RNA ShieldTM(1×)保存液1∶1.5 的体积比,每管加入0.6 mL DNA/RNA ShieldTM(1×)保存液,轻轻振荡混匀后短暂离心,室温孵育20 min 后放入-80 ℃冰箱保存1 d。
1.3.2 外周血加TRIzolTM法
每份样本取1 mL 均分装在4 个1.5 mL 无核酸酶离心管中(每管250 μL 外周血),按外周血与TRIzolTM试剂1∶3 的体积比,每管加入750 μL TRIzolTM试剂,轻轻振荡混匀后短暂离心,室温孵育20 min 后放入-80 ℃冰箱保存1 d。
1.3.3 外周血加RNAlaterTM法
每份样本取1 mL 分装在4 个1.5 mL 无核酸酶离心管中(每管250 μL 外周血),按外周血与RNAlaterTM保存液1∶3 的体积比,每管加入750 μL RNAlaterTM保存液,轻轻振荡混匀后短暂离心,室温孵育20 min 后放入-80 ℃冰箱保存1 d。
1.3.4 血细胞加DNA/RNA ShieldTM法
每份样本取0.8 mL 置于1.5 mL 无核酸酶离心管中,4 000×g离心10 min,弃去上清液。按沉淀(血细胞)与DNA/RNA ShieldTM(1×)保存液1∶1.5 的体积比加入DNA/RNA ShieldTM(1×)保存液,轻轻振荡混匀后短暂离心,室温孵育20 min 后放入-80 ℃冰箱保存1 d。
1.3.5 白细胞加TRIzolTM法
每份样本取1 mL 置于1.5 mL 无核酸酶离心管中,新鲜抗凝血以4 000×g离心10 min,弃去上清液,并将沉淀全部转移到1.5 mL 无核酸酶离心管中,按沉淀与红细胞裂解液1∶3 的体积比将两者混匀,冰上静置10 min。4 000×g离心5 min,弃去上清液,按沉淀与红细胞裂解液1∶2 的体积比将两者混匀,冰上静置5 min,4 000×g离心5 min,弃去上清液。加入1mL TRIzolTM试剂,混匀后移液到1.5 mL 无核酸酶离心管中,室温孵育20 min 后放入-80 ℃冰箱保存1 d。
1.3.6 白细胞加RNAlaterTM法
每份样本取1 mL 置于1.5 mL 无核酸酶离心管中,新鲜抗凝血以4 000×g离心10 min,弃去上清液,并将沉淀全部转移到1.5 mL 无核酸酶离心管中,按沉淀与红细胞裂解液1∶3 的体积比将两者混匀,冰上静置10 min。4 000×g离心5 min,弃去上清液,按沉淀与红细胞裂解液1∶2的体积比将两者混匀,冰上静置5 min,4 000×g离心5 min,弃去上清液。加入1 mL RNAlaterTM保存液,混匀后移液到1.5 mL 无核酸酶离心管中,室温孵育20 min 后放入-80 ℃冰箱保存1 d。
1.3.7 直接冻存法
每份样本取0.8 mL 置于1.5 mL 无核酸酶离心管中,轻轻振荡混匀后短暂离心,室温孵育20 min 后放入-80 ℃冰箱保存1 d。此方法的样本未经任何处理,作为空白对照组。
1.3.8 PAXgene 全血RNA 管法
采集完外周血后,将PAXgene 全血RNA 管在室温下放置6 h,-20 ℃冰箱中放置24 h 后转入-80 ℃冰箱中保存。
1.3.1~1.3.7 节的预处理法采用EDTA 抗凝管收集血液,1.3.8 节预处理法采用PAXgene 全血RNA 管收集血液。
1.4 样本储存
选取外周血加DNA/RNA ShieldTM对3 名健康志愿者的外周血进行预处理。外周血起始量均为1 mL,经预处理后在-80 ℃条件下分别保存0、5、10、15、30和60 d。
1.5 总RNA 提取
先将样本从-80 ℃冰箱中取出,室温下融化。按照Quick-RNATMMiniprep Plus 试剂盒操作说明书对经过不同方法预处理的样本进行总RNA 抽提,得到洗脱体积为50 μL 的RNA 提取物。具体步骤如下。
1.5.1 外周血加DNA/RNA ShieldTM法
①每1 mL 样本混合液中加入20 μL PK 充分混匀,室温孵育30 min;
②孵育后加入等体积的异丙醇混匀;
③混匀后的液体依次加入过滤柱,10 000×g离心1 min,弃掉滤液;
④过滤柱中加入0.4 mL RNA漂洗缓冲液,10 000×g离心1 min,弃掉滤液;
⑤按照每份样本5 μL DNaseⅠ和75 μL DNA 裂解液的比例加入无核酸酶离心管混匀,向过滤柱加入80 μL DNaseⅠ混合液,室温孵育15 min;
⑥加入0.4 mL RNA 预洗缓冲液,10 000×g离心1 min,弃掉滤液;
⑦加入0.7 mL RNA 漂洗缓冲液,10 000×g离心1 min,弃掉滤液;
⑧加入0.4 mL RNA 漂洗缓冲液,10 000×g离心2 min,弃掉滤液;
⑨加入50 μL 无核酸酶水,将RNA 从过滤柱中洗脱出来。
1.5.2 外周血加TRIzolTM法
①将样本混合液与乙醇(95%~100%)按1∶1 的体积比混匀;
后续步骤同1.5.1 节③~⑨。
1.5.3 外周血加RNAlaterTM法
①将样本混合液与无核酸酶水按1∶1 的体积比混匀;
②将混合液与RNA 裂解液按1∶4 的体积比混匀,混匀后加入过滤柱,4 000×g离心1 min,留过滤液;
③加入等体积的乙醇(95%~100%)混匀,混匀后加入过滤柱,10 000×g离心1 min,弃掉滤液;
后续步骤同1.5.1 节④~⑨。
1.5.4 血细胞加DNA/RNA ShieldTM法
①每1 mL 样本混合液中加入20 μL PK 充分混匀,室温孵育30 min;
②孵育后加入等体积的异丙醇混匀;
后续步骤同1.5.1 节③~⑨。
1.5.5 白细胞加TRIzolTM法
①将混合液与乙醇(95%~100%)按2∶1 的体积比混匀;
后续步骤同1.5.1 节③~⑨。
1.5.6 白细胞加RNAlaterTM法
①将样本混合液与无核酸酶水按1∶1 的体积比混匀;
②将混合液与RNA 裂解液按1∶4 的体积比混匀,混匀后加入过滤柱,4 000×g离心1 min,留过滤液;
③加入等体积的乙醇(95%~100%)混匀;
后续步骤同1.5.1 节③~⑨。
1.5.7 直接冻存法
①将样本混合液与DNA/RNA ShieldTM(2×)保存液按1∶1 的体积比混匀;
②每0.1 mL 样本混合液中加入2 μL PK 充分混匀,室温孵育30 min;
③将混合液与异丙醇按1∶2 的体积比混匀;
后续步骤同1.5.1 节③~⑨。
1.5.8 PAXgene 全血RNA 管法
①3 000×g~5 000×g离心10 min,弃去上清液;
②加入4 mL 无核酸酶水,涡旋混匀后3 000×g~5 000×g离心10 min,弃去上清液;
③加入DNA/RNA ShieldTM(1×)保存液使沉淀全部浸没,每0.3 mL 样本加入30 μL DNA 裂解液和15 μL PK,混匀后55 ℃孵育30 min;
④混匀后以最大速度离心2 min,将上清液转移至试管内;
⑤加入等体积的RNA 裂解液并混匀,加入过滤柱后离心,留过滤液;
⑥加入等体积的乙醇(95%~100%)混匀;
后续步骤同1.5.1 节③~⑨。
1.6 RNA 浓度、纯度和完整性分析测定
在QubitTM2.0 荧光计上使用QubitTMRNA HS Assay试剂盒测定提取所得RNA的浓度,使用Epoch微孔板分光光度计测定提取所得RNA 的纯度(D260/D280),浓度和纯度均重复测量3 次,取平均值。使用2100 生物分析仪测定提取所得RNA 的完整性(RNA integrity number,RIN)。
1.7 RNA 质量评估
RNA 质量主要从产量、纯度和RIN 值3 个方面进行评判。其中RNA 产量需根据RNA 洗脱体积与RNA浓度来计算。由于本研究各组外周血起始量略有差异,因此,将不同外周血起始量所得RNA 浓度与洗脱体积之积统一换算成每毫升外周血起始量所得RNA产量。RNA 纯度在1.8~2.0 范围表明样本的纯度较高,D260/D280值<1.8 表明有蛋白质或酚污染,而D260/D280值>2.0 表明有异硫氰酸胍等物质污染。RIN 值能够反映样本RNA 的降解程度,RIN 值一般在0(完全降解)至10(完整未降解)之间[12],样本RNA 的RIN 值大于7 时可认为完整性较好。
1.8 统计分析
2 结果
2.1 不同预处理方法对血液样本RNA 质量的影响
对不同预处理方法处理的血样抽提RNA 后,测量RNA 纯度、RIN 值、RNA 浓度和RNA 产量见表1。各预处理组使用2100 生物分析仪得到凝胶电泳图谱(图1)。
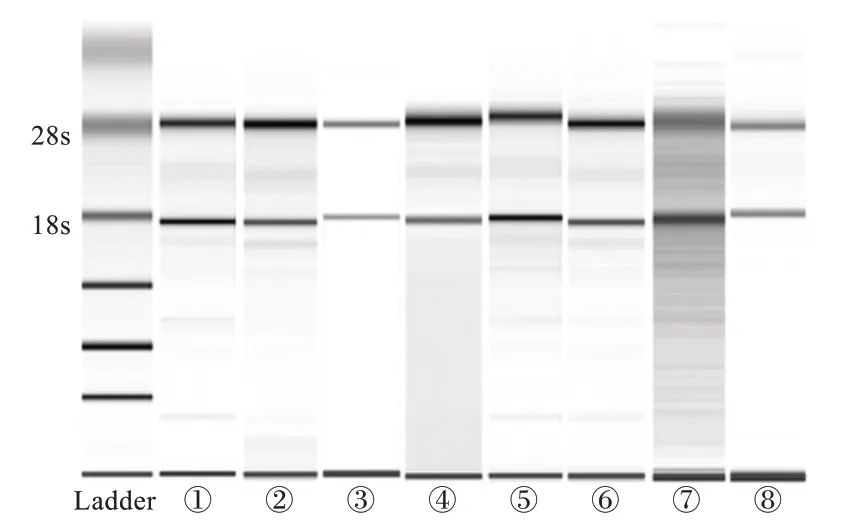
图1 外周血样本8 种预处理方法的电泳图谱Fig.1 Electrophoretogram of peripheral blood samples from 8 pretreatment methods
对各组样本所得的RNA 纯度进行分析,首先根据预处理方法将样本分为8 组进行配对t检验,结果显示,部分预处理方法之间RNA 纯度差异具有统计学意义。白细胞加RNAlaterTM法和直接冻存法的RNA纯度低于1.8,PAXgene 全血RNA 管法的RNA 纯度略高于2.0,其余5 组纯度较好且组间差异无统计学意义(P>0.05)。
对各组RIN 值进行配对t检验,部分预处理方法之间RIN 值差异具有统计学意义。结果显示,除直接冻存法外,其余预处理方法RIN 值均大于7,可满足高通量测序等实验对样本的要求,仅外周血加DNA/RNA ShieldTM法和血细胞加DNA/RNA ShieldTM法与PAXgene 全血RNA 管法相比差异无统计意义,其余方法与PAXgene 全血RNA 管法相比,RIN 值均较差且差异具有统计学意义(P<0.05)。
对不同预处理方法所得的RNA 产量进行配对t检验,部分预处理方法之间RNA 产量差异具有统计学意义。结果显示,外周血加TRIzolTM法、白细胞加RNAlaterTM法和直接冻存法与其余5 组相比产量较低,其中直接冻存法的产量与其余5 组相比差异均具有统计学意义(P<0.05),白细胞加RNAlaterTM法产量明显低于白细胞加TRIzolTM法(P<0.05)。
对于每一种预处理方法而言,同一预处理方法的不同样本在RNA 纯度、RIN 值以及RNA 产量之间差异均无统计学意义,这表明实验结果不受样本因素影响。
2.2 储存时长对血液样本RNA 质量的影响
不同储存时长下RNA 纯度、RIN 值、RNA 浓度和RNA 产量见表2。
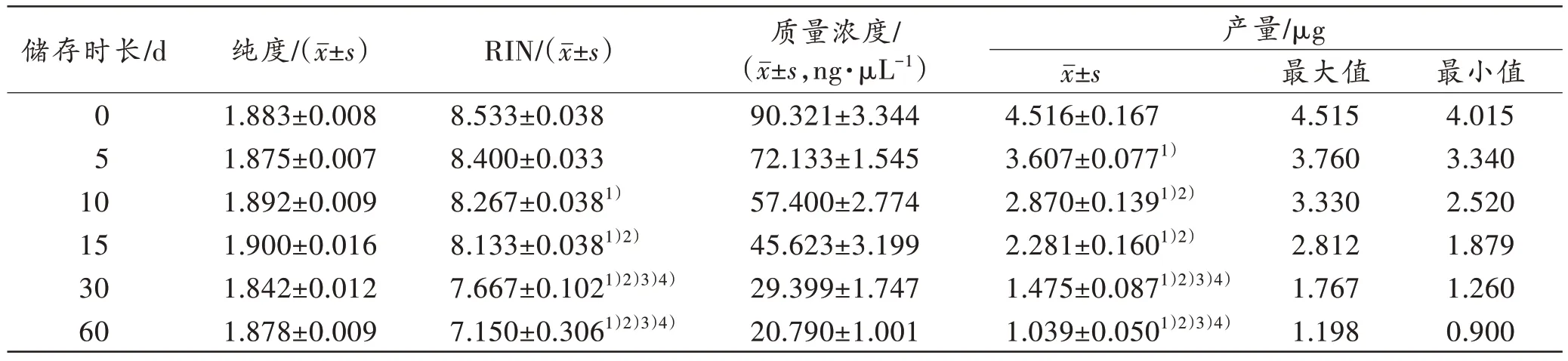
表2 外周血样本不同储存时长提取总RNA 纯度、完整性、质量浓度和产量的比较Tab.2 Comparison of purity,integrity,mass concentration and yield of total RNA of peripheral blood samples extracted at different storage times
对不同储存时长样本所得RNA 的纯度进行分析,单因素方差分析结果显示,RNA 纯度不受储存时长的影响(P>0.05)。各组纯度均在1.8~2.0 范围内,可认为样本RNA 纯度较好。
对不同储存时长样本所得RIN 值进行分析,单因素方差分析结果显示,RIN 值受储存时长的影响(P<0.05)。与直接进行RNA 抽提的样本(储存0 d)相比,储存10 d 及以上的样本RIN 值均有明显降低且差异具有统计学意义(P<0.05)。
对不同储存时长样本所得RNA 产量进行分析,单因素方差分析结果显示,RNA 产量受储存时长的影响(P<0.05)。随着储存时长的增加,样本RNA 的产量逐渐减少,与储存0 d 样本相比,储存5 d 起样本RNA 产量下降明显且差异具有统计学意义(P<0.05)。
此外,样本之间在相同的储存时长下RNA 纯度、RIN 值以及RNA 产量差异均无统计学意义,这表明实验结果不受样本因素影响。
3 讨论
外周血样本不仅是法医学实践中常见的一种检材,也是科学研究中常用的样本类型。一般情况下,因研究条件的限制,需要在外地或偏远地区采集外周血,采集现场条件各不相同且多数无法达到实验室条件,后续运输条件等不稳定因素都会对外周血中RNA的质量造成影响。离体后的外周血随时间的推移,血中的各种成分受到血细胞代谢、广泛存在的内源性RNase 等诸多因素影响,RNA 易发生降解,提取到的RNA 数量和质量较差,难以满足诸如高通量测序等后续实验的要求[13],使得从外周血中提取高质量RNA成为一个很大的挑战。
本研究选取8 种外周血样本预处理方法及6 个储存时长,统一储存在-80 ℃条件下,采用试剂盒抽提的方法对样本进行抽提,对总RNA 进行质量检测(浓度、纯度和完整性)并比较分析,从而选出最优的处理方法和适宜的储存时长范围。
3.1 预处理方法
在非实验室环境下采集样本后,直接冻存外周血是目前最普遍的样本处理方法,由于该方法没有使用任何具有稳定成分的添加剂,可作为对照组排除储存期间稳定剂的毒性或可能干扰实验的其他因素。LIU等[5]对血液样本采取6 种预处理方法,并使用TRIzol法和PAXgene 试剂盒提取法进行抽提,结果显示,经过处理的样本完整性好于未经处理的样本。因此,本研究选取了8 种样本预处理方法,以确定何种方法能达到提高样本中RNA 质量的效果。
通过对实验结果进行统计分析,发现样本在冻存前进行预处理可有效提高RNA 质量。除白细胞加RNAlaterTM法和直接冻存法的RNA 纯度较低,PAXgene 全血RNA 管法RNA 纯度均值略高于2.0 外,其余5 组RNA 纯度较好,均在1.8~2.0。PAXgene 全血RNA 管法RIN 值最高,样本RNA 片段几乎未发生降解;直接冻存法RIN 值最低且低于7.0,样本RNA 发生了部分降解;其余各组RIN 值均高于8.0。血细胞加DNA/RNA ShieldTM法RNA 产量最高,其次为外周血加DNA/RNA ShieldTM法。在对整体结果进行分析时发现,白细胞添加TRIzolTM和RNAlaterTM保存液的RNA 质量要优于外周血添加TRIzolTM和RNAlaterTM保存液。白细胞添加TRIzolTM保存液的样本在RNA纯度、RIN 值和产量3 个方面均优于白细胞添加RNAlaterTM保存液的样本,且在RNA 产量上差异具有统计学意义,这与LIU 等[5]对外周血预处理方法研究中部分相同方法所得结果一致。经过上述比较分析,外周血加DNA/RNA ShieldTM、血细胞加DNA/RNA ShieldTM、白细胞加TRIzolTM和PAXgene 全血RNA 管4 种方法在纯度、RIN 值和产量方面均较好。相比其余3 种方法,PAXgene 全血RNA 管的成本较高,不适用于大规模的样本采集,同时在采集后需至少2 d 时间才能够低温运输,其余3种方法中,外周血加DNA/RNA ShieldTM法相对操作步骤最少,能最大限度减少外源性污染,由于抽提试剂盒内含有DNA/RNA ShieldTM,无须单独购买,添加DNA/RNA ShieldTM保存的样本抽提出DNA 的RIN 值均高于其余两种方法。
3.2 储存时长
外地采集的外周血样本经过处理并低温运输到实验室进行处理的过程中,无法确定样本的储存时长。目前有关保存时间的研究[11,14]储存时长设为0 d(立即抽提)至10 d,结果表明,随着储存时长的增加,RNA 逐渐发生降解且与立即抽提得到的RNA 相比差异具有统计学意义。因此,本研究选取了6 个储存时长(0、5、10、15、30 和60 d)从产量、纯度和RIN 值3 个方面对样本储存时长对RNA 质量的影响进行了评估。通过对实验结果进行统计分析发现,储存时长对RNA 纯度无明显影响,纯度保持在1.815~1.952。随着储存时长的增加,RNA 浓度、产量及RIN 值均呈现下降趋势,其中RNA 产量除在10 d 与15 d、30 d 与60 d的比较差异无统计学意义外,其余各组间差异均有统计学意义,储存60 d 样本的RNA 产量已无法满足RNA 测序等实验要求。而RIN 值在10 d 起出现下降,除30 d 与60 d 比较差异无统计学意义外,在储存10 d及以上的各组间RIN 值差异均有统计学意义,到储存60 d 时RIN 值已降至RNA 测序等实验要求的最低值[12]。本研究部分结果与何松哲等[10]、洪恩宇等[11]关于储存时长对RNA 质量影响的结果基本一致。
本研究对RNA 纯度是否受储存时长的影响与何松哲等[10]研究结果不同,考虑可能是随着储存时长的增加,红细胞裂解以及血中大量内源性RNase 的释放,外周血中蛋白大量增加,从而改变了RNA 纯度。而本研究对外周血样本中添加了DNA/RNA ShieldTM保存液,对外周血中的RNA 起到了保护作用,减小了RNA 质量的降低。因此,本研究储存10 d 的样本在RNA 浓度和RIN 值上要明显优于其他研究[11]储存7 d的样本RNA 质量。
3.3 结论
对外地采集或无法立即进行实验的外周血样本进行冷冻前预处理,可确保能够获得大量高质量RNA,从而保证转录组分析等检测技术的成功。本研究结果显示,外周血加DNA/RNA ShieldTM保存液的方法是样本最佳预处理方法,经过该方法预处理的样本在低温条件下最多可存放60 d,其质量也可满足高通量测序等下游实验的要求。总而言之,对需要一定时间保存的样本进行预处理是一种能有效保障RNA质量的方法,可应用于RNA 抽提前的外周血样本保存。

