聚多巴胺仿生掺锶羟基磷灰石涂层的制备及对骨髓间充质干细胞生物学特性的影响*
孙仪庭 陈思悦 陈 昱 王天鸽 周志捷 林开利 刘加强
钛及其合金具有优良的力学性能,作为硬组织替代材料被广泛应用于口腔种植和骨缺损修复等领域[1]。然而,钛合金与周围组织结合强度低,表面无法直接成骨,会影响植入物的长期稳定性。
与其他如等离子喷涂、电化学沉积法、溶胶-凝胶法等表面改性方法[2-4]不同,仿生矿化法是指通过具有和人体血液相似的PH值以及离子组成的模拟体液中,促进材料表面的离子沉积形成羟基磷灰石。该成分与天然骨的无机结构相似,能强化钛合金与周围组织的骨结合[5,6]。
锶(Sr)与钙(Ca)有相似的物理和化学特性,是参与骨骼形成过程的微量元素之一[7],被证实有影响骨吸收以及骨形成的双重作用[8-10]。当两者同时存在时,Sr2+会替代部分Ca2+形成新的晶体,称掺锶羟基磷灰石,提高钛合金的生物相容性和成骨能力[11,12]。
通过邻苯二酚和氨基功能基团发生氧化-聚合等反应,形成的聚多巴胺薄膜具有良好黏附作用[13,14]。吸附钛表面的聚多巴胺分子能够与模拟体液里的钙离子螯合,通过静电作用将Ca2+与PO43-结合形成羟基磷灰石[15,16]。
为此,本实验拟采用聚多巴胺仿生矿化法,利用聚多巴胺良好的黏附能力,增强模拟体液中离子与材料表面的结合,改善羟基磷灰石涂层的厚度和稳定性。同时掺入一定比例的锶离子,于钛合金表面制备掺锶羟基磷灰石涂层。通过一系列体外实验探究材料对骨髓间充质干细胞生物学性能的调控作用。
1.材料及方法
1.1 聚多巴胺及掺锶羟基磷灰石涂层的制备
1.1.1 钛片清洗 根据文献[17]将钛片(10mm×10mm×2mm)用砂纸打磨抛光后以丙酮、无水乙醇及去离子水超声清洗。反复3次后,室温晾干钛片。
1.1.2 制备聚多巴胺涂层 将盐酸多巴胺(Sigma Aldrich)溶解在Tris溶液(10mM,PH=8.5)制备成2g/L多巴胺溶液[18]。把超声清洗完的钛合金材料置于溶液,室温避光反应24h。取出后用大量去离子水反复清洗去除未附着的聚多巴胺单体,室温干燥。
1.1.3 掺锶羟基磷灰石涂层制备 首先根据Kokubo等[19]先前的研究制备1.5倍模拟体液(1.5×SBF,Na+213.0;Ca2+3.75,Cl−221.7,HPO42−1.5,K+7.5 Mg2+2.25,SO42−0.75,HCO3-6.3 mM)。按照Sr2+/(Sr2++Ca2+)=10%的比例用锶离子替代钙离子,制备含锶模拟体液(PH=7.4)[12]。将上述聚多巴胺修饰的钛合金材料浸泡至该溶液,放置于37℃恒温摇床反应,每两天更换新的模拟体液保证一定的离子浓度。7d后取出钛片,大量去离子水冲洗,室温干燥。
1.2 材料表征 场发射扫描电子显微镜(FE-SEM;S-4800,Hitachi)观察喷金处理后各组材料的表面形貌;通过X 射线光电子能谱(XPS;EscaLab250,Thermo)测定不同样品的表面元素组成;借由拉曼光谱(Raman;RW2000,Renishaw)在波长532nm处验证PDA是否成功负载;X射线衍射分析(XRD;Buker D8,ADVANCE)测定材料的化学组成和晶体结构,2θ角范围:10-90°,扫描速率:6°/min,扫描步长:0.02;通过接触角测角仪(WCA;SL200B;Kono)测定各组材料的水接触角。
1.3 BMSCs的细胞黏附和增殖
1.3.1 CLSM用于检测BMSCs细胞骨架的丝状肌动蛋白 将钛片、聚多巴胺修饰钛片、聚多巴胺-羟基磷灰石修饰钛片以及聚多巴胺-掺锶羟基磷灰石修饰钛片共4种材料置于24孔板,并以2×104/孔密度将大鼠骨髓间充质干细胞接种于材料表面。使用含有10%胎牛血清以及双抗的α-MEM培养基,于37℃,5%CO2培养箱中培养。培养24h后吸取培养基。加入4%多聚甲醛固定30min,接着用1%TritonX-100孵育10min,然后用PBS漂洗。1%牛血清白蛋白封闭30min后,配制一定浓度的异硫氰酸荧光素(FITC)标记鬼笔环肽(Sigma Aldrich),并加入各组样品,在37℃下孵育30min。之后,将样本用PBS洗涤后,加入DAPI室温孵育10min,再次用PBS洗涤。随后借由激光扫描共聚焦显微镜观察细胞的铺展形态。
1.3.2 细胞增殖试验 按照1×104/孔密度将细胞接种于材料表面。分别在第1、4和7d进行细胞增殖测定。吸除培养基并用PBS漂洗。向每孔加入等体积的含溴化-3-(4,5-2甲基噻唑基-2)-2,5-二苯基四唑(MTT)的培养基,避光孵育4h。之后弃上清,加入同体积DMSO室温孵育15min并振荡,而后吸取100μL溶液转移至新96孔板,用酶标仪(Multiskan FC,Thermo Scientific)在490nm波长下测定OD值。
1.4 BMSCs的成骨分化
1.4.1 细胞碱性磷酸酶活性半定量及定性检测 通过ALP染色及半定量实验探究各组材料对细胞成骨分化能力的影响。以2×104/孔密度将BMSCs接种于材料表面进行共培养。1d后改为成骨诱导培养基。
于第4d终止培养。加入1% Triton-100X裂解并12000rpm/min离心10min,提取上清液,根据试剂盒的说明测定不同组的细胞碱性磷酸酶活性。第7d弃去培养基,PBS漂洗后用4%多聚甲醛固定30min,根据BCIP/NBT碱性磷酸酯酶显色试剂盒进行染色,显微镜下观察并拍照记录。
1.4.2 成骨基因相对表达qPCR 将BMSCs与四组材料共培养,24h后更换为成骨诱导培养基。分别在细胞与材料成骨诱导培养的第4和第7d提取总RNA。按照PrimeScriptTMRT reagent Kit说明书(Takara,Japan)逆转录成cDNA,在Light Cycler 96实时PCR系统(Roche,Switzerland)上使用SYBR green PCR反应混合物(Roche,Switzerland)研究聚多巴胺仿生掺锶羟基磷灰石涂层对细胞的成骨分化能力的影响。检测RUNX2、ALP、COL-I和BSP等成骨相关基因的相对表达量。
1.5 统计学分析 数据以平均值±标准差表示,采用SPSS 22.0统计分析软件。通过单因素方差分析(One Way ANOVA)对数据进行统计学分析。P<0.05,差异具有统计学意义。
2.结果
2.1 材料表征检测结果 图1显示材料实物图以及扫描电镜观察的表面形貌。可见钛合金(Ti)组表面相对光滑,聚多巴胺修饰后的钛合金(Ti@PDA)在低倍镜下形貌与钛合金组相似,在高倍镜下可见均匀分散的球形颗粒,为纳米尺寸。聚多巴胺-羟基磷灰石组(Ti@PDA+SBF)表面凹凸不平,可见呈针叶状的纳米颗粒晶体层层堆叠于材料表面。聚多巴胺-掺锶羟基磷灰石组(Ti@PDA+SBF(Sr))在高倍镜下显示矿物层形成,为球状纳米颗粒的团聚。

图1 (A)各组材料的实物图;(B)材料的扫描电镜图
图2依次显示了钛合金组、聚多巴胺-钛合金组、聚多巴胺-羟基磷灰石组以及聚多巴胺-掺锶羟基磷灰石组表面元素的X射线光电子能谱(XPS)结果。不同的修饰阶段呈现不同的变化,钛合金组主要呈现Ti,O和C的峰。与先前的文献结果一致,修饰聚多巴胺后XPS结果记录明显的N峰,且Ti明显减弱,侧面证实PDA的均匀涂覆[20]。在SBF溶液中浸泡后,Ca(2p,2s)和P(2p,2s)峰的强度显着增加,这表明在PDA膜上形成了磷酸钙化合物。Ca2p和P2p峰的存在,说明有类羟基磷灰石的结构[21]。Sr3p特征峰的出现则证明锶离子的成功负载。

图2 X线光电子能谱分析各组材料表面的元素组成
如图3 拉曼光谱所示:在1350cm-1和1580cm-1波长处,聚多巴胺-钛合金组样品表面可见聚多巴胺的特征峰,由此可进一步证明聚多巴胺成功地沉积在钛合金组样品表面[22]。
Ti@PDA+SBF 和Ti@PDA+SBF(Sr)的XRD谱(图4)显示仿生矿化后于2θ=26°和2θ=32°处出现了HA 的特征衍射峰。与Ti@PDA+SBF 组相比,Ti@PDA+SBF(Sr)组的HA 特征衍射峰强度减弱,说明涂层的结晶性降低。
从图5 接触角测量的结果来看,Ti 组的接触角角度最大,与各组之间均有统计学意义。再者是Ti@PDA 组,其 次 是Ti@PDA+SBF(Sr)组。Ti@PDA+SBF 组的接触角测量值最小。后三组两两之间比较均有统计学差异。一般认为接触角角度越小,亲水性越高。

图3 各组材料的拉曼光谱

图4 各组材料的X射线衍射图谱分析
2.2 各组材料表面的细胞黏附和细胞增殖 材料植入后会与周围组织直接接触,是否具有良好的生物相容性至关重要。图6 为BMSCs 在各组材料表面早期黏附的情况。可见Ti 组表面细胞多呈梭形,细胞铺展面积较小,伪足伸展少。Ti@PDA+SBF 组表面细胞数量略多余对照组,且细胞铺展面积有所增加。Ti@PDA+SBF(Sr)以及Ti@PDA 两组材料上的BMSCs 铺展面积显著大于Ti 组,表现出融合,多层和聚集的形态。此外,细胞通过更多的肌动蛋白丝与相邻细胞相连,可见丝状伪足伸展,而聚多巴胺-掺锶羟基磷灰石组表面细胞密度略大于聚多巴胺-钛合金组。细胞早期完全铺展有利于后续细胞的增殖和分化。

图5 各组材料的水接触角测量比较,采用单因素方差分析比较各组材料的水接触角,*代表与Ti组比较P<0.05,#代表与Ti@PDA+SBF(Sr)比较P<0.05

图6 (A)Ti(B)Ti@PDA(C)Ti@PDA+SBF(D)Ti@PDA+SBF(Sr),大鼠骨髓间充质干细胞在材料表面培养24h的CLSM图
图7为BMSCs在Ti、Ti@PDA、Ti@PDA+SBF和Ti@PDA+SBF(Sr)上培养1、4和7d后的MTT实验结果。图中可见每组细胞均有良好的增殖能力,细胞数随时间呈上升趋势。总体来说Ti@PDA组表面细胞增殖最为显著,与Ti组相比在第1、4和7d均显著增强了细胞的增殖能力(P<0.05)。Ti@PDA+SBF(Sr)组有着相似的结果,但两组之间无显著性差异。Ti@PDA+SBF 组在第4d的细胞数较低于Ti组,而第1和7d 的结果略高,但两组细胞数量均无明显差异。研究表明细胞在材料表面的黏附和伸展有利于细胞增殖。而图7 MTT结果也显示细胞在Ti@PDA和Ti@PDA+SBF(Sr)组有更好的增殖能力,这与细胞在材料表面铺展结果(图6)相一致。

图7 BMSCs在各组材料表面培养1、4和7d的增殖情况,采用单因素方差分析比较各组吸光度,*P<0.05
2.3 细胞ALP 活性 图8 所示为成骨诱导4d 后各组材料表面细胞的碱性磷酸酶活性。Ti@PDA组的ALP 水平略高于Ti 组,但未见统计学意义。Ti@PDA+SBF 组的ALP 水平高于Ti@PDA 以及Ti 组,Ti@PDA+SBF(Sr)组表面BMSCs 细胞内碱性磷酸酶活性明显高于其他3 组(P<0.05),说明有更好的促进细胞成骨分化的能力。
ALP 定性结果如图9 所示,成骨诱导培养7d后,Ti@PDA+SBF(Sr)组染色最深,其次为Ti@PDA+SBF 组,再者是Ti@PDA 组,最后是对照组。整体趋势与细胞碱性磷酸酶活性半定量测试结果一致,证明聚多巴胺仿生的掺锶羟基磷灰石涂层能较强的促进细胞成骨分化。ALP 是BMSCs早期成骨分化的标志,是参与骨形成过程的重要酶之一,与成骨细胞的分化有正向关系。ALP活性越高说明成骨细胞前体细胞向成骨细胞分化越显著。结果说明经聚多巴胺修饰和复合锶离子的羟基磷灰石涂层有望提高成骨活性。
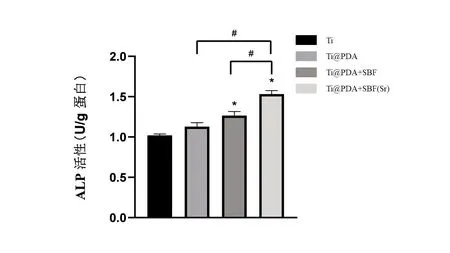
图8 不同材料表面的细胞成骨诱导培养4d后的细胞碱性磷酸酶活性。采用单因素方差分析比较各组的ALP活性,*代表与Ti组比较P<0.05,#代表与Ti@PDA+SBF(Sr)比较P<0.05
2.4 BMSCs 成骨相关基因表达的检测 图10为BMSCs在各组材料表面培养4 和7d 时成骨相关基因的相对表达量。在第4d,Ti@PDA+SBF(Sr)组细胞的各基因表达量均高于对照组且具有统计学意义(P<0.05)。第7d 各组材料表面细胞的基因表达量均有所升高,其中Ti@PDA+SBF(Sr)组升高更为显著,且与其他三组的表达差异均有统计学意义。表明聚多巴胺仿生掺锶羟基磷灰石涂层促进 了RUNX2、ALP、COL-I 和BSP 成 骨 因 子 的表达。

图9 (A)Ti(B)Ti@PDA(C)Ti@PDA+SBF(D)Ti@PDA+SBF(Sr)不同材料表面的细胞成骨诱导培养7d后的ALP定性结果

图10 细胞在不同材料表面成骨诱导培养4和7d,成骨相关基因表达情况。采用单因素方差分析比较各组的相对基因表达量,*代表与Ti组比较P<0.05,#代表与Ti@PDA+SBF(Sr)比较P<0.05
3.讨论
钛及钛合金是骨/齿科广泛应用的硬组织替代材料。理想的植入体在植入体内后应起到良好的骨引导作用,便于做到骨性结合。对其进行表面改性旨在做到植入体能够即刻负载,有良好的骨整合性并且满足长期稳定性的需求[23]。
羟基磷灰石是动物和人骨骼的主要无机组成成分[24],作为人体骨骼中最常见的磷酸钙盐并且与骨骼中矿物相的化学组成成分相似,同时具备理想生物相容性以及骨诱导性。研究普遍认为磷灰石类材料相对于钛合金材料能更早的达到骨整合,但负载能力较差。为了结合钛合金优秀的力学性能以及羟基磷灰石涂层良好的骨引导能力,关于钛及羟基磷灰石涂层的复合材料倍受关注[25]。目前的电化学沉积法、等离子喷涂和微弧氧化法等可以一定程度改善形成的羟基磷灰石涂层的结合强度和形态结构以优化钛合金材料[26,27]。
仿生矿化法于20世纪90年代首次被提出,通过将材料直接浸入具有与人体血液相近的PH值和无机成分模拟体液中形成羟基磷灰石结构。优点在于制备方法简单温和,不受限于材料本身[20]。根据羟基磷灰石的结构特性,我们可以通过复合不同离子改善羟基磷灰石涂层的生物活性和稳定性。骨骼中含有多种微量元素,低剂量的锶离子可以促进成骨及成血管作用[28,29]。其中锶离子的半径小于钙离子,可以取代部分钙离子掺入羟基磷灰石晶格并在骨形成和矿化中起重要作用。
聚多巴胺在贻贝中首次被发现,是多巴胺的衍生物之一,可以通过简单的方法在弱碱性条件下自聚合[30]。带有PDA涂层的植入物表面亲水性更佳,有利于蛋白的吸附和细胞反应,例如促进细胞黏附和细胞增殖[31]。聚多巴胺直接影响黏着斑蛋白的表达,经FAK/MAPK途径涉及BMSCs成骨分化过程,因此认为具有聚多巴胺涂层的植入物在体内有优秀的直接骨结合能力[22,32]。聚多巴胺含有多种邻苯二酚基团和氨基活性基团,与物体之间可以通过各种化学键产生结合[33-35],其末端丰富的酚羟基和醌基,能够螯合模拟体液中的Ca2+形成有机金属络合物并进一步吸附PO43-,加强羟基磷灰石在聚多巴胺薄膜表面的沉积和稳定性。
与其他复杂的表面改性方法相比,在本研究中,我们关注具有良好黏附能力聚多巴胺,通过构建该涂层加强仿生矿化工艺过程离子的沉积从而稳定形成的羟基磷灰石结构。向模拟体液中掺入一定比例的锶离子改变涂层的成分,进一步促进其促成骨的能力。
从扫描电镜观察材料表面形貌的结果来看,聚多巴胺颗粒以及羟基磷灰石能均匀的修饰到钛合金表面。同先前的研究一致发现锶离子会减小晶体的尺寸,改变经典羟基磷灰石的针状结构。XPS、XRD和拉曼光谱能进一步证明聚多巴胺仿生掺锶羟基磷灰石涂层的制备。接触角测试说明Ti@PDA+SBF(Sr)组有仅次于Ti@PDA+SBF组的亲水性,这可能是由于晶体结构的变化,纳米颗粒尺寸减小。
通过细胞黏附和细胞增殖实验发现聚多巴胺的修饰可以促进细胞在材料表面的黏附铺展,而复合掺锶羟基磷灰石涂层后该作用进一步增强。材料植入体内后直接与细胞和组织反应,良好的细胞黏附能力和促进细胞增殖能力对后续骨整合起到重要意义。
除此之外,聚多巴胺仿生掺锶羟基磷灰石涂层表面的细胞与其他组相比有更高的细胞碱性磷酸酶活性和成骨相关基因的表达。这可能是因为聚多巴胺可以直接影响骨整合,而羟基磷灰石与天然骨骼相似的无机成分和优秀的生物相容性可促进细胞的成骨分化。低剂量掺入的锶离子本身也具有促进成骨,减少骨吸收的作用。
本实验通过简单的仿生矿化法,在钛合金表面结合聚多巴胺并复合掺锶的羟基磷灰石,成功制备一具有良好生物相容性的复合涂层。通过一系列体外实验验证材料促进了大鼠骨髓间充质干细胞的细胞黏附、增殖和细胞的成骨分化。证明了该材料对细胞生物学活性的正向调控作用。

