N-乙酰半胱氨酸对软骨细胞基质降解和骨关节炎的作用研究
张卫华,张建业,叶恒,李永寿
(1.武汉市汉阳医院骨科,湖北 武汉 430050;2.湖北医药学院基础医学院,湖北 十堰 442000)
骨关节炎(osteoarthritis,OA)是一种以关节软骨变性、骨质疏松及滑膜炎为特征的慢性骨关节疾病,中老年人较为常见,临床主要表现为关节疼痛、活动受限等,甚至可导致残疾,严重影响患者的生活质量[1-2]。OA病理特征主要以软骨基质的降解和破坏为主,其与衰老、氧化应激、炎症反应和分解代谢相关的基因表达有关[3-4]。目前,临床骨关节炎并无特效治疗,因此,寻找用于治疗骨关节炎的药物是一项重要目标。
N-乙酰半胱氨酸(N-acetylcysteine,NAC)是一种谷胱甘肽前体,可以通过靶向于活性氧(reactive oxygen species,ROS)产生抗氧化作用,并且对许多ROS相关的疾病动物模型均有良好的抗氧化作用[5-6]。但是,NAC对于治疗骨关节炎的作用及其相关机制研究较少,因此,本研究通过建立体内外模型探讨了NAC的抗骨关节炎作用及其相关的分子机制。
1 实验材料与方法
1.1 实验材料 四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)(ST316),碘化吡啶(propidium iodide,PI)染色液(P0137),ROS检测试剂盒(S0033),蛋白裂解液(P0013C),蛋白酶磷酸酶抑制剂混合物(P1046),超氧化物(superoxide dismutase,SOD)检测试剂盒(S0060),总谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)检测试剂盒(S0058)购自碧云天生物科技有限公司(中国);Anti-基质金属蛋白酶(matrix metalloprotinase,MMP)-3(#14351),Anti-MMP-9(#13667),Anti-MMP-13(#69926),Anti-GAPDH(#5174)购自Cell Signaling生物公司(美国);Anti-ADAMTS 4(PA1-1749A)购自赛默飞生物科技有限公司(美国)。
1.2 细胞培养 人软骨细胞(HC-A)购自Sigma公司(美国),用含有10%胎牛血清(fetal bovine serum,FBS)、100U/mL青霉素及100μg/mL链霉素的DMEM/F12培养基,于5% CO2和37℃的细胞培养箱(赛默飞,美国)中培养。
1.3 MTT试验 以1×106个/mL密度将HC-A细胞接种于96孔板,过夜培养,待细胞长至80%时,将细胞分为对照组、白细胞介素(interleukin,IL)-β及IL-β+NAC(2.5、5、10 mmol/L)组,用不同浓度的NAC预处理2 h,然后用IL-1β处理24 h,根据制造商说明书使用MTT液检测细胞活力。
1.4 PI染色 以1×106个/mL密度将HC-A细胞接种于24孔板(预先放入细胞爬片),过夜培养,将细胞分为对照组和NAC(10 mmol/L)组,NAC组加入10 mmol/L NAC,对照组加入无血清DMEM/F12培养液,于37℃培养24 h,随后弃掉培养基,用磷酸盐缓冲液(phosphate Buffered Saline,PBS)洗涤1次,加入PI和4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染液进行染色30 min,弃掉染液,用PBS洗涤3次,5 min/次,然后用4%多聚甲醛室温固定20 min,用PBS洗涤3次,5 min/次,最后使用共聚焦荧光显微镜观察拍照检测。
1.5 细胞内ROS检测 以1×106个/mL密度将HC-A细胞接种于96孔板,过夜培养,待细胞长至80%时将细胞分为对照组、IL-β及IL-β+NAC(2.5、5、10 mmol/L)组,用不同浓度的NAC预处理2 h,然后用IL-1β处理24 h,弃掉培养基,加入2',7'-二氯荧光黄双乙酸盐(2',7'-Dichlorodi-hydrofluorescein diacetate,DCFH-DA)荧光探针于37℃反应20 min,使用酶标仪于波长488/525 nm检测荧光值。
1.6 SOD和GPX活性检测 细胞处理结束后,根据制造商要求使用商业试剂盒检测细胞内的SOD和GPX活性。
1.7 蛋白免疫印迹 buffer(4×)于100℃煮沸5 min,然后采用聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分离蛋白,电泳条件:80 V,30 min;120 V,60 min。随后采用100 V,90 min将电泳分离后的蛋白转移至聚偏佛乙烯(poly vinylidene fluoride,PVDF)膜,用5%脱脂奶粉室温封闭60 min,TBST洗涤5次,5 min/次,用一抗(MMP-3、MMP-9、MMP-13、ADAMTS 4及GAPDH,按1︰1 000稀释)4℃孵育过夜,TBST洗涤5次,5 min/次,用二抗[辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IG和HRP标记山羊抗鼠IG,按1︰10 000稀释]室温孵育90 min,TBST洗涤5次,5 min/次,用ECL化学发光法显影检测,Image J分析灰度值。
1.8 软骨细胞基质的形态学检测 以1×106个/mL密度将HC-A细胞接种于24孔板(预先放入细胞爬片),过夜培养,将细胞分为对照组、IL-1β组和IL-1β+NAC组,先用NAC预处理2 h,然后用IL-1β处理24 h,弃掉培养基,细胞在95%乙醇中固定,然后在室温下用1%阿尔新蓝染料(pH 1.0)染色过夜,随后使用倒置显微镜观察拍照。
1.9 OA动物模型 采用右膝关节前交叉韧带切断术建立OA大鼠模型,在第0天造模,提前禁食12 h,戊巴比妥钠(50 mg/kg)腹腔注射麻醉,固定于实验操作台,右膝关节刮毛备皮后用碘伏消毒。在无菌情况下,于膝关节内侧切约1 cm纵向切口,打开关节腔,同时切断前交叉韧带、内侧副韧带和内侧半月板,缝合伤口。术后连续肌肉注射4 d抗生素(氨苄青霉素,4×104U/d),假手术组在没有其他任何处理的情况下,缝合伤口,以手术当天为第0天。
1.10 给药与分组 SPF级别SD雄性大鼠48只(220~250 g)购于湖北医药学院基础医学院,随机分为假手术组、模型组、NAC-12.5 mg/kg、NAC-25 mg/kg、NAC-50 mg/kg及阳性对照组(双氯芬酸钠肠溶片,4 mg/kg),n=8。手术后2周(即第14天)开始灌胃给药,每天1次,模型组和假手术组灌胃给予等体积的CMCNa(0.5%),连续给药3周,在第35天行为学检测结束后腹主动脉取血,脱颈椎处死,分离大鼠关节软骨组织。
1.11 机械性痛阈值(paw withdrawal mechanical threshold,PWT)检测 采用电子自动爪触觉测试仪测定实验大鼠的机械刺激缩爪阈值PWT(单位:g),每周测量1次,将刺激针对准足底并逐渐增加刺激力量,大鼠感觉到痛觉后移开刺激针,设备记录并显示足瞬间移开的最大值,即PWT,隔5 min测量1次,连续测量3次,取其平均值。
1.12 反转录聚合酶链式反应(reverse transcriotion-polymerase chain reaction,RT-PCR)检测 分离和收集实验大鼠的膝关节软骨组织,称取约30mg,加入1 mL Trizol裂解液,组织研磨仪匀浆,提取组织总RNA,用NanoDrop 2000 Spectrophotometer检测RNA的浓度和纯度,用PrimeScript RT试剂盒和gDNA Eraser(宝日医生物技术有限公司,日本)将RNA(1 μg)逆转录为cDNA,使用配有SYBRs Green Master Mix(诺唯赞,中国)的CFX ConnectTMReal-Time系统(BioRad,美国)进行qRT-PCR定量分析。扩增条件:95℃预变性5 min;95℃变性15 s,60 ℃延伸30 s,重复40个循环,最后根据2-ΔΔCt法计算MMP-3、MMP-9、MMP-13、GAPDH mRNA的表达水平,引物序列:MMP-3 Forward:5’-AGTCTTCCAATCCTACTGTTGCT-3’,MMP-3 Reverse:5’-TCCCCGTCACCTCCAATCC-3’;MMP-9 Forward:5’-TGTACCGCTATGGTTACACTCG-3’,MMP-9 Reverse:5’-GGCAGGGACAGTTGCTTCT-3’;MMP-13 Forward:5’-ACTGAGAGGCTCCGAGAAATG-3’;MMP-13 Reverse:5’-GAACCCCGCATCTTGGCTT-3’;GAPDH Forward:5’-TGTGGGCATCAATGGATTTGG-3’,GAPDH Reverse:ACACCATGTATTCCGGGTCAAT。
1.13 组织病理学 采用番红固绿染色检测大鼠软骨组织病理变化,分离收集实验大鼠的膝关节软骨组织,置于10%福尔马林固定24 h,然后用EDTA脱钙液(0.5 M,pH=8)脱钙15 d,隔3 d换1次液,石蜡包埋,切成4 μm薄片,番红固绿染色并观察软骨病理变化。
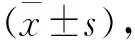
2 实验结果
2.1 NAC对软骨细胞细胞活力的影响 首先采用MTT法检测了IL-1β和NAC对软骨细胞HC-A细胞活性的影响,表明IL-1β(1 ng/mL)或IL-1β(1 ng/mL)+NAC(2.5、5、10 mmol/L)与对照组相比,对软骨细胞的细胞活力均无影响(P>0.05,见图1a),同时PI染色结果表明NAC(10 mmol/L)也不能够引起细胞凋亡(见图1b),因此,2.5、5、10 mmol/L的NAC及L-1β(1 ng/mL)应用于后续实验研究。
2.2 NAC对IL-1β诱导氧化应激的影响 大量ROS产生在软骨基质炎症病理变化过程中起着至关重要的作用,本研究结果表明IL-1β能够引起软骨细胞产生大量的ROS,预先给予NAC呈剂量依赖性降低ROS含量(P<0.05,见图2a)。同时,NAC预处理也能够抑制IL-1β诱导的软骨细胞GPX和SOD活性(P<0.05,见图2b和2c),这表明在软骨细胞中NAC能够抑制IL-1β诱导的氧化应激。
2.3 NAC对IL-1β诱导软骨细胞MMP表达及基质降解的影响 采用蛋白印迹法检测了NAC对IL-1β诱导的软骨细胞MMP表达的影响,结果表明IL-1β显著上调软骨细胞MMP-3、MMP-9、MMP-13及ADAMTS 4的蛋白表达水平,NAC预处理显著下调IL-1β诱导的MMP-3、MMP-9、MMP-13及ADAMTS 4蛋白上调(P<0.05,见图3a),同时,NAC也能够抑制IL-1β引起的软骨细胞基质降解(见图3b)。
2.4 NAC对骨关节炎大鼠PWT和膝关节直径的影响 结果表明模型组大鼠的PWT值较假手术组显著减小,灌胃给予NAC呈剂量性显著增加OA大鼠的PWT值(P<0.05,见图4a);同时,膝关节直径结果表明模型组大鼠的膝关节直径显著增加,但灌胃给予NAC呈剂量依赖性显著减小OA大鼠的膝关节直径(P<0.05,见图4b),这表明本研究成功建立了OA大鼠模型,同时表明NAC对OA具有潜在的保护作用。
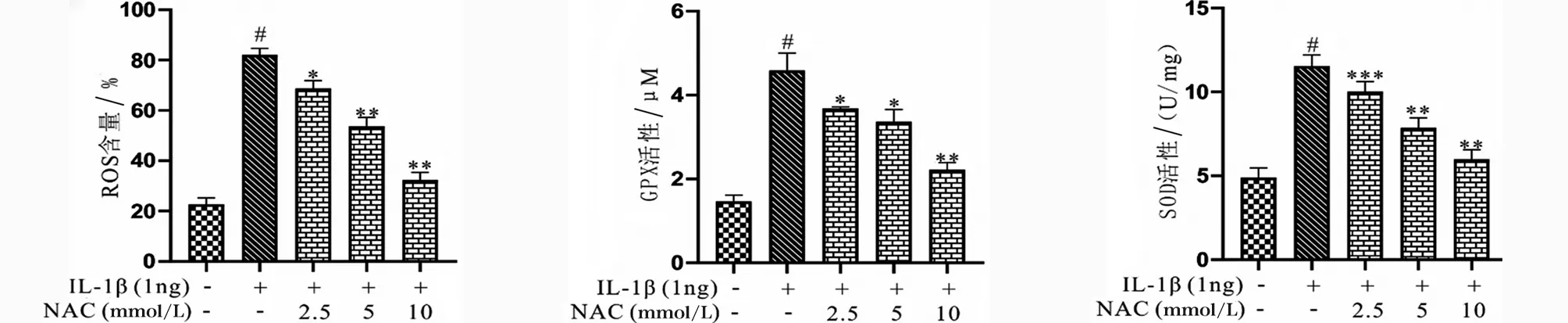
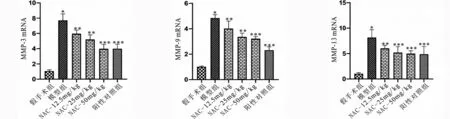
2.5 NAC对骨关节炎大鼠软骨组织MMP表达及基质降解的影响 RT-PCR结果表明模型组大鼠软骨组织中MMP-3、MMP-9和MMP-13的表达水平显著上调,但给予NAC呈剂量依赖性下调OA大鼠软骨组织中MMP-3、MMP-9和MMP-13的表达水平(P<0.05,见图5a~c)。同时,番红固绿染色结果表明模型组大鼠的软骨基质出现降解和破坏,给予NAC能够显著缓解OA大鼠的软骨基质破坏和降解(见图5d)。

a 软骨细胞的MTT细胞活性检测结果 b 软骨细胞的PI染色结果(×40;红色:PI,蓝色:DAPI)
a 软骨细胞中ROS的含量 b 软骨细胞中GPX的活性 c 软骨细胞中SOD的活性

a 软骨细胞MMP的蛋白表达水平

b 软骨细胞基质染色结果(×40,阿尔法新蓝)

a OA大鼠的PWT值 b OA大鼠的膝关节直径
a OA大鼠软骨组织中MMP-3的表达水平 b OA大鼠软骨组织中MMP-9的表达水平 c OA大鼠软骨组织中MMP-13的表达水平
d OA大鼠软骨组织染色结果(番红固绿染色)
3 讨 论
关节软骨组织主要由软骨细胞和软骨细胞外基质(extracellular matrix,ECM)组成,在正常生理条件下,其处于一种稳态水平,供氧量极少[7-8]。然而,机体发生异常时能够产生许多有害因子,其能够激活机体氧化应激,引起ROS的过量产生[9]。大量ROS能够通过影响细胞内信号通路包括细胞因子受体、受体酪氨酸激酶及G蛋白耦联受体等引起ECM降解。除此之外,ROS也能够通过激活有丝分裂原激酶(mitogen-activated protein kinase,MAPK)信号转导通路[10]。最终,细胞内信号转导通路通过介导胶原酶活化的MMP引起ECM降解[11]。
IL-1作为第一个被鉴定的IL,其能够影响所用的细胞及器官,且是自身炎症、免疫及传染性和退行性疾病的主要影响因子[12]。IL-1β作为IL-1的亚型之一,是一种重要的促炎细胞因子,其能够通过Ⅰ型IL-1受体(IL-1R1)发挥效应,在OA的病理发展过程中起着至关重要的作用,研究表明IL-1R1受体拮抗剂可用于关节炎的治疗[13]。IL-1β信号通路能够通过加速ECM降解并诱导过量ROS产生以及前列腺素E2(prostaglandin E2,PGE2)和一氧化氮(nitric oxide,NO)的表达,进而促进OA的病理发展[14]。因此,本研究首先采用IL-1β诱导的软骨细胞模型探讨了NAC对软骨基质降解的作用及相关分子机制,本研究表明在软骨细胞中NAC能够抑制IL-1β引起的ROS产生、GPX及SOD活性,上述表明NAC能抑制细胞发生的氧化应激反应。研究表明ROS对于降解ECM相关的MMPs是至关重要的,ROS能够通过细胞内一系列信号转导通路引起MMP的表达,进而引起胶原酶的活化,导致ECM降解[11]。本研究表明在软骨细胞中NAC能够下调IL-1β诱导的MMP-3、MMP-9、MMP-13及ADAMTS 4的表达,同时抑制IL-1β诱导的ECM降解。上述表明NAC可能通过清除细胞内ROS抑制MMP的表达,进而产生抗ECM降解作用。
氧化应激引起的ECM降解在OA的病理发展过程中起着重要的作用,由于体外结果表明NAC能够通过抑制细胞氧化应激缓解ECM降解,这暗示着NAC具有潜在治疗骨关节炎作用[15],因此,接下来本研究采用骨关节炎大鼠模型评价了NAC的抗骨关节炎作用及其对ECM降解的影响。首先,根据之前的研究采用膝关节交叉韧带切断术建立骨关节炎大鼠模型用于后续的药物干预研究[16]。结果表明模型组大鼠的膝关节肿胀显著增大,同时PWT小于假手术组,这表明本研究成功建立了OA大鼠模型,为后面的实验干预研究提供了实验基础。同时,研究表明NAC呈剂量和时间依赖性增加OA大鼠的PWT,减小膝关节直径,上述说明NAC能够缓解OA大鼠的关节肿胀和疼痛,对OA具有一定的潜在疗效。同时,体内结果表明灌胃给予NAC能够显著下调软骨组织中MMP-3、MMP-9及MMP-13的表达,上述表明NAC对OA具有潜在的治疗效果,并且与可能与抑制MMPs表达有关。
总的来说,本研究结果表明NAC对OA具有潜在的治疗作用,且这种作用与抑制MMP介导的ECM降解有关。但是,NAC是否能够通过影响其他的信号转导通路产生抗骨关节炎效应依然是未知的,因此,仍需进一步探索。

