夹脊电针对脊髓损伤大鼠P2X7R/NLRP3信号通路相关蛋白的影响*
张雨墨,李晓宁,付 豪,教传旭,梁雪松
1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;3.深圳市宝安中医院(集团), 广东 深圳 518133
脊髓损伤(SCI)是中枢神经系统经由直接或间接暴力损伤之后,表现出局部出血、水肿、坏死或神经元损伤,进而使神经系统功能遭到不可逆转的破坏,由于发病急骤,致残率和致死率高,对患者的生活质量造成极大的影响及较重的经济和心理负担[1-4]。我国每100万人中有37人罹患该病,发病率呈现逐年增高的趋势[5]。SCI会导致永久性神经功能缺损并带来许多并发症,如严重的肌肉麻痹和下肢功能丧失等肢体运动障碍、感觉障碍、二便失禁、营养不良以及自主神经功能障碍甚至引发抑郁症等心理疾病[6-7]。还有外国学者认为SCI患者会并发轻度至中度睡眠呼吸障碍病[8]。脊髓损伤分为由外力、创伤所致的原发性损伤和由血管损伤、炎症反应和氧化应激引起的继发性损伤[9]。而后者导致脊髓组织发生反应性胶质性增生瘢痕和生成的坏死腔才是阻碍脊髓损伤后再生功能的首要原因[10]。目前研究最多的一种炎症小体是NLRP3炎症小体,作为小胶质细胞在中枢神经系统疾病中的重要调节因子,广泛分布在中枢神经系统。NLRP3炎症小体由NLRP3、ASC和Caspase-1组装而成[11-12]。NLRP3是NOD样受体家族的核心成员,同时也是NLRP3炎症小体的受体蛋白。P2X7R是一种细胞外ATP门控型离子通道,在神经系统中,P2X7R广泛分布于小胶质细胞、施旺细胞和星状细胞,参与神经递质释放、调节多个信号通路等许多细胞生理病理过程。当脊髓损伤发生时,脊髓组织产生大量的ATP作为内源性信号使P2X7R表达增高,NLPR3炎性小体活化,Caspase-1激活,催化pro-IL-1β、pro-IL-18蛋白形成并释放炎症因子,如IL-1和IL-18,从而进一步加重脊髓组织炎性损伤[13-15]。本课题组在前期研究中发现夹脊电针能通过抑制SCI大鼠NLRP3炎性小体的活化,以缓解脊髓损伤后的炎性损伤。本研究通过建立SCI大鼠模型,引入siRNA 干扰 P2X7的表达来探究脊髓损伤之后应用夹脊电针调控P2X7R/NLRP3信号通路相关蛋白表达的机制,通过BBB评分评估其运动功能,对比组内及组间各大鼠脊髓中的NLRP3蛋白、NLRP3 mRNA及NLRP3/OX42共表达的情况,拟为临床应用夹脊电针治疗SCI给出可信的研究数据。
1 实验材料
1.1 实验动物
本实验研究选用SPF级雌性SD大鼠120只[辽宁长生生物技术有限公司提供,许可证号:SCXK(辽)2015-0001],体质量(220±10)g。各组鼠于实验前在室温(23±2)℃、通风良好和相对湿度45%~70%环境下常规饲养1周,明暗光每12 h交替循环。实验期间严格遵照国际最新实验动物指南,给予大鼠充分关怀,合理对大鼠进行处置。
1.2 主要试剂与设备仪器
1.2.1 主要试剂 二甲苯(10023418,中国);无水乙醇(10009228,中国);苏木素-伊红试剂盒(WLA051a,中国Wanleibio);NLRP3 (Rb)(NBP2-12446,美国novusbio);HRP标记山羊抗兔IgG(# 31460,美国thermofisher);OX42 (Ms)(ab1211,英国abcam);BCA蛋白浓度测定试剂盒(WLA004,中国wanleibio);山羊血清SL038(中国Solarbio);Cy3标记山羊抗兔IgG(绿光)A5608(中国Beyotime);Cy3标记山羊抗兔IgG(红光)A0516(中国Beyotime);一抗二抗去除液(WLA007,中国wanleibio);DAPI(C1002,中国Beyotime);Western洗涤液(WLA025,中国wanleibio);Powder琼脂糖(111860,西班牙Biowest);多功能DNA纯化回收试剂盒(DP1721,北京BioTeke);质粒大量制备试剂盒(DP2802,北京BioTeke)。
1.2.2 主要设备仪器 KWD-808-Ⅱ型针灸治疗仪(英迪);H-2050R超速冷冻离心机(湖南长沙湘仪);RM2235石蜡切片机(德国Leica);BX53显微镜、DP73显微镜拍照系统(日本OLUMPUS);WD-9405B水平摇床、WD-9413B凝胶成像系统(北京六一);Proline微量移液器(苏州BIOHIT);Exicycler 96荧光定量PCR仪(韩国BIOER);NANO 2000紫外分光光度计(美国Thermo)。
2 实验方法
2.1 动物分组
将120只SD大鼠随机分为5组,即假手术组、模型组、夹脊电针组、P2X7R干扰组和干扰对照组,每组根据不同时间点分为1 d、3 d、7 d和21 d共4个亚组,每个亚组各6只。分组后采用染色法标记各鼠。选择BBB 评分为1~3分的大鼠入组。
2.2 动物处理方式
2.2.1 假手术组 切除相应的椎板暴露脊髓后不予撞击,随后即缝合伤口,常规饲养,同其他各组大鼠一同捆绑,不予其他处置。
2.2.2 模型组 模型制备成功后,正常捆绑,常规饲养,不予其他处置。
2.2.3 夹脊电针组 造模成功3 h待大鼠苏醒后,给予夹脊电针治疗。取T9、T11节段夹脊穴,受术部位用75%浓度酒精常规消毒后,用华佗牌0.35 mm×13 mm针灸针直刺4~5 mm至针尖触及椎扳。按照上正下负的原则,将电针治疗仪正负两端分别接在同侧两针针柄,计时器调至30 min,输出频率为100 Hz,输出电流调至1~2 mA以大鼠背部肌肉轻度颤动且大鼠不强烈挣扎为度。每次治疗时间为30 min,每日1次,至疗程结束为止。
2.2.4 P2X7R干扰组 造模成功后,用明胶海绵在大鼠脊髓伤口处按压并止血,直到手术区域没有明显的出血为止。然后使用10 μL微量注射器抽取8 μL滴度为107TU/mL P2X7R干扰慢病毒悬浮液,在损伤部位头部和尾部,距离损伤边缘2 mm,背部中央静脉两侧各1 mm处各取一个注射点,倾斜45°进针,进针深度约1.5 mm,各注射点分别注射2 μL病毒悬液,注射后针头停留3 min,最后缓慢退出针头。
2.2.5 干扰对照组 同上述方法注射阴性对照慢病毒。
2.3 造模方法
本实验采用改良Allen’s打击法制作SCI大鼠模型。术前12 h对大鼠禁食,正常喂水,准备好相关实验试剂及器具,随机选取SD大鼠,称重后按照3.5 mL/kg配比,腹腔注射10%水合氯醛麻醉。待大鼠完全麻醉后,用俯卧位将其固定,按肋骨顺序确定T10脊柱位置并以T10棘突为中心对背部皮肤局部脱毛,常规消毒皮肤,铺无菌手术巾,用手术刀以T10棘突为中心切开3 cm长的切口,逐层切开至触及椎板停止。随后用组织钳将皮肤、筋膜和肌肉逐层钝性剥离,露出T9-11棘突,用小手术剪将棘突切除,暴露椎板,接着用小咬骨钳咬掉椎板,避免损伤硬脑膜并完全暴露脊髓组织,至此准备阶段工作完成。然后将玻璃管垂直放置在硬脑膜上方,并使用消毒后的5 g砝码沿玻璃管自由下落,击中硬脊膜从而造成该节段脊髓损伤,用生理盐水仔细冲洗伤口后作缝合术。术后补液,腹腔注射5 mL生理盐水,每12 h协助大鼠排尿1次,维持1~2周,直至大鼠恢复反射性排尿。造模成功的标志是大鼠身体抖动,双下肢迅速回缩, 尾巴一过性痉挛,受损部位脊髓组织颜色加深出现瘀血[16-19]。最后当大鼠苏醒后,由3名实验人员对大鼠进行BBB评分,选取评分1~3分者纳入研究。评分内容如表1。

表1 大鼠BBB评分
2.4 观察指标与检测方法
2.4.1 大鼠行为学观察 BBB评分量表是目前对SCI大鼠行为学评分的量表之一,具有较强的客观性和有效性[20-21]。各组大鼠分别于模型建立后第1天、3天、7天和21天进行评分,观察大鼠的双后肢、髋、膝和足关节的运动情况,每次观察1 min,取2次评分的平均值作为BBB评分的结果。BBB评分标准如表2。

表2 BBB评分标准
2.4.2 NLRP3蛋白、NLRP3 mRNA及NLRP3/OX42共表达 各组于模型建立后分别在第1天、3天、7天和21天称重,给予10%水合氯醛(3.5 mL/kg)腹膜内麻醉。完全麻醉后将大鼠断头处死,在冰盒上迅速取出长约4 cm的损伤节段脊髓组织,放置于4%多聚甲醛缓冲液中固定,4℃恒温储存以备使用。用Western blot法检测NLRP3蛋白的表达,用Realtime-PCR检测各组大鼠脊髓组织NLRP3 mRNA的表达,用免疫荧光双染法观察NLRP3与OX42共定位表达。
2.5 统计学处理

3 实验结果
3.1 各组大鼠治疗前后BBB评分比较
假手术组各时间点评分均为满分21分,表示无后肢运动障碍。各时间点模型组大鼠BBB评分较假手术组显著降低,差异有统计学意义(P<0.05);术后3 d、7 d和21 d夹脊电针组大鼠BBB评分较模型组大鼠升高,差异有统计学意义(P<0.05),见表3;随着时间推移,假手术组分数维持不变,夹脊电针组与模型组大鼠BBB评分随时间呈上升趋势,且夹脊电针组上升幅度高于模型组,说明夹脊电针能显著改善其运动功能,疗效随疗程推进越发明显。
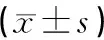
表3 各组大鼠治疗前后BBB评分
3.2 各组Western blot检测NLRP3蛋白表达
假手术组NLRP3蛋白表达在所有时间点均维持在较小且稳定的低水平。在术后3 d、7 d和21 d时,模型组NLRP3蛋白表达较假手术组升高显著,差异有统计学意义(P<0.05);夹脊电针组、P2X7R干扰组NLRP3蛋白表达均明显低于模型组,差异有统计学意义(P<0.05);干扰对照组NLRP3蛋白较P2X7R干扰组表达量高,差异有统计学意义(P<0.05)。随疗程推进,模型组大鼠脊髓组织NLRP3蛋白表达在1 d、3 d和7 d呈上升趋势,7 d时达到峰值,21 d出现下降趋势;夹脊电针组NLRP3在1 d、3 d和7 d表达增加,21 d出现下降趋势,但各时间点表达量均低于模型组。见表4。
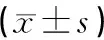
表4 各组大鼠脊髓组织NLRP3相对表达量变化
3.3 各组Realtime-PCR检测NLRP3 mRNA表达
各时间点模型组NLRP3 mRNA较假手术组均升高显著(P<0.05);夹脊电针治疗后在3 d、7 d和21 d时NLRP3 mRNA表达水平明显低于模型组(P<0.05);在3 d、7 d和21 d时,P2X7R干扰组NLRP3 mRNA表达水平低于干扰对照组和模型组(P<0.05)。见表5。
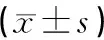
表5 各组大鼠脊髓组织NLRP3mRNA表达水平变化
3.4 免疫荧光双染法检测NLRP3与OX42共定位情况
NLRP3和OX42与免疫荧光共定位:于荧光显微镜下可见红色荧光(NLRP3阳性)、绿色荧光(OX42阳性)、蓝色荧光(细胞核)及橙色(NLRP3阳性和OX42阳性双染)。模型组NLRP3与OX42共定位阳性在各时间点表达均明显多于假手术组,在3 d、7 d和21 d时显著多于夹脊电针组和P2X7R干扰组。见图1~4。
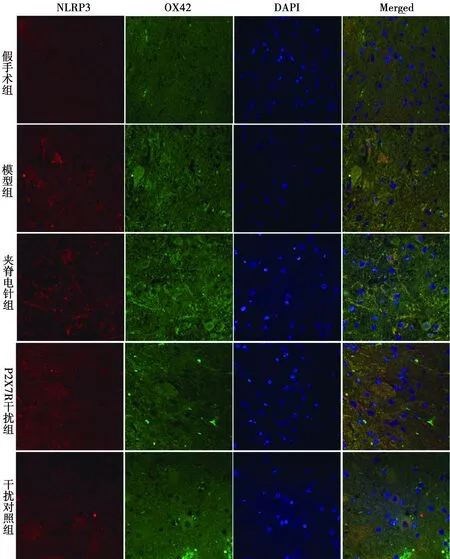
图1 各组免疫荧光双染图(1 d)
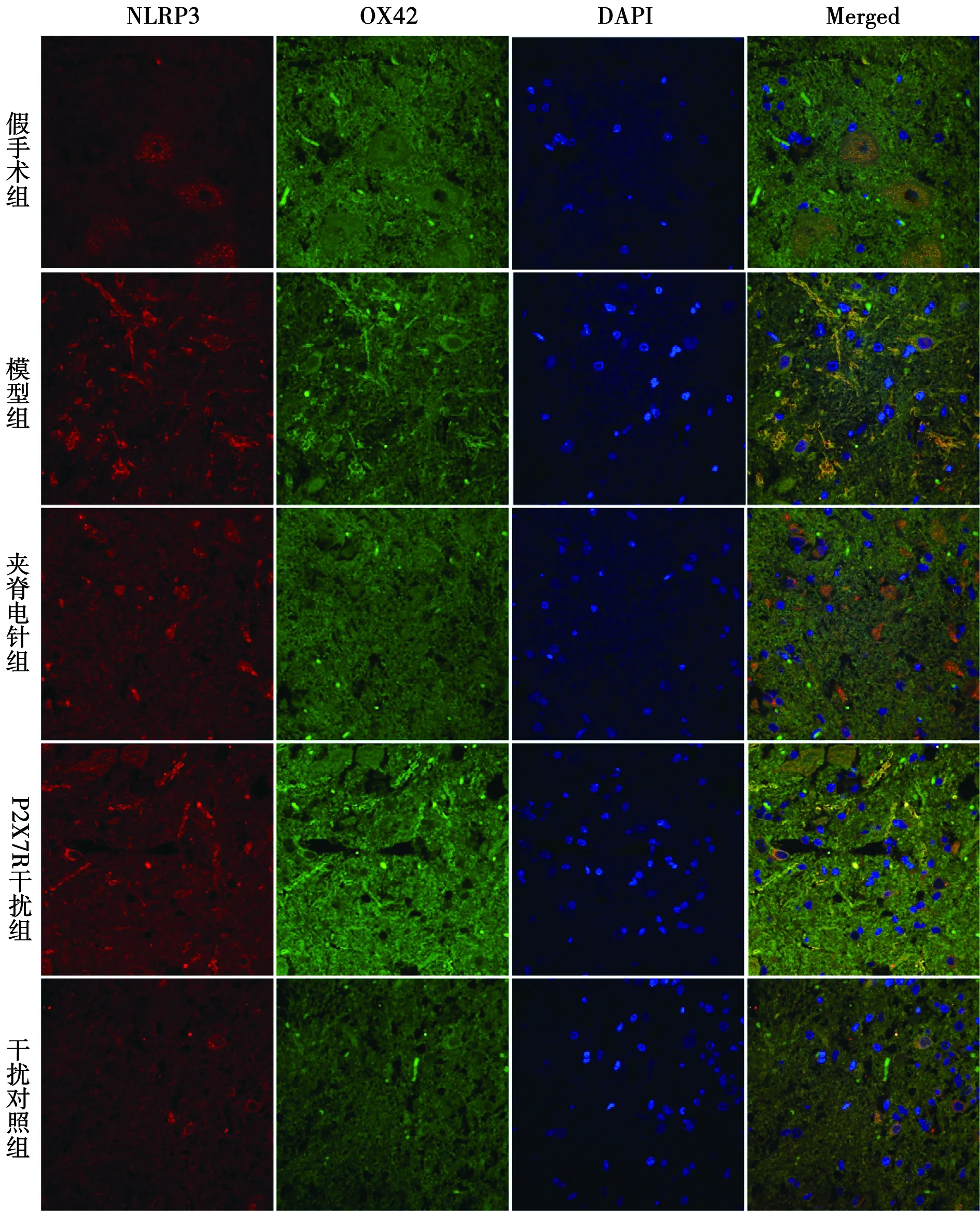
图2 各组免疫荧光双染图(3 d)
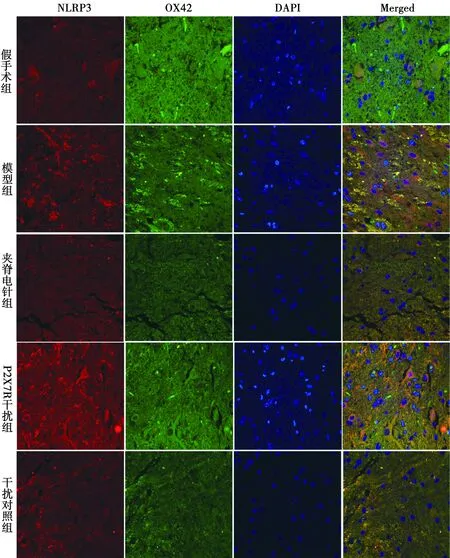
图3 各组免疫荧光双染图(7 d)
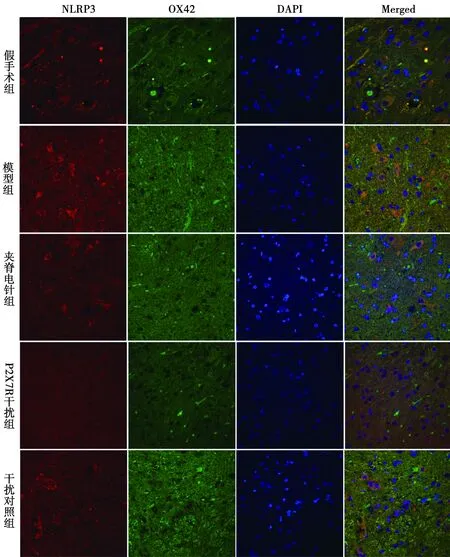
图4 各组免疫荧光双染图(21 d)
4 讨论
脊髓损伤在中医上无与之完全对应的病名,结合临床表现可将其归属为“痿证”范畴,病机多为督脉受损之后,气血瘀滞发而痿痹。《灵枢·本输》云:“痿厥者,张而刺之,可令立快也。”华佗夹脊穴位于督脉之旁,针刺时针尖略向脊椎倾斜进针,针尖附近有脊神经后支分布,针刺该区域可以调节神经根兴奋性,配合电针以改善局部血液循环及促进神经功能恢复。
脊髓损伤后,继发的组织水肿、细胞凋亡及一系列炎症风暴造成的链式反应形成的抑制性微环境会限制神经元新生,这是影响神经再生的一个障碍[22]。而炎性小体在炎症风暴的进程中扮演着十分重要的角色,其中NLPRP3炎性小体作为不可或缺的一员,广泛存在于中枢神经系统的小胶质细胞中,小胶质细胞对神经发育至关重要,脊髓损伤后的炎症风暴主要依靠活化的小胶质细胞介导,OX42是小胶质细胞的特异性标志物,依靠免疫荧光双染技术将NLRP3蛋白和OX42标记,可以通过激光共聚焦扫描显微镜观察NLRP3蛋白在小胶质细胞的作用,即NLRP3与OX42共定位的情况。胞外的ATP可以激活P2X7受体(P2X7R),从而使NLRP3炎性小体活化[23],导致P2X7R调节炎症介质的产生和释放,如IL-1β、肿瘤坏死因子α和前列腺素E2[24],继而放大局部炎性损伤,对组织造成难以逆转的损害。同时本实验利用慢病毒感染能力强、整合能力强、免疫反应小和载体容量大的特点,将其引入从而干扰P2X7R/NLRP3通路相关蛋白的表达及释放。
本实验结果说明了脊髓损伤后微环境和脊髓组织小胶质细胞中NLRP3蛋白表达会升高,夹脊电针和P2X7R siRNA干扰病毒均可抑制NLRP3蛋白的表达及干扰P2X7R的激活,以抑制NLRP3 mRNA的表达,减轻由NLRP3介导的炎症反应,从而改善SCI大鼠脊髓组织炎性损伤。所以笔者认为夹脊电针具有和慢病毒siRNA相似的作用,可以调控P2X7R/NLRP3通路相关蛋白在微环境及小胶质细胞的表达。
综上所述,夹脊电针能通过调控P2X7R/NLRP3通路降低SCI大鼠脊髓组织NLRP3蛋白、NLRP3 mRNA以及NLRP3与OX42共定位的表达水平,减轻脊髓损伤大鼠炎症反应,改善脊髓损伤大鼠运功功能。

