长叶红砂RtVAMP2-2 基因克隆及功能验证
张 健,王彩霞,王迎春,郑琳琳
(内蒙古大学生命科学学院, 内蒙古 呼和浩特 010000)
长叶红砂(Reaumuria trigyna)又被称为黄花红砂或黄花琵琶柴,柽柳科(Tamarieaceae)琵琶柴属(Reaumuria),是一种强旱生泌盐小灌木,主要分布于东阿拉善—西鄂尔多斯地区,是内蒙古自治区和国家重点保护植物之一[1]。由于其生境具有干旱、高盐和低温等特点,在长期的自然选择下,长叶红砂进化出了一种泌盐结构—盐腺,该结构在长叶红砂适应盐渍环境中发挥至关重要的功能[2]。此外,该植物还具有一定的药用价值,其枝、叶及果实均可入药,用于治疗湿疹和皮炎等[3]。近年来,已先后对长叶红砂的形态结构、耐盐机制、转录组数据等进行了颇为深入的研究,为开发利用这种珍贵的植物资源提供了科学依据[4-6]。
在植物中,定向膜泡运输是维持细胞稳态、极性、生长和发育的基础[7],该过程涉及可溶性N-乙基马来酰胺敏感因子连接复合体(soluble N-ethylmaleimide-sensitive factor protein attachment protein receptor, SNARE)的参与,它通过在水环境中将囊泡和目标膜表面结合在一起来介导双层融合[8]。有研究表明,膜泡结合膜蛋白(vesicle-associated membrane protein, VAMP)可能参与了含盐囊泡的排出过程,该蛋白属于R-SNAREs,在植物中以蛋白家族形式存在,如拟南芥(Arabidopsis thaliana)基因组中含有14个VAMP家族成员[9]。VAMPs 在植物物质运输、生长发育及抵抗生物和非生物胁迫方面均发挥着重要作用[10-13]。AtSYP121、AtVAMP721/722 和AtSNAP33能够组成三元复合体,在拟南芥免疫应答过程执行重要功能,AtVAMP721/722的缺失将削弱拟南芥对剧毒卵菌以及宿主特异性和非特异性霉菌感染的防御能力[14];Sugano 等[15]研究证实,定位于叶绿体和液泡膜上的OsVAMP714的过量表达可以增强水稻(Oryza sativa)对稻瘟病的抗性,同时促进叶鞘伸长;Ebine 等[16]报道了一种植物特有的R-SNARE 蛋白,将其命名为VAMP727,主要用于介导由胞内体向细胞质膜方向的运输,该蛋白在拟南芥响应盐胁迫过程中发挥重要作用。
本研究基于长叶红砂耐盐转录组数据分析[6],结合RT-qPCR 结果发现,RtVAMP2-2基因(Genbank登录号MZ852768)在盐胁迫诱导下表达量显著升高(P< 0.05),表明RtVAMP2-2基因可能在长叶红砂应对盐胁迫中发挥一定的功能。因此,本研究克隆获得膜泡运输相关基因RtVAMP2-2,对其进行生物信息学、亚细胞定位和表达特性进行分析,并将该基因转入拟南芥中进行进一步的功能鉴定,以期为长叶红砂盐腺泌盐机理的阐明和开发该植物优异抗逆基因资源提供科学依据。
1 材料与方法
1.1 植物材料、菌株和载体
长叶红砂种子于2017 年10 月采摘自内蒙古乌海市郊,野生型拟南芥 (Columbia-0)、本式烟草(Nicotiana tabacum)为牧草与特色作物生物技术教育部重点实验室保存;Trans-T1 感受态细胞(全式金)、pMD19-T (TaKaRa);农 杆 菌GV3101、pPZP221表达载体、pCAMBIA-1300 亚细胞表达载体也为牧草与特色作物生物技术教育部重点实验室保存。
1.2 引物设计
RtVAMP2-2基因的序列筛选自前期已经获得的长叶红砂耐盐转录组数据,序列的总长度为1 960 bp。使用在线工具ORF Finder,发现RtVAMP2-2基因的ORF 为1 074 bp。利用Primer 5.0 软件,针对不同的用途,分别设计了不同的引物:设计一对引物用于RtVAMP2-2基因的克隆,分别在上下游引物5′末端插入了BamH I 和KpnI 酶切位点;设计一对引物用于RtVAMP2-2基因亚细胞定位分析,去掉终止密码子,分别在上下游引物 5′末端插入了KpnI 和XbaⅠ酶切位点;设计一对引物用于RtVAMP2-2基因的RT-qPCR;设计一对引物用于内参基因RtActin的RT-qPCR (表1)。

表1 植物表达载体的构建及RT-qPCR 所需的引物序列Table 1 Primers sequences used in plant vector construction and RT-qPCR
1.3 RtVAMP2-2 基因的克隆
长叶红砂总RNA 按照Eastep Super 说明书(Promega)提取;按照反转录试剂盒PrimeScriptTMII 1st strand cDNA synthesis kit (TaKaRa)的 说 明 书 以RNA 为模板合成cDNA 第一链,再通过oligo (dT)合成cDNA 第二链。以cDNA 为模板,使用上述用于pMD19T-RtVAMP2-2 载体构建的引物,用Trans start Taq 酶(全式金)扩增RtVAMP2-2基因编码序列。PCR结束后产物回收,与pMD19-T 载体连接,将连接的产物转化至感受态细胞Trans-T1 中。之后将菌落PCR 验证呈阳性的菌株送至北京生工生物公司测序。
1.4 RtVAMP2-2 基因生物信息学分析
利用DANMAN 6.0 软件分析蛋白的理论分子量和等电点;利用NCBI 网站识别ORF 并翻译出氨基酸序列;利用在线工具Pfam 分析功能结构域;利用DANMAN 6.0 软件进行氨基酸序列的比对。
1.5 RtVAMP2-2 基因的亚细胞定位分析
使用上述构建亚细胞定位载体的引物,PCR 扩增去掉终止密码子的ORF,连接到pMD19-T 载体中,转入大肠杆菌进行克隆。按照质粒提取试剂盒EasyPure Plasmid MiniPrep Kit (全式金)的说明书提取重组质粒与亚细胞定位载体pCAMBIA-1 300 一起进行双酶切,将酶切产物用T4 DNA 连接酶(SIGMA)连接得到亚细胞定位重组载体,电转到农杆菌中,之后用无针头注射器注射到烟草中,待3~5 d 后利用激光扫描共聚焦显微镜进行观察。
1.6 RtVAMP2-2 基因的表达特性分析
将长叶红砂种子剪去绒毛,放入10% NaCl 溶液中,浸泡过夜,再用10% NaClO 浸泡10~15 min,期间不断用玻璃棒搅拌,放到超净台用灭菌水反复冲洗3~5 次,播种于固体MS 培养基中,暗培养2~3 d后,置于温度25 ℃、湿度70%、16 h/8 h (光照/黑暗)的人工气候室中培养20~30 d,选择长势较好的幼苗移入装有Hoagland 营养液的无菌大试管中,以相同的条件再培养15~20 d,选择生长到10 cm 左右的长叶红砂幼苗,进行盐胁迫。将不同浓度(100、200、300、400、500 mmol·L-1)的NaCl 加入到Hoagland 营养液中处理6 h,不加NaCl 为对照组,其余浓度(Hoagland + NaCl)为 试 验 组;使 用300 mmol·L-1NaCl 进行不同时间(3、6、12、24 h)的处理,NaCl 处理时间0 时即对照组,其余处理时间为试验组,收获叶片用液氮处理,-80 ℃保存备用。提取处理后的长叶红砂叶片RNA,反转录成cDNA,使用上述用于RT-qPCR 的引物,按照TransStart Tip Green qPCR SuperMix 试剂盒说明书(全式金),进行RTqPCR。不同处理各3 个重复。
1.7 拟南芥的遗传转化及转RtVAMP2-2 基因植株的筛选和鉴定
利用上述带KpnⅠ和BamH Ⅰ酶切位点的引物扩增RtVAMP2-2的ORF,将扩增产物同pPZP221 载体连接,将连接的产物转化大肠杆菌,之后进行蓝白斑筛选,将白色菌落提取质粒进行PCR 和双酶切验证,并将验证结果正确的菌株送至北京生工生物公司测序。利用电转法将构建成功的表达载体转化到农杆菌中,再通过花序浸染法侵染拟南芥,在Gent 抗性培养基中筛选至T3 代纯合体植株。通过基因组PCR、RT-qPCR 等技术对转基因拟南芥进行鉴定,最终筛选出3 个转基因株系。
1.8 转RtVAMP2-2 基因拟南芥的耐盐性分析
将野生型(Columbia-0)和3 个转基因株系拟南芥种子播种到1/2 MS 固体培养基中进行培养,待生长至7 d 后,将幼苗分别移到含有0、75、100 mmol·L-1NaCl 的胁迫培养基中,继续生长7 d 后测量根长,14 d 后测量鲜重和叶绿素含量。按照DAB 和BCIP/NBT 显色试剂盒说明书(Coolaber 北京)进行操作,对转基因拟南芥叶片进行DAB 和NBT染色。
2 结果
2.1 RtVAMP2-2 基因的克隆
在转录组数据中找到一段注释为VAMP的基因序列,根据该序列设计引物,通过PCR 扩增克隆获得基因编码序列 (coding sequences, CDS) 1 074 bp(图1A)。将该CDS 序列连接pMD19-T 载体,转化到大肠杆菌中,菌液PCR 验证与预期大小一致(图1B)。经氨基酸序列比对,结果显示其与NCBI 数据库中多种植物VAMP2-2基因具有高度的同源性,因此命名为RtVAMP2-2。
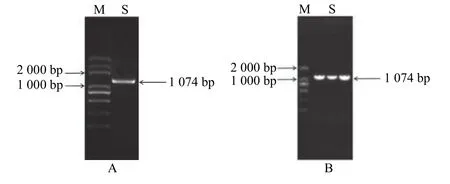
图1 PCR 扩增RtVAMP2-2 基因的ORFFigure 1 Amplification of the ORF of RtVAMP2-2 gene by PCR
2.2 RtVAMP2-2 基因的生物信息学分析
通过在线工具ORF Finder 分析发现,VAMP2-2基因的开放阅读框(open reading frame, ORF)为1 074 bp,编码氨基酸的数量为357。利用NCBI blast对VAMP2-2 氨基酸序列进行同源比对,发现VAMP2-2 蛋白与葡萄(Vitis riparia, XP_034706841.1)的相似度最高,为51%;与番木瓜(Carica papaya, XP_021891213.1)的相似度为50%;与陆地棉(Gossypiumhirsutum, XP_016672432.1)的相似度为50%;与菠菜(Spinacia oleracea, XP_021835062.1)的相似度为49%;与茶树(Camellia sinensis, XP_028098258.1)的相似度为49%。利用在线工具Pfam 分析发现,VAMP2-2的N 端有主要精子蛋白(major sperm protein, MSP)结构域,此结构域是VAMP 蛋白家族的保守结构域,在动物体中参与精子的运动[17]。用DNAMAN软件比对上述不同植物VAMP 蛋白的氨基酸序列,比对结果如图2 所示,划线处为MSP 结构域。

图2 VAMPs 的氨基酸序列比对Figure 2 Amino acid sequence alignment of VAMPs
2.3 RtVAMP2-2 基因的亚细胞定位分析
为进一步了解RtVAMP2-2基因的功能,本研究分析了该基因的亚细胞定位情况。通过农杆菌转化法,在烟草表皮细胞中,瞬时表达CaMV35S 启动子驱动的RtVAMP2-2-GFP 融合蛋白。以pCAMBIA-1300载体作为阴性对照,以质膜定位的拟南芥PM-mCherry蛋白作为阳性对照。利用激光扫描共聚焦显微镜观察,发现阴性对照中绿色荧光分布于整个细胞中(图3A),而PM-mCherry 蛋白的红色荧光与RtVAMP2-2蛋白的绿色荧光于细胞质膜上完全重合(图3 B—D),说明RtVAMP2-2 蛋白定位于细胞质膜。
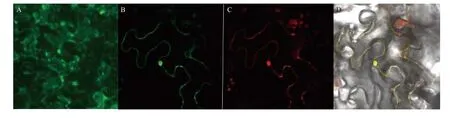
图3 RtVAMP2-2 蛋白的亚细胞定位Figure 3 Subcellular localization of RtVAMP2-2
2.4 RtVAMP2-2 基因的表达特性分析
采用RT-qPCR 技术分析RtVAMP2-2基因在不同组织的表达特性。结果显示,该基因的表达量茎 >根 > 叶(图4)。
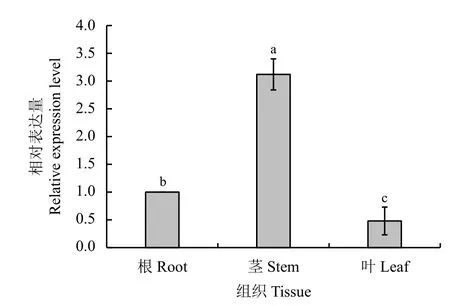
图4 长叶红砂不同组织中RtVAMP2-2 基因相对表达量Figure 4 The relative expression of RtVAMP2-2 gene in different tissues of Reaumuria trigyna
为了分析RtVAMP2-2基因在盐胁迫下的表达特性,本研究检测了RtVAMP2-2基因在盐胁迫下的表达量。结果显示,除200 mmol·L-1NaCl 处理外,其余浓度NaCl 处理下,RtVAMP2-2基因的表达量与对照组相比均显著增加(P< 0.05),在100 mmol·L-1NaCl 时,该基因的表达量最高,达到了对照组的2.76 倍 (图5A);之后分别利用300 mmol·L-1NaCl 进行不同时间梯度的胁迫,发现在300 mmol·L-1NaCl的处理下,基因的表达量随处理时间的增加呈现平缓上升的趋势,12 h 时达到顶峰 (图5B)。上述结果说明,RtVAMP2-2基因可以被盐胁迫所诱导。
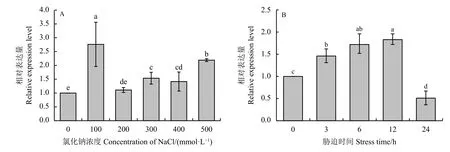
图5 长叶红砂在NaCl 处理下RtVAMP2-2 基因的表达水平Figure 5 Expression level of RtVAMP2-2 gene under NaCl stress in Reaumuria trigyna
2.5 RtVAMP2-2 转基因拟南芥的筛选
利用电转法将真核表达载体转化到农杆菌中,再通过花序浸染法侵染拟南芥,在Gent 抗性培养基中筛选获得了T1 代转基因拟南芥(图6A),收种子后再用相同的方式筛选,获得纯合体T3 代植株(图6B)。提取DNA 进行PCR 扩增,发现转基因拟南芥OE1、OE3、OE5 均可扩增出RtVAMP2-2基因的特异性片段,而野生型无条带(图6C);将3 个转基因株系提取RNA 进行RT-qPCR 检测, 3 个转基因株系中均扩增出特异性条带(图6D),上述结果显示目的基因己成功转入拟南芥基因组中并进行稳定表达。
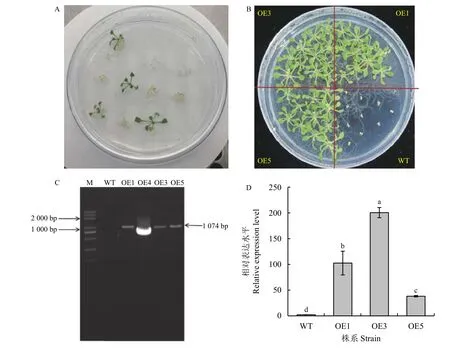
图6 RtVAMP2-2 转基因拟南芥的筛选与鉴定Figure 6 Screening and identification of RtVAMP2-2 transgenic Arabidopsis
2.6 盐胁迫条件下RtVAMP2-2 转基因拟南芥的耐受性分析
为了分析RtVAMP2-2基因在植物应对盐胁迫中发挥的作用,本研究对比了野生型拟南芥和转基因株系的生长表型,并对根长、鲜重、叶绿素含量进行了测定。结果显示,在对照组中,野生型和转基因拟南芥长势良好,并无明显差异,但在不同浓度的盐胁迫下,野生型和转基因拟南芥的根长、鲜重、叶绿素含量均下降,且随着NaCl 浓度的增加,生长受到抑制的程度愈发严重(图7),但野生型的生长状况和相关指标一直优于转基因植株,反映出转基因植株具有盐敏感性。
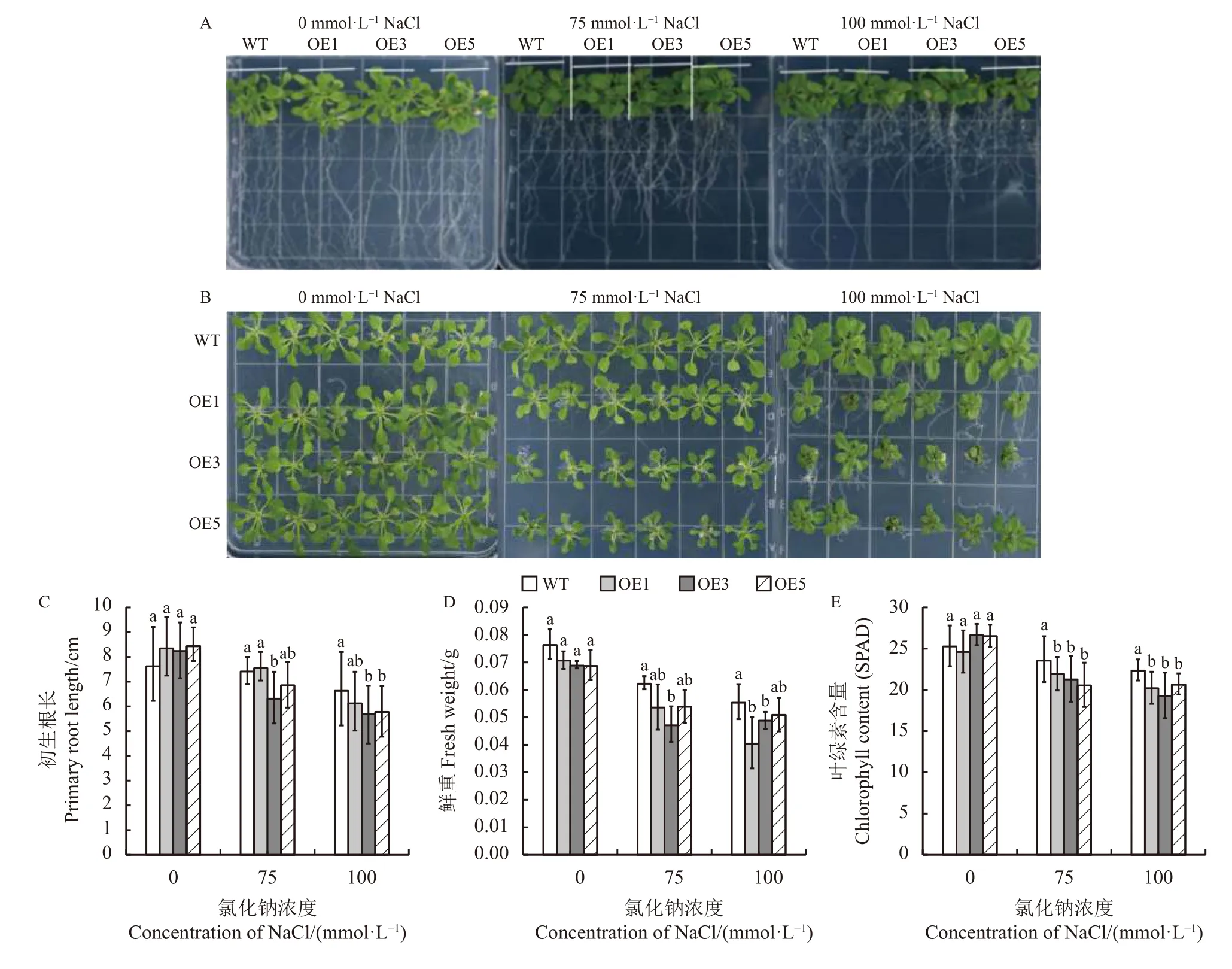
图7 不同浓度的NaCl 对转RtVAMP2-2 基因拟南芥生长的影响Figure 7 Effects of different concentrations of NaCl on the growth of transgenic Arabidopsis
对野生型和转基因拟南芥幼苗的叶片进行DAB 和NBT 染色。结果如图8 所示,胁迫处理后转基因植株叶片中积累了更多的蓝色和褐色沉淀物,说明在盐胁迫下,与野生型相比,转基因株系积累了更多的ROS,氧化损伤程度更高。
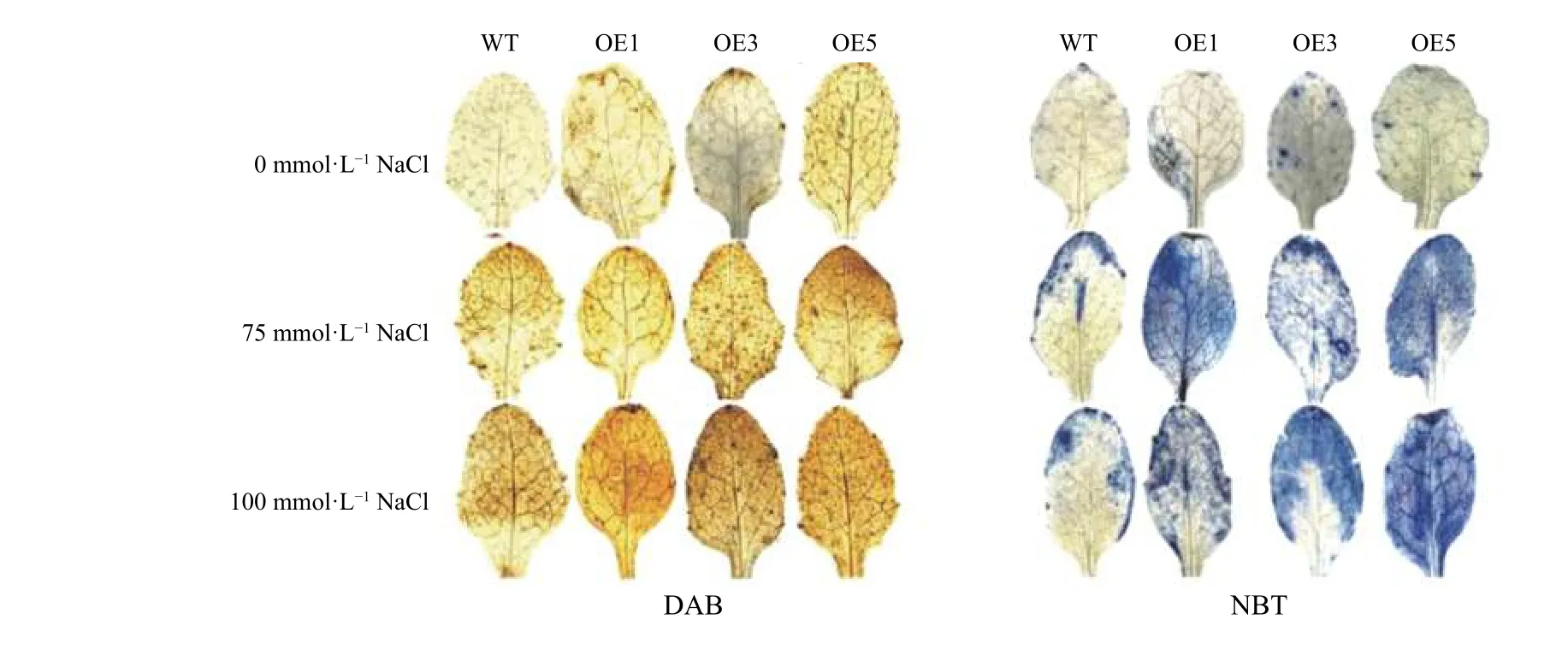
图8 不同浓度盐胁迫下叶片的DAB 和NBT 染色Figure 8 DAB and NBT staining of leaves under salt stress
3 讨论与结论
VAMP作为膜泡运输相关基因,已经在动物和模式植物拟南芥中进行了广泛研究,但是在泌盐盐生植物中却鲜有报道。事实上,膜泡运输已被证实在盐腺泌盐中发挥着关键作用[18],因此在泌盐盐生植物中研究该基因,具有重要价值。本研究克隆获得长叶红砂RtVAMP2-2基因,并对其进行了生物信息学、亚细胞定位和表达特性分析,发现NaCl 能诱导RtVAMP2-2基因的表达,说明RtVAMP2-2基因可能在植物应对盐胁迫中发挥作用,但具体发挥何种调控作用,需要通过转基因或基因沉默等试验进一步加以阐释。
研究表明,VAMP 蛋白家族在植物应对盐胁迫中发挥重要作用,但不同的成员对植物耐盐性的影响大不相同。一些VAMP 蛋白对植物的耐盐性具有积极作用,如Josselyn 等[19]利用微阵列和RT-qPCR技术发现番茄(Solanum lycopersicum)的SlVAMP727等SNARE基因与盐胁迫呈正相关关系,暗示该基因在植物盐胁迫应答中发挥重要作用。而另外一些VAMP 蛋白则对植物的耐盐性具有消极作用,如Leshem 等[20]通过反义或突变AtVAMP711基因来抑制AtVAMP7C基因的表达,发现含H2O2的囊泡与液泡膜的融合受到抑制,使细胞质中保留许多含H2O2的大囊泡,使得突变植株的液泡免受活性氧的损伤,能够发挥良好的功能,从而提高了植物的耐盐性,推测该基因对植物的耐盐性具有消极作用;Sun 等[21]通过研究发现,高盐度能够诱导野生大豆GsVAMP72基因的表达,表明GsVAMP72可能参与植物应对盐胁迫的响应,之后将GsVAMP72基因导入拟南芥中,发现该基因的过量表达通过下调COR47、CORA15A、KRN1、RAB18和RD29A等应激反应基因的表达和改变细胞离子含量的方式,显著降低了植物对盐的耐受性。本研究中得到了与Sun 类似的结果,将RtVAMP2-2基因转入拟南芥中,发现盐胁迫下转基因拟南芥的生理指标比野生型更低,并且在叶片中积累了更多的活性氧,说明异源表达RtVAMP2-2基因可以通过抑制转基因拟南芥根的生长,削弱光合作用效率,减少生物量积累,增加氧化损伤程度,从而导致转基因植株对盐的敏感性提高。
事实上,本研究发现的盐胁迫下基因表达量上调,而转基因拟南芥却对盐敏感的现象并不少见。例如曹扬荣等[22]发现烟草的NtRop1基因的表达水平受到NaCl 的诱导,将该基因转到拟南芥中,发现转基因拟南芥对NaCl 的敏感性有所增加;王燕[23]将盐胁迫下表达量显著增加的唐古特白刺(Nitraria tangutorum)NtAOC基因转入到拟南芥中,发现该基因增加了拟南芥对盐的敏感性。推测原因可能是RtVAMP2-2基因在不同植物应对非生物胁迫中所发挥的调控作用有所不同,特别是在盐生植物和甜土植物存在较大差异,后续将进一步通过转化盐生植物二色补血草(Limonium bicolor)进行对比分析。
综上,RtVAMP2-2基因在长叶红砂应对盐胁迫中发挥作用,转RtVAMP2-2基因拟南芥对盐敏感,推测RtVAMP2-2基因在植物耐盐中发挥负调控作用。未来沉默或敲除植物中RtVAMP2-2的同源基因从而抑制其表达,可能是一种提高植物耐盐性的有效手段。

