血清miR-181b与冠状动脉狭窄程度的相关性分析
刘玉芝,任玉华,王雪,张少阳
(聊城市人民医院心内科,山东 聊城 252000)
冠状动脉粥样硬化性心脏病是冠状动脉血管发生动脉粥样硬化病变而引起血管狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏病。我国冠心病(CHD)的发病率呈逐年升高的趋势,严重威胁人们的生活质量和健康,其主要的发病原因为各种危险因素对动脉内皮的损伤和脂质在动脉内膜层的积聚,导致动脉壁的慢性炎症,逐渐形成粥样斑块。在动脉粥样硬化(AS)中,异常的脂质位于血管壁内膜下,介导形成泡沫细胞,进而导致血管内皮功能障碍和炎症反应[1]。在此过程中,免疫细胞、淋巴细胞和树突状细胞被激活,一些细胞因子被释放,进一步增加炎症反应。随后,巨噬细胞、血小板和平滑肌细胞被激活,从而显著增加炎性物质,加重斑块的不稳定性和破裂,进而加重疾病的发展程度[2]。
近年来,基因调控因子微核糖核酸(miRNA)、AS 及心血管疾病相关性研究增多。如miR-208a、miR-133a 参与心肌肥厚,miR-155在冠心病患者血浆中显著下降,miR-143/145通过改变细胞结构,增强血管平滑肌细胞的增殖,miR-2 也参与血管平滑肌细胞增殖和血管新生内膜病变的形成,micoRNA-195 参与心脏重塑的病理过程。Yao 等[3]研究发现miR-181 家族可能参与动脉粥样硬化的调控。其中miR-181b 是 miR-181 家族在心血管细胞中的主要表达亚型[4]。本研究旨在分析miR-181b与冠状动脉狭窄程度之间的相关性,为进一步发现miRNA在冠状动脉斑块形成和心血管治疗中的作用提供新的依据,现报道如下。
1 资料与方法
1.1 临床资料 选取2019 年1 月至2019 年12 月本院心内科收治的冠状动脉粥样硬化性心脏病患者180 例为研究对象,根据Gensini 积分(见表1)分为≤25 分组(n=71)、26~50分组(n=53)、>50分组(n=56),选取同期行冠状动脉造影结果正常的35名作为对照组,所有研究对象年龄38~78岁,平均(60.82±8.24)岁。本研究经本院伦理委员会审核批准,患者知情同意并签署知情同意书。

表1 Gensini积分Table 1 Gensini score
纳入标准:年龄<85 岁者;2 个月内无手术、外伤、感染性疾病者;无肝脏疾病、肾功能衰竭者;无恶性肿瘤者;无结缔组织病或自身免疫性疾病者;非急性出血,输血期者;无甲状腺功能异常者;非接受放疗、化疗者;非脑梗病史或其他血栓病史者。排除标准:临床资料不完整者;中途退出者;拒绝参与本研究者。
1.2 方法
1.2.1 临床一般指标检测 所有研究对象入院后第2天清晨空腹采集超敏CRP(hs-CRP)、Cr、BUN、TC、TG、HDL-C、LDL-C等血标本进行化验。
1.2.2 血清miR-181b相对表达量检测 采用实时荧光定量PCR法(qRT-PCR)测定血清miR-181b相对表达水平。具体方法为:提取血清1份,并检测总RNA纯度比值,范围为1.6~2.0。按Takara反转录试剂盒说明书反转录为cDNA。将反转录cDNA 进行PCR 扩增,扩增条件为 95 ℃ 30 s,60 ℃ 60 s,循环45次。采用2-△△Ct法计算miR-181b mRNA的相对表达量。
1.3 观察指标 分析血清miR-181b 与冠状动脉狭窄程度的相关性 分别测定4组血清miR-181b水平,比较其与冠状动脉狭窄程度的相关性。
1.4 统计学方法 采用SPSS 23.0统计软件进行数据分析,所有统计指标均进行正态检验和方差齐性检验,服从正态分布的计量资料采用“”表示,采用单因素方差分析;不服从正态分布的计量资料采用秩和检验;计数资料以[n(%)]表示,采用χ2检验;采用直线回归相关分析血清miR-181b水平与临床及病理指标的关系,以P<O.05为差异有统计学意义。
2 结果
2.1 4组血清miR-181b相对表达水平及临床资料比较 对照组miR-181b水平高于≤25分组、26~50分组及>50分组,差异有统计学意义(P<0.05);≤25分组、26~50分组及>50分组比较差异有统计学意义(P<0.05);≤25分组与26~50分组比较差异无统计学意义。≤25分组、26~50分组、>50分组hs-CRP 水平均高于对照组(P<0.05);>50 分组高于≤25 分组、26~50分组(P<0.05);≤25分组与26~50分组比较差异无统计学意义;其他指标比较差异无统计学意义,见表2。
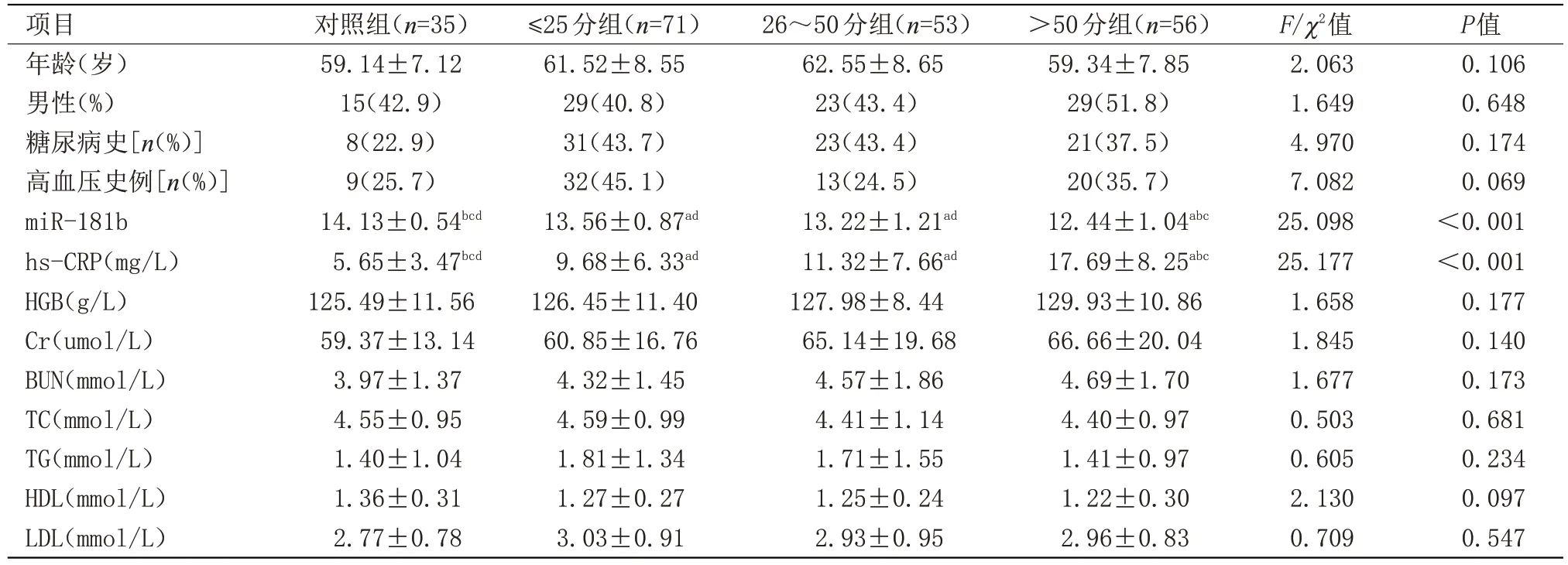
表2 4组miR-181相对表达水平及临床资料比较Table 2 Comparison of relative expression levels and clinical data of miR-181b among the four groups
2.2 血清miR-181b 相对表达水平与hs-CRP 直线相关分析血清miR-181b相对表达水平与hs-CRP呈负相关(r=-0.767,P<0.001),见图1。

图1 血清miR-181b与hs-CRP直线相关分析Figure 1 Linear correlation analysis of serum miR-181b and hs-CRP
3 讨论
miR-181b 属于 miR-181 家族 ,miR-181 是典型的具有内含子性质的非编码RNA 分子家族,其中包括4 个成熟的miRs:miR-181a,miR181b,miR181c,miR181d,由位于3 条不同的染色体上的6个主miRs序列编码构成,靶基因主要参与细胞修复、炎性反应、调控细胞增生等生物学过程[5-7]。有研究表明,miR-181b 是miR181 家族在心血管细胞中的主要表达亚型,miR-181b能负调控促炎分子的表达,从而保护血管炎症[4]。
冠状动脉粥样硬化性心脏病(CHD)是血脂异常、血管内皮炎性反应等多种病理因素造成的冠状动脉管腔狭窄而引发的疾病。急性冠脉事件多由斑块破裂和血栓形成引起,据病理学研究显示,血小板反应介导的急性事件的发展主要取决于斑块的组成和脆弱程度[8]。动脉粥样硬化(AS)是一种动脉管壁的慢性进展性炎性反应,异常的脂质代谢引发动脉管壁上脂质沉积和炎性反应,可形成粥样斑块及血管损伤,导致AS的发生[9]。
研究表明,miRNA 在血管和炎性疾病(包括中风和斑块破裂)的发病机制中发挥重要作用,miR-181 家族在心血管炎症、动脉粥样硬化斑块形成和急性卒中事件中起关键作用[9-11]。Deng B[12]发现,在局灶性缺血性脑卒中大鼠中,miR-181b 的表达随缺血程度的增加而下降,miR-181b 表达的增加可降低总动脉负荷。Sun 等[9]研究表明,miR-181b 可通过调控炎性相关因子的表达,阻碍炎性细胞的聚集和动脉粥样斑块形成。以往研究发现[13-14],在易损斑块中存在大量的巨噬细胞,这些巨噬细胞对于斑块的破裂非常重要。miR-181b 可通过调节巨噬细胞极化来减少斑块面积、坏死面积和巨噬细胞浸润。Hulsmans 等[15-16]在喂食高脂肪饮食的小鼠主动脉内膜中miR-181b 下调,miR-181b 的过量表达与大鼠体质量的下降呈正相关,超重、肥胖为CHD 发病危险因素之一,表明miR-181b与CHD发病风险成负相关。本研究结果显示,冠脉狭窄程度越重,miR-181b的表达水平越低;同时,冠脉狭窄程度越重,其血浆炎症因子hs-CRP 水平越高,且miR-181b 的表达水平与hs-CRP 呈显著负相关,表明miR-181b 在炎症反应中起负调节作用,提示miR-181b 在冠状动脉硬化中起保护作用。
关于miR-181b 对冠状动脉硬化的保护机制尚未明确。Zhang 等[17-18]研究发现,输入蛋白-α3 和 caspase 募集结构域蛋白-10 的低表达,可特异性下NF-κB 核转位作用,进而导致IL-6、IL-8、TNF-α的失活,诱导型一氧化氮合酶、环氧化酶-2、细胞黏附分子-1、人血管内皮细胞黏附分子-1等细胞因子表达的下调,从而抑制炎性反应的发生。Gargi S等[19]和 Dan-Dan Xu 等[20]提出 miR-181b 与 NF-κB 之间存在NF-κB/IL-6/STAT/miR-181b调节环路,NF-κB可通过激活IL-6 依赖的STAT 通路,实现促进miR-181b 的转录作用,降低炎性反应。miR-181b 与NF-κB 互相作用,进一步降低动脉粥样硬化时血管内皮炎性反应,提示miR-181b 在动脉粥样硬化中发挥保护作用。有研究证实[21],miR-181b 可通过抑制巨噬细胞和白细胞之间的转化,抑制免疫细胞在炎性反应中的聚集,进一步发挥抗炎作用。miR-181b 为血管内皮和平滑肌的主要调节因子,可诱导VEC 及VSMC 的增生分化,促进组织修复[22]。P SUN等[23]发现miR-181b/Notch1信号通路对血管内皮细胞的影响,miR-181b 通过抑制Notch1 的表达来保护内皮细胞功能。Tie-Jun Li等[24]发现过表达miR-181b 可激活 PI3K 和 MAPK 通路,AKT 和 ERK1/2 磷酸化水平升高,miR-181b 可通过 PI3K、MAPK 和 JNK 通路调节细胞周期调节因子的表达来促进细胞增殖,发挥动脉粥样硬化血管的修复作用。Di Gregoli 等[25]进行动物实验发现,miR-181b 在小鼠动脉粥样硬化模型中能抑制病变组织中MMP-12 和TIMP-3等金属蛋白酶表达,可扩张血管,稳定动脉粥样硬化斑块。miR-181b 通过自噬调节机制,正性调节mTOR 信号通路的下游分子p70S6K的表达,负性调节自噬,延缓动脉粥样硬化斑块的形成。Carlos等[26]发现在CHD患者血浆中,TNF-α 可促进白细胞附着,冠状动脉内皮细胞活性,细胞因子TNF-α 高表达可诱导miR-181b 的表达,而高表达的miR-181b 可反向抑制 TNF-α 的表达,证实 miR-181b 在 CHD 中发挥保护作用。本研究的不足之处为总体样本量较少,组内比较样本量相对更少;本研究主要为临床实验,与动物实验比较,不可控因素相对较多,可能存在一定偏差。
综上所述,miR-181b 在动脉粥样硬化的进展通过各种途径、机制可发挥保护作用,延缓冠状动脉粥样硬化性心脏病的病情发展,有望为冠心病的治疗提供新的方向。

