新疆部分地区9个奶牛场致奶牛乳房炎主要病原菌的检测与药敏试验
陈 杰,魏 勇,王晨豫,陈明杰,解津刚,齐亚银*
(1.石河子大学动物科技学院,新疆 石河子 832000;2.新疆天澳牧业有限公司,新疆 奎屯 833200)
在奶牛养殖业发展中,奶牛乳房炎是当前奶牛生产中比较常见的疾病之一。该疾病是由多种病因引起的一种常见性疾病,直接影响奶牛的产奶质量和品质[1]。
据报道,在奶牛场中,临床型乳房炎的发病率为 2%~8%,隐性乳房炎的发病率更高,并且难以自愈[2]。根据炎症的严重程度,奶牛乳房炎大体上可以分为临床型和隐性型,其中临床型奶牛乳房炎,视觉上可见明显的受感染表征[3],而隐性型乳房炎,虽然在临床体征上没有明显的变化,但其对牛奶质量和产量方面均带来严重的影响,也正因其无明显的特征,所有很难及时诊断并采用有效措施[4]。
相关研究文献显示,与临床型奶牛乳房炎相比,隐性型乳房炎的发病率要高 15~40 倍[5]。目前,文献显示引起奶牛隐性型乳房炎的常见传染性致病菌大约 20 多种。在超过 90 %的奶牛隐性乳房炎乳样中,都可以检测出大肠杆菌、葡萄球菌和链球菌,因此,以下内容将针对这 3 种病原菌微生物进行详细介绍[3]。
目前发现金黄色平葡萄球菌是诱发奶牛乳房炎的主要病原菌,很难治愈,且由于抗生素的使用产生的耐药菌株已经普遍存在,因此常常使用疫苗进行防治,对于患牛采用淘汰的方式处理[6]。研究表明,金黄色葡萄球菌主要与生奶中体细胞数异常升高相关[7],严重影响牛奶品质。
大肠杆菌诱发的奶牛乳房炎往往多见于泌乳高峰期,常常呈现出急性经过[8],研究表明,控制大肠杆菌性乳房炎,可有效提高奶牛产奶量[9],可见大肠杆菌在乳房炎诱发因素中的地位不容忽略。
只有当奶牛自身发生变化,如缺乏影响、外伤、挤奶方式不正确或免疫力降低时,链球菌才会以乳房炎诱发因素发挥作用[10]。单纯由链球菌诱发的奶牛隐性型乳房炎,奶牛乳腺表现出的红肿等炎症表征不是十分明显,但产奶量会急剧下降[11]。
当奶牛场出现乳房炎时,继而会引起一系列糟糕的连锁反应如牛奶品质的下降、不合格奶牛的淘汰率升高、治疗所用药物成本的增加、牛奶中药物残留的增多。这些影响都会极大的降低奶牛场的效益。因此对奶牛场致乳房炎的主要病原菌的分离鉴定,以及提供合理的预防、治疗方案是相当重要的[7]。
因此本实验为查明新疆部分地区9个规模化奶牛场奶牛乳房炎的致病菌,首要任务是准确采集还未开展临床用药的临床型乳房炎奶样和体细胞数≥50万个/mL的隐性型乳房炎奶样,然后结合常规微生物学实验室诊断的方法,对新疆部分地区9个规模化奶牛场中致乳房炎主要病原菌进行分离鉴定,以及药敏试验并给出合理的临床用药方案。旨在为奶牛场乳房炎的临床治疗以及预防,提供合理有效的理论指导依据。
1 材料
1.1 试验样品
试验样品采自新疆部分地区9个规模化奶牛场214头临床型乳房炎牛只和1 022头隐性型乳房炎牛只的奶样,经-4 ℃保存运输。
1.2 主要试剂及药品
试验所需相关试剂见表1。

表1 实验试剂
1.3 主要仪器与设备
试验一所需相关仪器与设备见表2。

表2 仪器与设备
2 试验方法
2.1 样品采集
2021年5月—6月在新疆部分地区饲养规模均为1 000~1 300头之间的9个规模化奶牛场,对均处于泌乳期的成年奶牛进行样品采集,用5 mL无菌EP管采集,挤奶时选择已完成前药浴、弃头三把奶工作后的奶样,共采集1 236份奶样,其中临床型乳房炎牛只的奶样共214份,共采取1 022份隐性型乳房炎牛只的奶样,经-4℃保存运输。其中隐乳牛只奶样采集工作,根据奶牛场的DHI数据体细胞数≥50万个/mL的泌乳牛只信息,首先通过隐性乳房炎检测(CMT)法和牛博士体细胞检测仪的结合应用,判定标准见表3。来准确筛选出奶牛场中隐性型乳房炎牛只的耳号信息,其次再通过奶牛场“阿菲金”软件系统,在开始每日的挤奶工作时能够快速、准确的锁定目标牛只,从而完成隐性型乳房炎奶样的采集工作。

表3 CMT 判定标准
2.2 致乳房炎主要病原菌菌株的分离纯化与保藏
2.2.1 葡萄球菌的分离纯化 将奶样样品管充分涡旋振荡均质,移取50 μL转种于800 μL的LB肉汤培养基内,在37 ℃、180 r/min条件的振荡培养箱中培养18~24 h。在甘露醇高盐琼脂培养基上划线接种,在37 ℃的恒温培养箱中培养18~24 h。挑取金黄色单个菌落(且此菌落周围的甘露醇高盐琼脂培养基的颜色也由最初透明的淡红色变成了透明的淡黄色)重复转种于LB肉汤培养基中振荡培养18~24 h。再次在甘露醇琼脂培养基上划线接种,在37℃恒温培养箱中培养18~24 h。挑取菌落进行涂片、革兰氏染色,显微镜下镜检观察,将镜检呈葡萄串状,无芽孢、鞭毛,无荚膜的单个菌落再次转种于脑心浸出液肉汤(BHI)培养基振荡培养18~24 h。
2.2.2 大肠杆菌的分离纯化 将奶样样品管充分涡旋振荡均质,移取50 μL,转种于800 μL的LB肉汤培养基内,在37 ℃、180 r/min条件的振荡培养箱中培养18~24 h。在麦康凯琼脂培养基上划线接种,在37 ℃的恒温培养箱中培养18~24 h。挑取玫红色单个菌落重复转种于LB肉汤培养基中振荡培养18~24 h。再次在麦康凯琼脂培养基上划线接种,在37 ℃的恒温培养箱中培养18~24 h。挑取菌落进行涂片、革兰氏染色,于显微镜下镜检观察,将镜检呈中等大小的革兰氏阴性杆菌的单个菌落再次转种于脑心浸出液肉汤(BHI)培养基振荡培养18~24 h。
2.2.3 链球菌的分离纯化 将奶样样品管充分涡旋振荡均质,移取50 μL,转种于800 μL的叠氮钠葡萄糖肉汤培养基内,在37 ℃、180 r/min条件的振荡培养箱中培养18~24 h。在脱纤维绵羊血琼脂培养基上划线接种,在37 ℃的恒温培养箱中培养18~24 h。 挑取具有溶血环的菌落重复转种于叠氮钠葡萄糖肉汤培养基中振荡培养18~24 h。再次在脱纤维绵羊血琼脂培养基上划线接种,在37℃的恒温培养箱中培养18~24 h。挑取菌落进行涂片、革兰氏染色,于显微镜下镜检观察,将镜检呈阳性球菌,链状排布的单个菌落再次转种于脑心浸出液肉汤(BHI)培养基振荡培养18~24 h。
2.2.4 菌种的保藏 首先将丙三醇(甘油)与蒸馏水1∶1混匀在锥形瓶中,使得甘油浓度保持在50%,再通过高压灭菌锅121 ℃条件下高压20 min。再将经多次分离纯化后的葡萄球菌、大肠杆菌、链球菌的菌液与50%甘油,按照1∶1比例各取500 μL加入无菌冻存管中混匀,最后置于-20 ℃冰箱储存。
2.3 分离菌形态学观察
使用接种环分别将纯化后的三种菌液均匀涂抹在载玻片中央,将载玻片置于酒精灯外焰上3~5 cm处固定,经革兰染色法染色后,在光学显微镜的100倍油镜下观察菌株形态。
2.4 分离菌株的PCR鉴定
依照DNA提取试剂盒操作步骤提取三种目标细菌DNA,于-20℃保存。
2.4.1 PCR鉴定 对提取的分离菌DNA进行PCR扩增,引物合成参考相关文献[12-14],引物序列及条件见表4,反应体系为25 μL:2 × Taq Plus Master mix Ⅱ12.5 μL,双蒸水8.5μL,上下游引物各1μL,细菌DNA模板2 μL。反应程序为:

表4 PCR扩增条件及引物序列
①金黄色葡萄球菌:预变性95 ℃ 5min,95 ℃变性30 s,47 ℃退火30 s,72 ℃延伸1 min,进行30个循环;72 ℃终延伸10 min,4 ℃保存。
②大肠杆菌:预变性94 ℃ 5min,94 ℃变性40 s,59 ℃退火30 s,72 ℃延伸1 min,进行35个循环;72 ℃终延伸10 min,4 ℃保存。
③无乳链球菌:预变性95 ℃ 5min,94 ℃变性1 min,56 ℃退火1min,72 ℃延伸2 min,进行30个循环;72 ℃终延伸10 min,4 ℃保存。
扩增PCR产物片段小于700 bp的使用2%的琼脂糖凝胶进行电泳,大于700 bp的使用1.5%的琼脂糖凝胶进行电泳,电泳条件为:1×TAE电泳液,120 V,90 mA,40 min。用凝胶成像仪对电泳后的琼脂糖凝胶进行分析。
2.5 分离菌株的药物敏感性试验
2.5.1 分离菌株的药敏表型检测 主要药敏试纸选择为:头孢噻肟、青霉素、万古霉素、链霉素、庆大霉素、诺氟沙星、丁胺卡那霉素、氨苄西林、四环素、阿莫西林、环丙沙星等购自于杭州滨和微生物试剂有限公司。将多次分离纯化后得到的金黄色葡萄球菌、大肠杆菌、无乳链球菌,分别接种与LB肉汤培养基中,置于恒温摇床内增菌培养24 h后,用生理盐水将菌液浓度调节至(1~2)×10 CFU/mL。按照纸片法的操作,吸取适量菌液涂布在琼脂平板上,取出不同药敏纸片,贴于琼脂表面,不同药敏纸片的间距至少24 mm。将平板置于37 ℃恒温培养箱中培养24 h后,测量琼脂上的抑菌环直径。评判结果均参照美国临床实验室国家标准化管理委员会标准(CLSI2008)。
3 结果与分析
3.1 分离菌株的初步鉴定及形态学特征
纯化后的葡萄球菌菌液划线于甘露醇高盐琼脂培养基上长出的菌落颜色为金黄色菌落(且此菌落周围的甘露醇高盐琼脂培养基的颜色也由最初透明的淡红色变成了透明的淡黄色);符合金黄色葡萄球菌的生长特性;该菌经革兰氏染色后在显微镜下呈球型,排列呈葡萄串状,无芽孢、鞭毛,无荚膜(详见图1)。
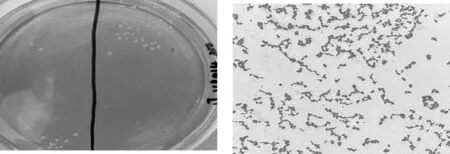
(a)甘露醇高盐培养基 (b)金黄色葡萄球菌镜检照片(1 000×)
纯化后的大肠杆菌菌液划线于麦康凯琼脂培养基上的菌落形态为玫红色、边缘光、湿润的菌落;大肠杆菌经革兰氏染色后,在显微镜下呈现中等大小的革兰氏阴性杆菌(图2)。
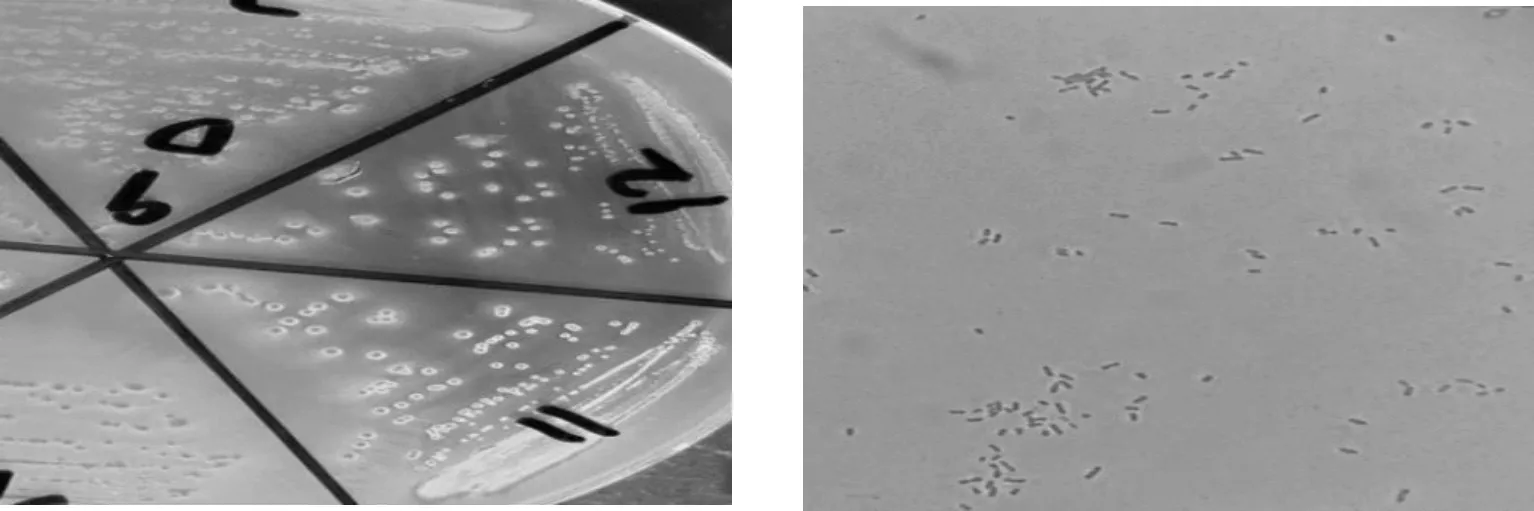
(a)麦康凯培养基 (b)大肠杆菌镜检照片(1 000×)
纯化后的链球菌菌液划线于脱纤维无菌绵羊血琼脂平板上的菌落出现灰白色菌落,菌落周围出现透明溶血环:经革兰氏染色后该菌在显微镜下呈现革兰氏阳性球菌,链状排布(图3)。

(a)血琼脂平板 (b)链球菌镜检照片(1 000×)
3.2 PCR鉴定结果
扩增产物经琼脂糖凝胶电泳,产物大小与预期大小一致,分别为264 bp、651 bp和345 bp(详见图4、5、6);9个规模化奶牛场样品纯化后的菌液经PCR鉴定后确定为金黄色葡萄球菌371株、大肠杆菌297株、无乳链球菌112株(详见表5、表6)。
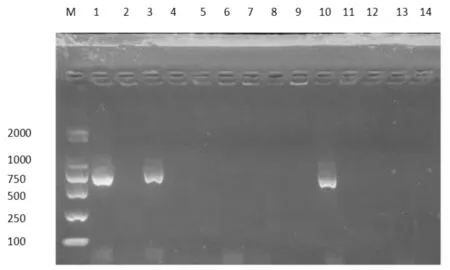
注:marker为DL 2 000 marker;M:Marker;1-14:部分金黄色葡萄球菌PCR鉴定;
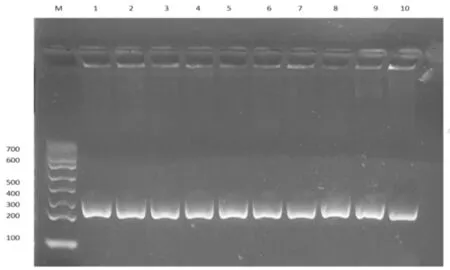
注:marker为DL 700marker;M:Marker;1-10:部分大肠杆菌PCR鉴定;
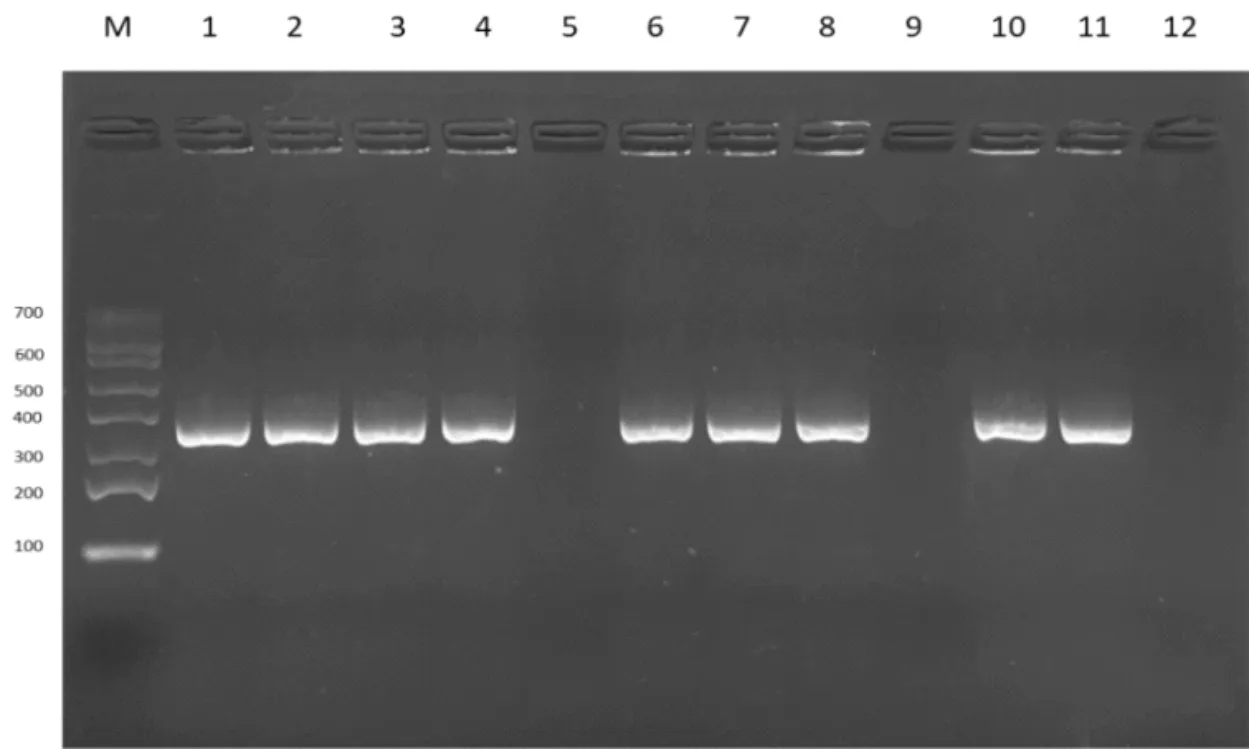
注:marker为DL700marker;M:Marker;1-12:部分无乳链球菌PCR鉴定;
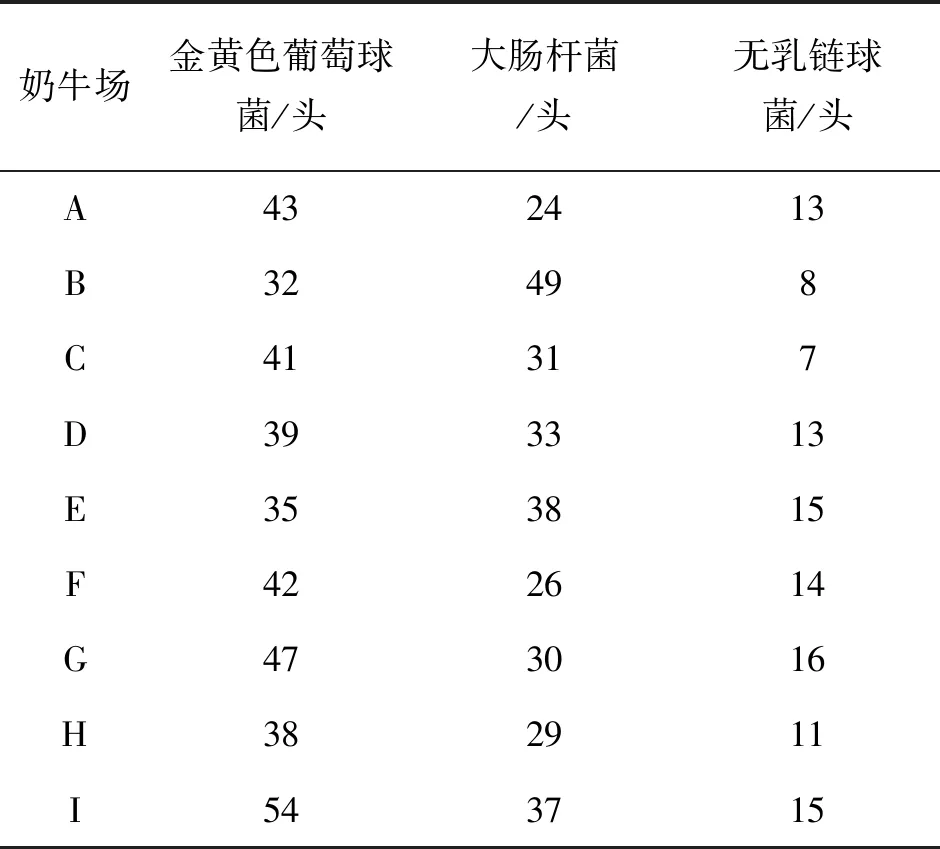
表5 9个规模化奶牛场致乳房炎主要病原菌检测奶牛头数
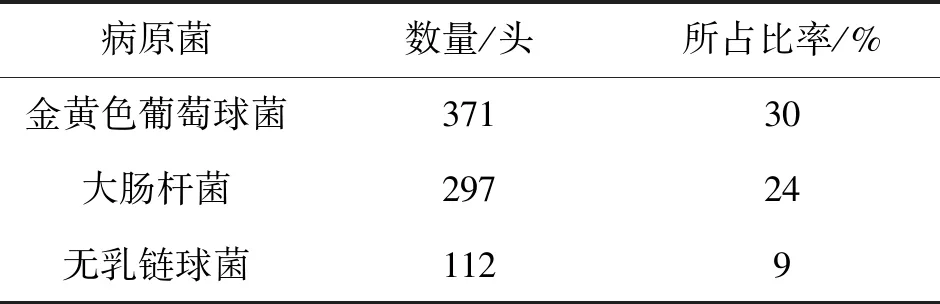
表6 1236份乳样细菌分离鉴定表
3.3 药敏表型检测结果
由表8可知,金黄色葡萄球菌对头孢噻肟、万古霉素、链霉素、庆大霉素、丁胺卡那霉素、阿莫西林、环丙沙星高度敏感;大肠杆菌对头孢噻肟、链霉素、庆大霉素、丁胺卡那霉素、环丙沙星高度敏感;无乳链球菌对头孢噻肟、万古霉素、诺氟沙星、环丙沙星高度敏感。
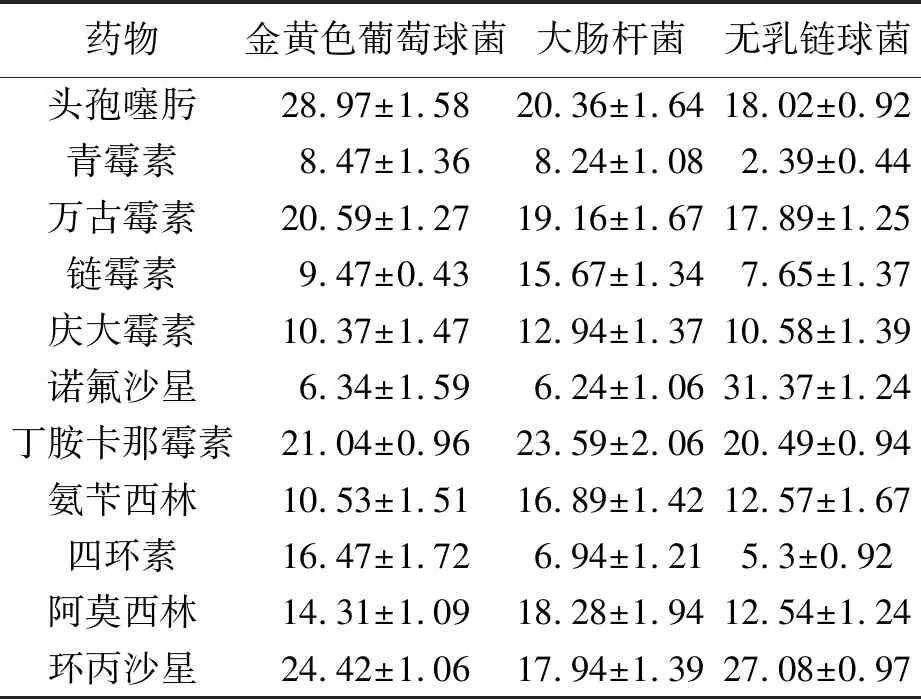
表7 不同药物对三种致病菌的平均抑菌直径(mm)
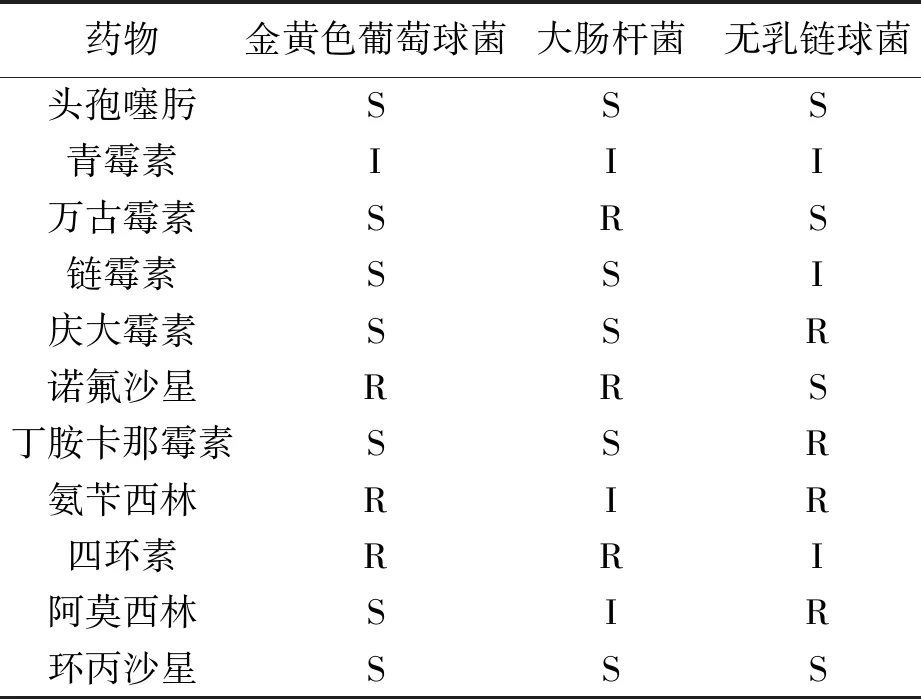
表8 药敏试验结果
4 讨论
此次共采集乳样1236份,1150份分离出病原菌,分离率达到93%,其中经革兰氏染色、显微镜观察后葡萄球菌742株,肠杆菌共531株,链球菌371株。最后通过特异性引物经PCR鉴定后共得到371株金黄色葡萄球菌、297株大肠杆菌、112株无乳链球菌。引起奶牛乳房炎的病原菌种类繁多,其主要致病菌是金黄色葡萄球菌、大肠杆菌、无乳链球菌及停乳链球菌。本次分离结果以金黄色葡萄球菌居多,其次是大肠杆菌和无乳链球菌。细菌的分离和鉴定是防治奶牛乳房炎技术研究的基础。根据本次实验的药敏结果显示头孢噻肟、环丙沙星效果最好,可为新疆部分地区奶牛场防治乳房炎的临床用药提供一定的理论依据。为了减少耐药性建议在进行乳房炎的治疗时,用药方式应采取轮换用药。

