甘蔗黑穗病拮抗细菌的促生长特性及其防治效果研究
谢光杰 段振峰 王震 余卓新 邢永秀 李杨瑞

摘要:【目的】篩选具有拮抗甘蔗黑穗病菌(Sporisorium scitamineum)及促进植物生长特性的细菌,为甘蔗黑穗病的生物防治提供菌株资源和参考依据。【方法】采集出现黑穗病甘蔗株的根际土壤,采用平板对峙培养法分离纯化获得拮抗菌株,通过16S rRNA序列分析明确拮抗菌株的分类地位并分析其促生长特性;采用桶栽试验,研究筛选获得的优良拮抗菌株对甘蔗黑穗病的防治效果。【结果】分离纯化获得68株细菌菌株,其中7株(G1、G10、G12、G14、G20、G21和G23)对甘蔗黑穗病菌具有抑制效果。7株菌株具有产纤维素酶、产几丁质酶、分泌吲哚乙酸(IAA)、产1-氨基环丙烷-1-羧酸脱氨酶(ACC脱氨酶)、嗜铁能力、溶解有机磷、产蛋白酶及产氢氰酸(HCN)等不同程度的促进植物生长特性,特别是3株伯克霍尔德氏菌属(Burkholderia)菌株G1、G10和G23的综合效果更好。用拮抗能力较强的菌株G1、G10、G12和G23防治甘蔗黑穗病的桶栽试验结果表明,4株拮抗菌株处理均可有效抑制黑穗病的发生,提高甘蔗的出苗率和生物量,其中以菌株G23处理的综合效果最好。【结论】分离获得7株对甘蔗黑穗病菌拮抗效果较好的菌株,均具有不同程度的促进植物生长特性,其中以菌株G23的综合效果最好,具有良好的应用前景。
关键词: 甘蔗黑穗病;拮抗细菌;鉴定;防治效果;促植物生长特性
中图分类号: S435.661 文献标志码: A 文章编号:2095-1191(2021)11-3013-09
Plant growth-promoting characteristics and control effect of antagonistic bacteria against sugarcane smut
TA Quang-kiet1, DUAN Zhen-feng1, WANG Zhen1, YU Zhuo-xin1,
XING Yong-xiu1*, LI Yang-rui2*
(1College of Agriculture, Guangxi University, Nanning 530004, China; 2 Guangxi Key Laboratory of Sugarcane Genetic Improvement/ Key Laboratory of Sugarcane Biotechnology and Genetic Improvement (Guangxi), Ministry of Agriculture and Rural Affairs/Sugarcane Research Center, Chinese Academy of Agricultural Sciences/Sugarcane
Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
Abstract:【Objective】To screen for bacteria with the characteristics of antagonizing sugarcane smut and promoting plant growth to provide strain resources and reference for the biological control of sugarcane smut. 【Method】The rhizosphere soils of sugarcane with serious incidences of sugarcane smut disease were collected, and antagonistic strains were isolated and purified by gradient dilution and the plate confrontation culture method. The classification of antagonistic strains was determined by 16S rRNA sequence analysis and their different growth promoting characteristics were analyzed. In parallel, their effect on sugarcane smut development was studied by pot experiments. 【Result】A total of 68 bacterial strains were obtained after isolation and purification,of which seven strains (G1, G10, G12, G14, G20, G21 and G23) had inhibitory effects on the fungus Sporisorium scitamineum. The seven strains showed different growth promoting abilities, as indicated by their differing productions of cellulose, chitinase, indole acetic acid (IAA), 1-aminocyclopropane-1-carboxylic aciddeaminase(ACC deaminase), siderophores, proteases, hydrocyanic acid production(HCN) production, and their abilities to dissolve organic phosphate. Three strains of Burkholderia spp. (G1, G10 and G23) ranked highest. The pot experiment of sugarcane smut control showed that four antagonistic strains (G1, G10, G12 and G23) effectively inhibited the occurrence of smut and improve the emergence rate and biomass of sugarcane with a significantly increase in biomass. Among all the strains, the strain G3 seemed to be the most performing one. 【Conclusion】The top se-ven strains displaying antagonistic effects on sugarcane smut all show different growth promoting ability. Considering all the data, the antagonistic strain G23 shows the best combined effects of smut control and growth promotion, indicating good application potential.
Key words: sugarcane smut; antagonistic bacteria; identification; control effect; plant growth promoting characteristic
Foundation item: National Natural Science Foundation of China(31971858,31560352);Guangxi Science and Technology Base and Talents Special Project (Guike AD17195100);Guangxi Sugarcane Innovation Team Project of National Modern Agricultural Industrial Technology System (gjnytxgxcxtd-03-01)
0 引言
【研究意义】甘蔗黑穗病为全球性重要真菌病害,对甘蔗生产危害严重(Schenck et al.,2005;Izadi and Moosawi-Joff,2007;李杨瑞,2010;Li et al.,2016)。广西是世界十大产糖区之一,甘蔗种植面积约73.33万ha(罗含敏等,2020),目前甘蔗生产上最主要的病害是黑穗病,常造成甘蔗产量的巨大损失(Li et al.,2016;韦金菊等,2019)。由于当前广西甘蔗主栽品种桂糖42号和桂柳05-136均较感黑穗病,且该病的病原菌已广泛分布于土壤、空气等蔗田环境中,采用脱毒健康种苗和化学药剂防治效果不佳,因此,探寻有效的甘蔗黑穗病防治手段具有重要意义。【前人研究进展】植物根际促生细菌(PGPR)具有溶磷、分泌嗜铁素和植物激素、产氢氰酸(HCN)及防治病虫害等作用。研究发现铁载体有助于对植物病原体的生物控制(Solanki et al.,2014),植物可利用微生物铁载体获得铁以提高产量(Etesami and Maheshwari,2018)。已有报道一些植物根际促生长细菌具有强大的生防潜力,可减少化学肥料和农药的使用(孔庆科和丁爱云,2001;郝晓娟等,2007;曹媛媛等,2019)。Velazhahan等(1999)研究表明,根际内生拮抗细菌荧光假单胞菌(Pseudomonas fluorescens)对水稻稻瘟病防治有积极作用,菌株产生的几丁质酶和葡聚糖酶水平与其防治效果有密切关系。Cui等(2019)研究发现小麦根际分离的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)B9601-Y2对几种重要的植物病原具有拮抗作用,能溶解磷酸盐、钾等矿物,并能在体外條件下无氮生长;可显著促进玉米幼苗生长,改善与土壤质量相关的几种酶,提高叶绿素含量;同时具有营养增溶和病害抑制特性,具有作为生物防治和植物生长促进剂的潜力。已有学者开展了甘蔗病害生防拮抗菌研究,并取得了一定成果。Lal等(2009)利用木霉菌(Trichoderma viride)防治甘蔗黑穗病菌的研究结果表明,木霉菌处理使甘蔗发芽率提高6.2%,有效茎数增加15.1%,甘蔗产量提高27.33%。Liu等(2017)分离了1株来自根际的瓜里科州假单胞菌(P. guariconensis)ST4细菌,该细菌对甘蔗黑穗病菌双极性孢子菌丝的交配具有很强的抑制活性,但需要葡萄糖才能产生拮抗物质。Juma等(2018)从甘蔗品种Co421根际中分离得到的微生物AJB9对甘蔗黑穗病菌具有显著的拮抗作用。Jayakumar等(2019)从甘蔗节间、芽和根中分离到8株对甘蔗黑穗病菌具有较强拮抗作用的内生细菌,田间试验结果表明,接种内生菌不仅降低了甘蔗黑穗病的发病率,而且使发病初期推迟60 d。张旭娜(2020)采用平板对峙法从甘蔗芽中筛选分离得到1株对甘蔗鞭黑粉菌菌丝生长有促进作用的内生细菌菌株D3和1株对甘蔗鞭黑粉菌有拮抗作用的内生细菌菌株ZC2-4,经鉴定,菌株D3为拉氏根瘤菌[Rhizobium larrymoorei (Bouzar and Jones)],ZC2-4为解淀粉芽孢杆菌[B. amyloliquefaciens (Fukumoto)]。近年来,本课题组在甘蔗黑穗病拮抗细菌的筛选方面初步开展了一些工作,从甘蔗根中分离获得20株芽孢杆菌(Bacillus)菌株,其中多株菌株可拮抗1种以上病原真菌,尤其是贝莱斯芽孢杆菌(B. velezensis)Y8对测试的8种病原真菌均具有拮抗作用,并具有促植物生长特性(Wang et al.,2019;余卓新,2020);Guo等(2020)从甘蔗属5个种的根中分离获得175株内生细菌菌株,其中多株菌株对甘蔗黑穗病菌具有拮抗作用;Singh等(2021a)从甘蔗根中分离得到的内生绿脓杆菌(P. aeruginosa)菌株B18对3种甘蔗病原菌黑穗病菌(Sporisorium scitamineum)、凤梨病菌(Ceratocystis paradoxa)和轮枝镰孢菌(Fusarium verticillioides)均具有较强的拮抗能力并具有显著的植物促生性能;Singh等(2021b)从甘蔗根际分离得到阿氏肠杆菌(Enterobacter asburiae)菌株BY4和分散泛菌(Pantoea dispersa)菌株AA7对甘蔗黑穗病菌和凤梨病菌具有拮抗作用。【本研究切入点】甘蔗根际存在大量的植物促生长细菌,但有关甘蔗黑穗病拮抗菌的分离报道相对较少,且尚未见有关于伯克霍尔德氏菌属(Burkholderia)细菌拮抗甘蔗黑穗病菌的报道。【拟解决的关键问题】在原有工作的基础上,采用平板对峙培养法从甘蔗黑穗病发病严重的土壤中分离具有拮抗甘蔗黑穗病菌及促进植物生长特性的细菌,为甘蔗黑穗病的生物防治提供菌株资源和参考依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 甘蔗黑穗病菌的分离 从感染黑穗病的甘蔗上采集黑鞭,75%酒精消毒后剥开黑穗鞭,挑取孢子放入装有20 mL无菌水的小瓷杯中,其中链霉素浓度为1500 mg/L,拌匀静置1 min。取2 mL于另一无菌小瓷杯进行10倍稀释,连续3次。取稀释液0.1 mL涂布于马铃薯蔗糖琼脂培养基(PDA),在28 ℃培养箱中培养3 d后挑取单菌落纯化。
1. 1. 2 甘蔗黑穗病病原菌的PCR鉴定 利用真菌DNA提取试剂盒(E.Z.N.ATM HP Fungal DNA Kit,壹棵松生物公司提供)提取甘蔗黑穗病病原菌DNA,采用黑穗病菌检测引物bE4(5'-CGCTCTGGTTCAT CAAGC-3')和bE8(5'-TGCTGTCGATGGAAGGTG T-3')进行PCR扩增。PCR体系25.0 μL:10×PCR Buffer 2.5 μL,25 mmol/L MgCl2 2.0 μL,10 mmol/L dNTPs 1.0 μL,Taq DNA聚合酶(5U/µL)0.2 µL,上、下游引物各2.0 µL,DNA模板2.0 µL,加灭菌超纯水补足至25.0 µL。PCR扩增程序:94 ℃预变性4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行35个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳进行检测。
1. 2 甘蔗黑穗病拮抗细菌的分离、筛选和鉴定
1. 2. 1 甘蔗黑穗病拮抗细菌的分离和筛选 于甘蔗生长期在广西大学农学院甘蔗黑穗病研究温室采集出现黑穗病甘蔗株的根际土壤。采用五点采样法采样,铲去2 cm表土,小心挖出根系,抖动去土,保留附着在根上的少量土,置于塑料袋中,带回实验室。剪取根系5 g,置于装有45 mL无菌水的灭菌三角瓶,振荡2~3 min,静置2 h,取土壤浸提液1 mL至试管中,依次稀释成10-2、10-3和10-4倍稀释液进行分离。
分离方法:各浓度取0.1 mL悬液分别涂布于LB培养基平板上,设3个重复,28~30 ℃下培养1~3 d,待菌落形成后,挑取形态、大小、色泽不同菌落划线纯化,经2次纯化培养后的单菌落移至LB斜面培养基上,编号后在28 ℃培养1~2 d,置于4 ℃冰箱中保存备用。
采用平板对峙培养法,在PDA培养基中心放入黑穗病菌单菌落,28 ℃下恒温培养2~4 d后,形成直径为3 mm的黑穗病菌菌落,将分离获得的细菌接种于培养基中心间距18 mm处,继续培养10~15 d。以细菌接种点至甘蔗黑穗病菌菌落外缘的间距确定拮抗程度。
细菌抑制黑穗病菌生长的抑菌率按下式计算:I(%)=d/D×100。式中,I为细菌抑制黑穗病菌生长的抑菌率(%);D为对照黑穗病菌菌落直径(mm);d为细菌接种点至甘蔗黑穗病菌菌落外缘的间距(mm)。
1. 2. 2 甘蔗黑穗病拮抗细菌鉴定 用细菌基因组DNA提取试剂盒(北京康为世纪生物技术有限公司)提取细菌DNA,按试剂盒使用说明进行操作。
参照Lane(1991)的方法,采用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCA-3')和1942R(5'-TACGGCTACCTTGTTACGACTT-3')扩增细菌菌株的16S rRNA基因片段。PCR反应体系50.0 μL:Master Mix 25.0 μL,DNA模板(30 ng/μL)1.5 μL,上、下游引物各1.5 μL,ddH2O 20.5 μL。扩增程序:94 ℃预变性5 min;94 ℃ 55 s,50 ℃ 50 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min。PCR产物委托北京奥科鼎盛生物科技有限公司测序。
以细菌菌株的16S rRNA序列及其在NCBI网站下载的相关参考菌株的基因序列,用MEGA-X中的非加权组平均法(UPGMA)構建系统发育进化树。
1. 3 甘蔗黑穗病拮抗细菌的促生长特性检测
1. 3. 1 菌株产几丁质酶和纤维素酶能力检测 将分离获得的拮抗细菌接种于几丁质培养基上,28 ℃培养 7 d,观察透明圈产生情况。采用羧甲基纤维素钠平板法和刚果红染色法筛选具有纤维素分解能力的菌株,并测量菌落直径(D)和水解圈直径(d)。
1. 3. 2 菌株的嗜铁能力检测 参考Schwyn和Neiland(1987)的方法进行。拮抗细菌在CAS培养基上划线,37 ℃培养3 d(或5 d),观察菌落周围是否形成黄色晕圈,以黄色晕圈的大小代表菌株的嗜铁能力。
1. 3. 3 菌株溶解有机磷能力检测 在Pikovaskai’s培养基上接种拮抗细菌,于30 ℃下培养5 d,以菌落周围的晕圈区有无和大小代表细菌的溶解磷能力。
1. 3. 4 菌株产蛋白酶能力检测 参照Ghorbel等(2003)的方法进行。自能够产生胞外蛋白酶的菌株在牛奶平板上生长后,其菌落周围可形成明显的蛋白水解圈。水解圈与菌落直径的比值常被作为判断该菌株蛋白酶产生能力的筛选依据。
1. 3. 5 菌株分泌吲哚乙酸(IAA)能力测定 参照Glick等(1997)的方法进行。
1. 3. 6 菌株1-氨基环丙烷-1-羧酸脱氨酶(ACC脱氨酶)活性检测 PYG培养基:葡萄糖20.0 g,蛋白胨5.0 g,酵母粉3.0 g,蒸馏水1000 mL,pH 7.0;A#培养基:蔗糖10.0 g,ACC 1.0 g,无机盐溶液1000 mL(KH2PO4 100.0 g,K2HPO4 1.0 g,MgSO4·7H2O 0.5 g,CaCl2·2H2O 0.13 g,FeSO4·7H2O 0.013 g,pH 7.0)。B#培养基:不加ACC,其余同A#。
菌株纯化后接种于3 mL PYG液体培养基中,30 ℃下200 r/min摇床培养40 h,离心收集菌体,用0.1 mol/L磷酸盐缓冲液(pH 7.5)洗2次,然后用无菌水制成菌悬液,分别取10 μL接种于1.5 mL A#和B#培养基中,30 ℃下200 r/min摇床培养,测定660 nm处的OD值。
1. 3. 7 菌株产氢氰酸(HCN)能力测定 参考陈庆河等(1998)的方法进行。将细菌接种于加有4.4 g/L甘氨酸的NB培养基上,盖上培养皿盖(顶盖内侧贴有浸过苦味酸溶液的无菌滤纸;苦味酸溶液配制:苦味酸2.5 g,Na2CO3 12.5 g,水1000 mL),培养皿用Parafilm封口膜密封,28 ℃下培养48 h后确定各菌株产HCN能力。每处理3个重复。
1. 4 拮抗菌株对甘蔗黑穗病发病率及甘蔗出苗率和生物量的影响
1. 4. 1 菌株的培养 从-80 ℃冰箱中取出拮抗能力较强的菌株于LB固体培养基上活化,长出单菌落后用消毒牙签挑取单菌落于液体培养基中过夜培养,测定600 nm下菌液的吸光值为0.8左右,进行离心(4 ℃下4000 r/min离心10 min),收集菌体,随后用无菌蒸馏水稀释至108 CFU/mL备用。
黑穗病菌菌液制备参考黄家雍等(2001)的方法。
1. 4. 2 甘蔗种植及处理 试验在广西大学甘蔗研究所进行。供试土壤为种植甘蔗的大田土壤并进行蒸汽灭菌处理,土壤有机质含量21.47 g/kg。栽培用桶规格上口径约32 cm,高度约20 cm,每桶装土约17 kg。
试验设CK1(清水浸泡)、CK2(黑穗病菌菌悬液浸泡)及黑穗病菌 + 拮抗菌株菌悬液浸泡处理。将甘蔗品种ROC22砍成单芽,分别在不同处理的溶液中浸泡。对于黑穗病菌 + 拮抗菌株共接种处理的甘蔗,先在浓度为5×106孢子/mL的黑穗病菌菌悬液中浸泡6 h,取出遮荫干燥后再放入浓度为108 CFU/mL的拮抗菌菌悬液中浸泡30 min;CK1处理用清水浸泡6 h;CK2处理用浓度为5×106孢子/mL的黑穗病菌菌悬液浸泡6 h。每桶种植3株,3次重复。甘蔗生长期间不施肥,只进行正常浇水除草管理。
1. 5 统计分析
试验数据采用Excel 2010整理和作图,运用DPS v15.10进行数据统计分析,采用Duncan法进行多重比较。
2 结果与分析
2. 1 甘蔗黑穗病菌的分离、培养和鉴定
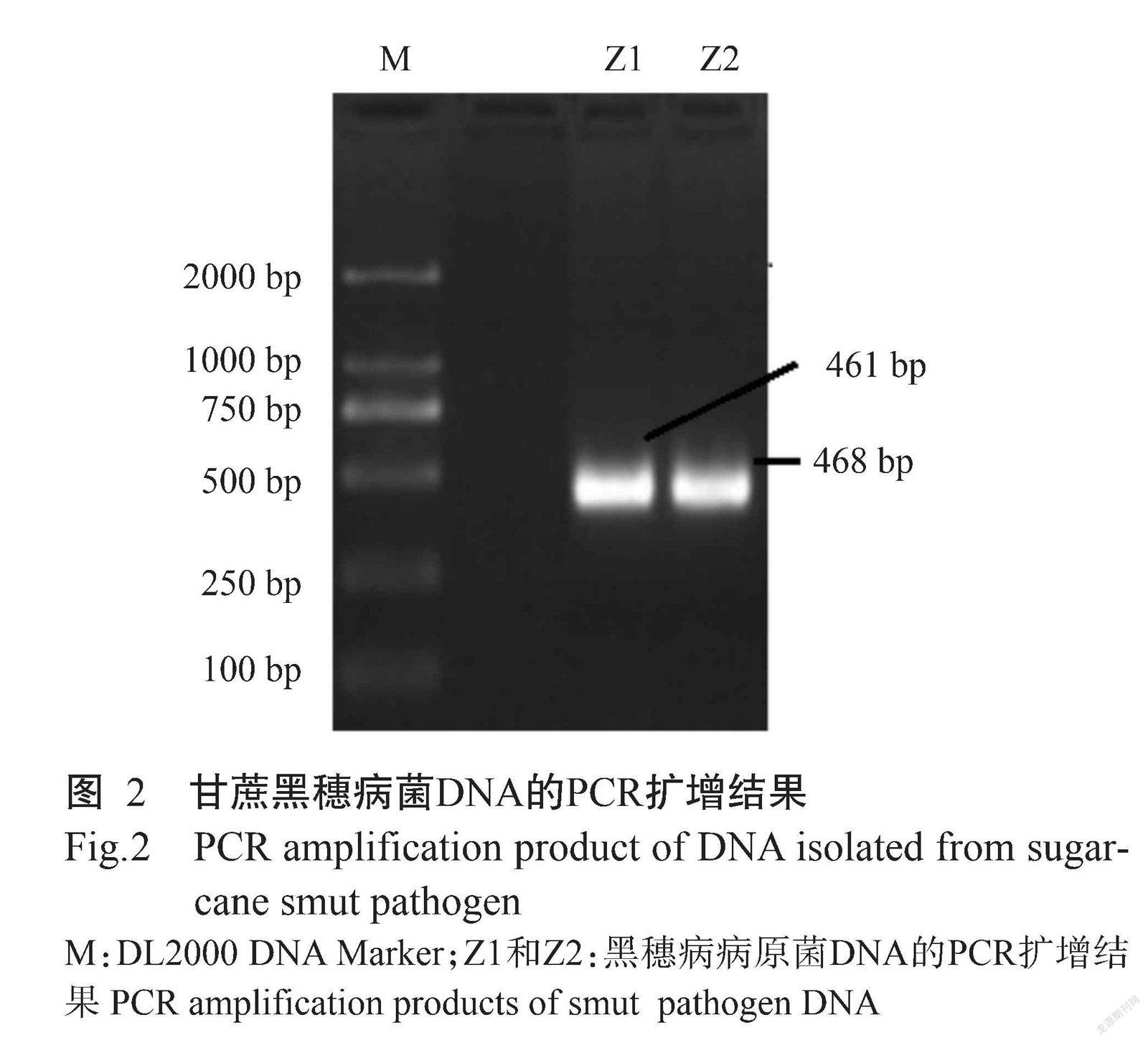
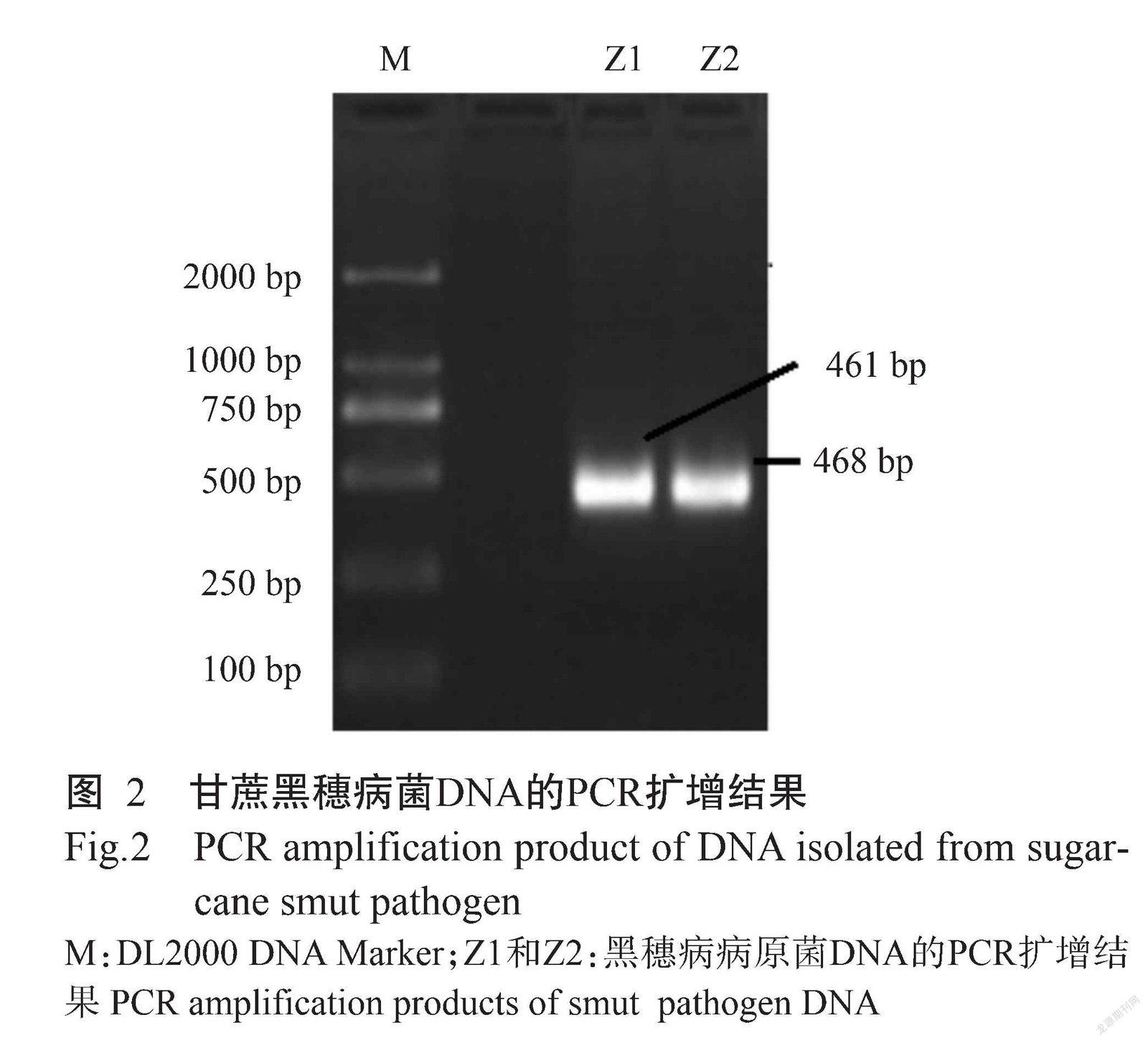
在PDA培养基上,甘蔗黑穗病菌菌丝呈纯白色,密生,形成的菌落圆形,培养3 d观察到明显的菌落,5 d时菌落直径10 mm左右,培养10 d菌落直径22 mm,培养15 d菌落直径达35 mm(图1)。提取分离纯化的2个黑穗病菌单菌落Z1和Z2的DNA进行PCR扩增,结果表明,黑穗病病原菌Z1出现461 bp的条带,Z2出现468 bp的条带(图2)。所得序列经与NCBI數据库进行序列比对,确定分离的菌株属于甘蔗黑穗病菌属(Sporisorium)。
2. 2 甘蔗黑穗病拮抗细菌的分离、筛选和鉴定
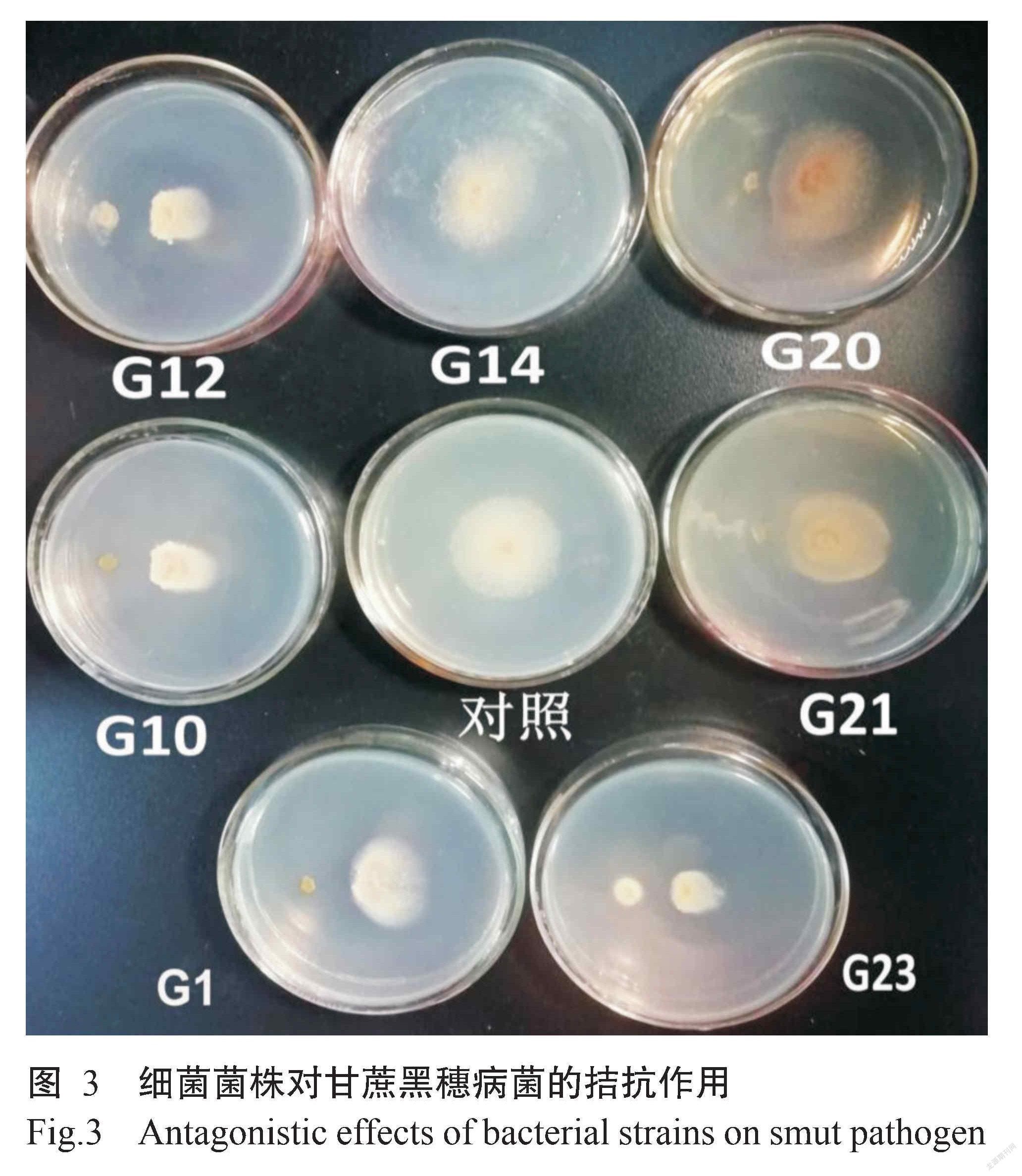
2. 2. 1 拮抗细菌的分离和筛选 采集出现黑穗病甘蔗株的根际土壤,采用平板对峙培养法从LB培养基上共分离纯化获得68株细菌菌株,发现7株对黑穗病菌有抑制效果(图3),其中拮抗能力较强的菌株为G1、G12、G10和G23,抑菌率分别为51.43%、62.86%、71.43%和80.00%,拮抗能力较弱的菌株为G14、G20和G21,抑菌率分别为14.29%、14.29%和17.14%。
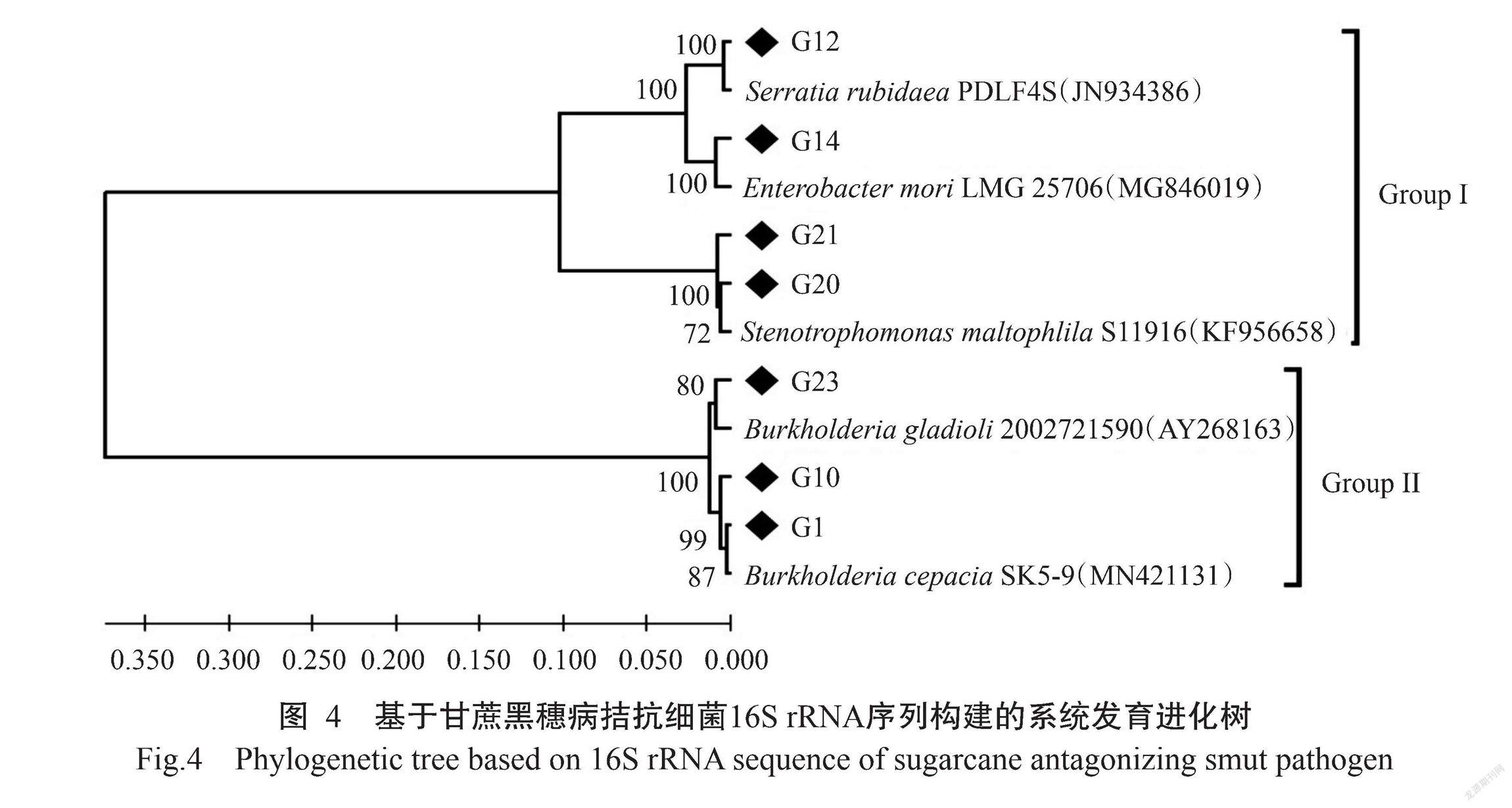
2. 2. 2 拮抗细菌系统发育分析 以拮抗细菌的16S rRNA序列与相近的参考标准菌株的16S rRNA序列通过MEGA-X软件的UPGMA法构建系统发育进化树。由图4可看出,7株拮抗细菌菌株可分为2大类群,其中伯克霍尔德氏菌属(Burkholderia)(G1、G10、G23)与其他菌株的亲缘关系最远,独立为一个簇菌;沙雷氏菌属(Serratia) (G12)、肠杆菌属(Enterobacter)(G14)和窄食单胞菌属(Stenotrophomonas)(G20、G21)为一个簇菌。
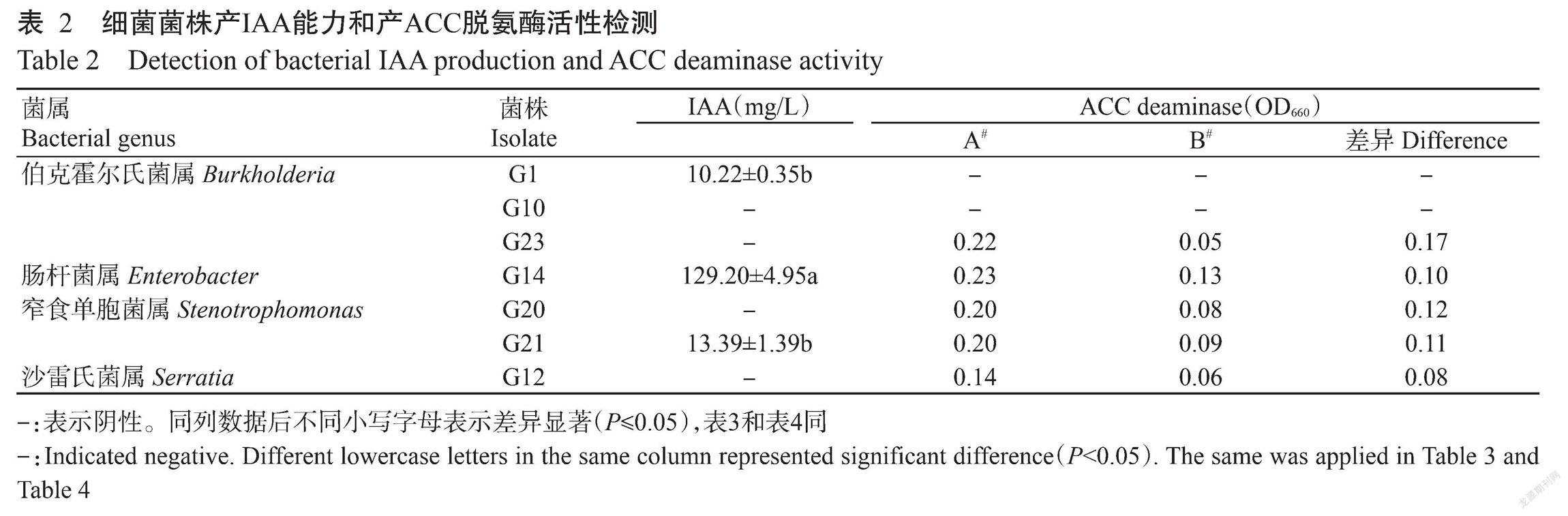
2. 2. 3 拮抗细菌的促生长特性 从产几丁质酶、产纤维素酶、嗜铁能力、溶解有机磷、产蛋白酶、产生IAA和产生HCN等方面评价7株拮抗菌株的促甘蔗生长特性。结果(表1和表2)显示,7株菌株均具有产几丁质酶和纤维素酶能力,其中G20、G21和G23能力较强,G1和G10中等,G14和G12较弱。7株菌株均具有嗜铁能力,以G1和G10最强,G23中等,G12、G14、G20和G21较弱。溶磷能力以G1、G10和G12较强,G23中等,G14、G20和G21无溶磷能力。除G14表现较弱的产蛋白酶能力外,其余菌株产蛋白酶的能力均较强。菌株G1、G10、G14和G23具有产HCN能力。
7株菌株中只有3株菌株检测到产IAA能力,其中G14产IAA产能力最强(129.20 mg/L),G1和G21产IAA能力较弱(分别为10.22和13.39 mg/L),G14产IAA能力显著高于G1和G21(P<0.05,下同)。菌株G23分解1-氨基环丙烷-1-羧酸(ACC)效果最明显,菌株G12、G14、G20和G21居中,G1和G10分解ACC效果不明显。
2. 3 拮抗菌株对甘蔗黑穗病发病率及甘蔗出苗率和生物量的影响
2. 3. 1 不同接菌处理对甘蔗黑穗病发病率和出苗率的影响 选取拮抗能力较强的菌株G1、G10、G12和G23进行拮抗菌株对甘蔗黑穗病发病率及甘蔗出苗率和生物量的影响测定。由表3可知,4株拮抗甘蔗黑穗病菌菌株处理均可有效抑制甘蔗黑穗病的发生,各处理的发病率均显著低于CK2处理,其中CK2+G10和CK2+G23处理未发生黑穗病,CK2+G1和CK2+G12处理的发病率较CK2处理分别降低70.46%和77.27%;同时观察到拮抗菌株处理可延缓黑穗病的发生,其中CK2+G1和CK2+G12处理的发病时间较CK2处理分别推迟25和40 d。与CK2处理相比,CK2+G1、CK2+G10、CK2+G12和CK2+G23处理均不同程度地提高了甘蔗的出苗率,分别较CK2处理提高27.76%、13.23%、11.02%和17.18%,但均低于CK1处理。
2. 3. 2 不同拮抗菌株处理对甘蔗生物量的影响
由表4可知,与CK2处理相比,除CK2+G1处理甘蔗根的鲜重、CK2+G1和CK2+G10处理甘蔗根的干重差异不显著外(P>0.05),不同拮抗菌处理均显著提高了甘蔗茎、根的干重和鲜重,而CK1处理甘蔗茎的鲜重和干重较CK2处理分别增加85.16%和134.12%。黑穗病菌+拮抗菌各处理间茎的鲜重和干重均达显著差异水平,生物量大小排序為CK2+G23>CK2+G12>CK2+G1>CK2+G10,其中CK2+G23处理甘蔗茎的鲜重和干重较CK1处理分别提高8.29%和10.32%。各处理对甘蔗根鲜重影响以CK2+G23处理最高,其次是CK1和CK2+G12处理;对甘蔗根干重的影响以CK2+G23、CK1和CK2+G12处理最高,且与CK2处理达显著差异水平。
3 讨论
微生物生物防治具有对环境无化学污染、低成本、自然资源丰富的优点,被认为是最具发展潜力的防治方法之一(郝晓娟等,2007;程欢欢等,2019)。从甘蔗根际土壤分离的枯草芽孢杆菌HAS对黑穗病菌具有较强的抑制作用,对甘蔗黑穗病的防效可达100%,表明HAS是一株在防治甘蔗黑穗病上具有潜在意义的生防菌株(熊国如等,2013a,2013b)。Liu等(2017)从甘蔗体内分离获得119株拮抗甘蔗黑穗病的细菌分离物,其中ST4对甘蔗黑穗病防治效果明显,特别是进行细菌接种时添加2%葡萄糖可显著提高ST4对甘蔗黑穗病的生物防治效率。本课题组前期的研究也证实从甘蔗不同部位及根际获得的促生长菌株具有多种生防潜能(Wang et al.,2019;余卓新,2020;Guo et al.,2020;Singh et al.,2021a,2021b)。本研究采用平板对峙培养法从甘蔗根际土壤中分离获得68株细菌菌株,进一步筛选获得7株甘蔗黑穗病生防拮抗细菌,其中有4株菌株对黑穗病的抑菌率在50.00%以上,而其中的G1、G10和G23均属于伯克霍尔德氏菌属,首次揭示了伯克霍尔氏菌属在甘蔗生物防治中的应用潜能。
由于根际或植物内生促生细菌与植物有相似的生态位,是适宜的生物防治剂,其除了具有拮抗特性外,还具有促进植物生长特性(Wang et al.,2019;Guo et al.,2020)。用几丁质培养基筛选拮抗细菌,获得对甘蔗黑穗病有拮抗特性细菌的机会较大。据报道,裂解真菌的细菌一般都产生几丁质酶,该酶可降解真菌菌丝,因此可控制土传病害(孔庆科和丁爱云,2001)。本研究中分离筛选获得的7株黑穗病拮抗细菌均具有产几丁质酶和纤维素酶能力,PGPR特性的嗜铁、溶解有机磷、产蛋白酶能力也较强。蛋白酶可抑制许多病原真菌生长,是生防菌发挥拮抗作用的基础(Ghorbel et al.,2003)。Wei等(1991)曾对6株诱导抗病性菌株进行产HCN试验,其中有4株产HCN,认为HCN可能与细菌生防作用有关。HCN因其对植物病原体的毒性而被公认为是一种生物防治剂(Tomaž and Aleš,2016)。本研究发现伯克霍尔氏菌属菌株均具有产HCN能力,但这些细菌产生的氰化物是否对植病生防产生诱导抗性仍需继续研究。有些土壤微生物在以ACC为唯一氨源的培养基上可诱导产生ACC脱氨酶,把乙烯生物合成的关键中间前体ACC分解为α丁酮酸和氨,从而抑制乙烯合成,减少乙烯排放有利于维持植物旺盛生长,延缓衰老。有些促植物生长的根际细菌定殖到植物组织后,可产生IAA,从而促进植物生长(刘晓瑞,2017)。本研究筛选获得的黑穗病拮抗细菌菌株G23表现出较强的ACC脱氨酶活性,但不产生IAA;而G14产IAA能力特别强,但ACC脱氨酶活性中等。可见,不同的甘蔗黑穗病拮抗细菌菌株的促植物生长特性有明显差异,各有所长。本研究中,以G23的综合表现最好,不仅具有较强的拮抗甘蔗黑穗病菌能力,而且具有优良的促植物生长特性,接种甘蔗后防治黑穗病和增加甘蔗生物量均表现最好,表现出良好的潜在应用价值,但正如Subedi等(2020)指出,生防细菌在室内试验所表现的拮抗作用不一定与田间防效成正相关。因此,本研究中筛选出的黑穗病拮抗菌株的防治效果还需在田间自然环境下进一步系统验证。
4 结论
从甘蔗根际土壤中分离获得7株对黑穗病菌拮抗效果较好的菌株,均具有不同程度的促植物生长特性,其中以菌株G23对甘蔗黑穗病的防治效果和促进植物生长能力最突出,表现出良好的潜在应用价值。
参考文献:
曹媛媛,陈春,郭婷婷,钱叶,张程飞,何相怡,李婷,Lay Khien Duc,唐欣昀,邵文韬,王晓波,邱丽娟. 2019. 亲和性促生菌DW12-L的定殖及其对大豆生长的影响[J]. 江苏农业学报,35(4):776-783. [Cao Y Y,Chen C,Guo T T,Qian Y,Zhang C F,He X Y,Li T,Lay K D,Tang X Y,Shao W T,Wang X B,Qiu L J. 2019. Colonization of soybean affinity rhizobacteria strain DW12-L and its effects on soybean growth[J]. Jiangsu Journal of Agricultural Scien-ces,35(4):776-783.] doi:10.3969/j.issn.1000-4440.2019. 04.004.
陈庆河,翁启勇,何玉仙,谢世勇. 1998. 大白菜健、病株根际细菌荧光反应及产HCN能力比较研究[J]. 福建农业学报,13(2):30-32. [Chen Q H,Weng Q Y,He Y X,Xie S Y. 1998. The comparative studies on fluorescence reaction and HCN production of the health and diseased Chinese cabbage[J]. Fujian Journal of Agricultural Sciences,13(2):30-32.] doi:10.19303/j.issn.1008-0384.1998.02. 007.
程欢欢,余水,姚伟伟,李忠,彭丽娟,丁海霞. 2019. 辣椒炭疽病生防芽孢杆菌的筛选及田间防效[J]. 河南农业大学学报,53(4):568-573. [Cheng H H,Yu S,Yao W W,Li Z,Peng L J,Ding H X. 2019. Screening of antagonistic Bacillus strains and control effect against pepper anthracnose in field trial[J]. Journal of Henan Agricultural University,53(4):568-573.] doi:10.16445/j.cnki.1000-2340. 2019.04.012.
郝晓娟,刘波,谢关林. 2007. 植物枯萎病生物防治研究进展[J]. 中国农学通报,21(7):319-323. [Hao X J,Liu B,Xie G L. 2007. Research progress in biological control of Fusarium wilt disease[J]. Chinese Agricultural Science Bulletin,21(7):319-323.] doi:10.3969/j.issn.1000-6850.2005. 07.095.
黄家雍,何红,闭少玲,张革民,梁丽琼. 2001. 抗黑穗病甘蔗优良品系的筛选[J]. 广西蔗糖,(1):6-8. [Huang J Y,He H,Bi S L,Zhang G M,Liang L Q. 2001. Selection of sugarcane clones with smut-resistant[J]. Guangxi Sugarcane & Canesugar,(1):6-8.] doi:10.3969/j.issn.1007-4732. 2001.01.002.
孔庆科,丁爱云. 2001. 内生细菌作为生防因子的研究进展[J]. 山东农业大学学报(自然科学版),32(2):256-260. [Kong Q K,Ding A Y. 2001. Advances of study on endophytic bacteria as biological control agents[J]. Journal of Shandong Agricultural University(Natural Science),32(2):256-260.] doi:10.3969/j.issn.1000-2324.2001.02.029.
李杨瑞. 2010. 现代甘蔗学[M]. 北京:中国农业出版社:371-374. [Li Y R. 2010. Modern sugarcane science[M]. Beijing:China Agriculture Press:371-374.]
刘晓瑞. 2017. 吲哚乙酸(IAA)产生菌的筛选鉴定及生物炭负载菌株的研究[D]. 杭州:浙江大学. [Liu X R. 2017. Screening,identification of Indole-3-acetic acid(IAA) producing bacteria and the application of biochar as carrier material for the bacteria[D]. Hangzhou:Zhejiang University.]
罗含敏,周慧文,闫海锋,周忠凤,范业赓,罗霆,陈荣发,段维兴,刘俊仙,丘立杭,吴建明. 2020. 甘蔗产量形成的要素及其化控措施[J]. 广西糖业,(4):8-14. [Luo H M,Zhou H W,Yan H F,Zhou Z F,Fan Y G,Luo T,Chen R F,Duan W X,Liu J X,Qiu L H,Wu J M. 2020. The key factors of affecting the sugarcane yield formation and its chemical control strategies[J]. Guangxi Sugar Industry,(4):8-14.] doi:10.3969/j.issn.1007-4732.2020.04.002.
韦金菊,宋修鹏,魏春燕,张小秋,黄伟华,颜梅新. 2019. 甘蔗黑穗病及其防治研究进展[J]. 广东农业科学,46(4):81-88. [Wei J J,Song X P,Wei C Y,Zhang X Q,Huang W H,Yan M X. 2019. Research progress on sugarcane smut and its control[J]. Guangdong Agricultural Sciences,46(4):81-88.] doi:10.16768/j.issn.1004-874X.2019.04.012.
熊國如,伍苏然,张树珍,杨本鹏,冯翠莲,蔡文伟,王俊刚,王文治. 2013a. 枯草芽孢杆菌HAS及其在防治甘蔗黑穗病中的应用:中国,201210452707.7[P]. 2013-01-30. [Xiong G R,Wu S R,Zhang S Z,Yang B P,Feng C L,Chai W W,Wang J G,Wang W Z. 2013a. Bacillus subtilis HAS and its application in the control of sugarcane smut:China,201210452707.7[P]. 2013-01-30.]
熊国如,赵更锋,伍苏然,冯翠莲,张树珍. 2013b. 甘蔗黑穗病菌拮抗菌HAS的筛选和鉴定[J]. 热带作物学报,34(6):1149-1154. [Xiong G R,Zhao G F,Wu S R,Feng C L,Zhang S Z. 2013b. Screening and identification of a biocontrol strain,HAS antagonistic to Sporisorium scitaminea Syd[J]. Chinese Journal of Tropical Crops,34(6):1149-1154.] doi:10.3969/j.issn.1000-2561.2013.06.027.
余卓新. 2020. 甘蔗內生芽孢杆菌的分离鉴定及其促生机制研究[D]. 南宁:广西大学. [Yu Z X. 2020. Isolation and characterization of endobacillus from sugarcane and study on the plant growth promoting mechanism[D]. Nanning:Guangxi University.] doi:10.27034/d.cnki.ggxiu.2020. 000427.
张旭娜. 2020. 两株甘蔗内生细菌对甘蔗鞭黑粉菌的作用研究[D]. 广州:仲恺农业工程学院. [Zhang X N. 2020. Effects of two sugarcane endophytic bacteria on Sporisorium scitanmineum[D]. Guangzhou:Zhongkai University of Agricultural and Engineering.]
Cui W Y,He P J,He P B,Li X Y,Li Y M. 2019. Efficacy of plant growth promoting bacteria Bacillus amyloliquefaciens B9601-Y2 for biocontrol of southern corn leaf blight[J]. Biological Control,139:104080. doi:10.1016/j.biocontrol.2019.104080.
Etesami H,Maheshwari D K. 2018. Use of plant growth promoting rhizobacteria(PGPRs) with multiple plant growth promoting traits in stress agriculture:Action mechanisms and future prospect[J]. Ecotoxicology and Environmental Safety,156:225-246. doi:10.1016/j.ecoenv.2018.03. 013.
Ghorbel B,Sellami-Kamoun A,Nasri M. 2003. Stability studies of protease from Bacillus cereus BG1[J]. Enzyme and Microbial Technology,32(5):513-518. doi:0.1016/S0141-0229(03)00004-8.
Glick B R,Liu C P,Ghosh S,Dumbroff E B. 1997. Early development of canola seedlings in the presence of the plant growth-promoting rhizobacterium Pseudomonas putida GR12-2[J]. Soil Biology & Biochemistry,29(8):1233-1239. doi:10.1016/S0038-0717(97)00026-6.
Guo D J,Singh R K,Singh P,Li D P,Sharma A,Xing Y X,Song X P,Yang L T,Li Y R. 2020. Complete genome sequence of Enterobacter roggenkampii ED5,a nitrogen fixing plant growth promoting endophytic bacterium with biocontrol and stress tolerance properties,isolated from sugarcane root[J]. Frontiers in Microbiology,11:580081. doi:10.3389/fmicb.2020.580081.
Izadi M B,Moosawi-Joff S A. 2007. Isolation and identification of yeast-like and mycelial colonies of Ustilago seitaminea using specific primers[J]. Asian Journal of Plant Sciences,6(7):1137-1142. doi:10.3923/ajps.2007.1137. 1142.
Jayakumar V,Sundar A R,Viswanathan R. 2019. Biological suppression of sugarcane smut with endophytic bacteria[J]. Sugar Tech,21(3):653-660. doi:10.1007/s12355-018-0684-1.
Juma E O A,Musyimi D M,George O. 2018. Antagonistic potential of selected fungal and bacterial isolates from rhizosphere of sugarcane variety Co 421 against Sporisorium scitamineum in Kibos,Kisumu County,Kenya[J]. Applied Science Reports,23(1):7-15. doi:10.15192/PSCP.ASR.2018.23.1.715.
Lal R J,Sinha, O K,Bhatnagar S,Lal S,Awasthi S K. 2009. Biological control of sugarcane smut(Sporisorium scitamineum) through botanicals and Trichoderma viride[J]. Sugar Tech,11(4):381-386.
Lane D J. 1991. 16S/23S rRNA sequencing[M]//Stackebrandt E,Goodfellow M. Nucleic acid techniques in bacterial systematic. New York:John Wiley and Sons:115-175.
Li Y R,Song X P,Wu J M,Li C N,Liang Q,Liu X H,Wang W Z,Tan H W,Yang L T. 2016. Sugar industry and improved sugarcane farming technologies in China[J]. Sugar Tech,18(6):603-611. doi:10.1007/s12355-016-0480-8.
Liu S Y,Lin N,Chen Y,Liang Z B,Liao L S,Lü M F,Chen Y F,Tang Y X,He F,Chen S H,Zhou J N,Zhang L H. 2017. Biocontrol of sugarcane smut disease by interference of fungal sexual mating and hyphal growth using a bacterial isolate[J]. Frontiers in Microbiology,8:778. doi:10. 3389/fmicb.2017.00778.eCollection 2017.
Schenck S,Pear H M,Liu Z,Moore P H,Ming R. 2005. Genetic variation of Ustilago seitaminea pathotypes in Hawaii evaluated by host range and AFLP marked[J]. Su-garcane International,23(1):15-19.
Schwyn B,Neilands J B. 1987. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry,160(1):47-56. doi.org/10.1016/0003-2697(87)90612-9.
Singh P,Singh R K,Guo D J,Sharma A,Singh R N,Li D P,Malviya M K,Song X P,Lakshmanan P,Yang L T,Li Y R. 2021a. Whole genome analysis of sugarcane root-associated endophyte Pseudomonas aeruginosa B18,a plant growth-promoting bacterium with antagonistic potential against Sporisorium scitamineum[J]. Frontiers in Microbiology,12:628376. doi:10.3389/fmicb.2021.628376.
Singh P,Singh R K,Li H B,Guo D J,Sharma A,Lakshmanan P,Malviya M K,Song X P,Solanki M K,Verma K K,Yang L T,Li Y R. 2021b. Diazotrophic bacteria Pantoea dispersa and Enterobacter asburiae promote sugarcane growth by inducing nitrogen uptake and defense-related gene expression[J]. Frontiers in Microbiology,11:600417. doi:10.3389/fmicb.2020.600417.
Solanki M K,Singh R,Srivastava S,Kumar S,Kashyap P L,Srivastava A K,Arora D K. 2014. Isolation and characte-rization of siderophore producing antagonistic rhizobacteria against Rhizoctonia solani[J]. Journal of Basic Microbiology,54(6):585-597. doi:10.1002/jobm.201200564.
Subedi N,Taylor C G,Paul P A,Miller S A. 2020. Combining partial host resistance with bacterial biocontrol agents improves outcomes for tomatoes infected with Ralstonia pseudosolanacearum[J]. Crop Protection,135:104-119. doi:10.1016/j.cropro.2019.03.024.
Tomaž R,Aleš L. 2016. Hydrogen cyanide in the rhizosphere:Not suppressing plant pathogens,but rather regulating availability of phosphate[J]. Frontiers in Microbiology,7:1785. doi:10.3389/fmicb.2016.01785.
Velazhahan R,Samiyappan R,Vidhyasekaran P. 1999. Relationship between antagonistic activties of Pseudomonas fluorescens isolates against Rhizoctonia solani and their production of lytic enzymes[J]. Plant Disease and Protection,106(3):244-250.
Wang Z,Yu Z X,Solanki M K,Solanki M K,Yang L T,Xing Y X,Dong D F,Li Y R. 2019. Diversity of sugarcane root-associated endophytic Bacillus and their activities in enhancing plant growth[J]. Journal of Applied Microbio-logy,128:814-827. doi.org/10.1111/jam.14512.
Wei G,Kloepper J W,Tuzun S. 1991. Induction of systemic resistance of cucumber to Colletotrichum orbiculare by select strains of plant growth-promoting rhizobacteria[J]. Phytopathology,81(12):1508-1512. doi:10.1094/Phyto-81-1508.
收稿日期:2021-05-16
基金項目:国家自然科学基金项目(31971858,31560352);广西科技基地和人才专项(桂科AD17195100);国家现代农业产业技术体系广西甘蔗创新团队项目(gjnytxgxcxtd-03-01)
通讯作者:邢永秀(1972-),https://orcid.org/0000-0001-7062-0342,博士,副教授,主要从事甘蔗生理与分子生物学及甘蔗生物固氮研究工作,E-mail:document126@126.com;李杨瑞(1957-),https://orcid.org/0000-0002-7559-9244,博士,教授,博士生导师,主要从事甘蔗栽培及育种研究工作,E-mail:liyr@gxaas.net
第一作者:谢光杰(1994-),https://orcid.org/0000-0001-8054-1007,研究方向为甘蔗黑穗病拮抗细菌,E-mail:2788853256@qq.com

