高脂饮食上调兔子血管内膜与血清炎性因子表达*
赵海专 袁明杰 余 波
高脂饮食诱导动脉粥样硬化模型通常被用来研究心血管疾病的相关机制[1,2]。动脉粥样硬化引起心血管疾病的死亡率逐渐增加[3],且发病年龄有年轻化的趋势[4],是临床关注的热点之一,但其发病机制还不明确。研究认为动脉粥样硬化的变化过程是多因素作用的结果,炎症是其中一个重要原因[5-7]。高脂饮食是引起肥胖的因素之一,肥胖者易发动脉粥样硬化相关心血管疾病[8]。但高脂饮食引起血管内皮细胞损伤或功能障碍而致炎症反应还未见明确的报道。本实验利用高脂饮食诱导兔子动脉粥样硬化造模,分析高脂饮食与炎症反应的关系,为预防肥胖或动脉粥样硬化提供数据参考。
1 材料与方法
1.1 动物造模和分组
12只健康新西兰兔子,雌雄各半,体重2.50±0.35kg,购于湖北省医学实验动物中心(SCXK(鄂)2019-0004)。所有兔子购回后饲养于本院SPF级实验动物中心。维持室温25℃±2℃,相对湿度为45%—60%,12h光照/黑暗交替。将12只兔子平分为两组:普通饮食组 (OD组,n=6)和高脂饮食组 (HFD组,n=6)。普通饲料主要包括玉米、麦麸、豆粕、鱼粉、壳粉、食盐和复合维生素。高脂饮食配方在普通饲料的基础上增加了蛋黄粉、胆固醇和猪油,所有兔子饲养8周后,耳静脉逐渐注射戊巴比妥麻醉后抽血液,随后处死取颈动脉。
1.2 实验室相关指标检测
兔子麻醉后经耳静脉采集血液8.0ml ,其中2.0ml置入EDTA-K2抗凝管中,混匀使用SYSMEX NE-9000型全自动血球分析仪及配套试剂(日本希森美康公司)检测血细胞相关参数:包括白细胞(WBC)、红细胞(RBC)、血红蛋白(HB)、红细胞压积(HCT)、血小板(PLT)等,另6.0ml血置入促凝剂管中,以3000转/min离心10min分离血清,分别使用ADVIA-2400型全自动血液生化分析仪(德国西门子公司)检测血液生化参数:包括总蛋白(TP)、白蛋白(ALB)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、肌酸激酶(CK)、乳酸脱氢酶(LDH)、尿素氮(BUN)、肌酐(CREA)、血糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A(ApoA)、载脂蛋白B(ApoB)、载脂蛋白小α[Lp(α)],以及ELISA法检测血清炎性因子水平:包括白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)浓度,试剂盒为上海通蔚生物科技有限公司生产(IL-1β货号:TWp027836,TNF-α货号:TWp028087);酶标仪为迈瑞医疗器械公司全自动酶标仪MR-96A,所有检测均由本院检验科按操作手册说明书进行。
1.3 组织病理学观察
兔子处死后,取颈动脉常规石蜡包埋,4μm连续切片,用苏木精和伊红(HE)染色,由专业的病理学科医师阅片。使用Axiophot显微镜(德国蔡司公司)和数码相机(Leaf Systems Lumina, 日本玛米亚利图公司)拍摄图像。采用图像处理软件(Version 6.5, Media Cybernetics, 美国Silver Springs公司)分析血管内膜平均厚度。
1.4 Western Blot分析蛋白表达[9]
颈动脉组织用1ml裂解液充分裂解,4℃、12 500g离心15min取上清。使用BCA蛋白质分析试剂(Pierce Com, Rockford, IL, USA)测定蛋白质浓度。将每个样品的等量裂解蛋白(20μg)装载在7.5%十二烷基硫酸钠-聚丙烯酰胺凝胶上进行电泳,然后将条带转移到聚偏二氟乙烯膜上(Amersham Pharmacia Biotech, Piscataway, NJ, USA)。室温下用3%牛血清白蛋白在Tris缓冲盐液中阻断与膜的非特异性结合1h。 然后在4℃下与不同的一抗抗体孵育过夜,抗IL-1β兔多克隆抗体(上海艾博抗,编号ab2105),抗TNF-α兔多克隆抗体(深圳子科生物科技有限公司,编号ZIKER-0078R)和抗GAPDH(Santa Cruz, CA,美国. 编号sc-25778)。辣根过氧化物酶结合山羊抗兔IgG2a二抗(Santa Cruz, CA, 美国. 编号sc-2061)孵育2h。通过Bio-Rad GelDoc XR和Chemi-Doc XRS系统(Bio-Rad,Hercules,美国Bio-Rad公司)扫描蛋白质条带,并使用Quantity One一维分析软件(Version 4.6.3,美国Bio-Rad公司)进行分析。以目标蛋白与GAPDH蛋白条带灰度值的比值表示该目标蛋白的相对表达量。
1.5 统计学处理
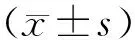
2 结 果
2.1 两组兔子各项血液参数结果比较
两组血液学指标检测结果见表1。与OD组比较,HED组TG、TC、LDL-C、ApoB、IL-1β和TNF-α水平均升高,而HDL-C水平降低,差异均有统计学意义(P<0.05或P<0.01),两组其它指标差异无统计学意义(P>0.05)。
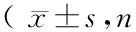
表1 不同组血液参数检测均=6)
2.2 两组兔子血管内膜厚度比较
HFD组血管内膜厚度明显高于OD组(2.34±0.08mm vs 1.73±0.11mm),差异有统计学意义(t=4.93 ,P<0.01)。见图1。
2.3 两组兔子血管内膜TNF-α和IL-1β蛋白表达比较
HFD组TNF-α蛋白表达高于OD组(0.51±0.03 vs 0.25±0.02)。IL-1β 蛋白表达亦高于OD组(0.42±0.02 vs 0.22±0.03),差异均有统计学意义(t=6.22、 6.27,P<0.01)。见图2。
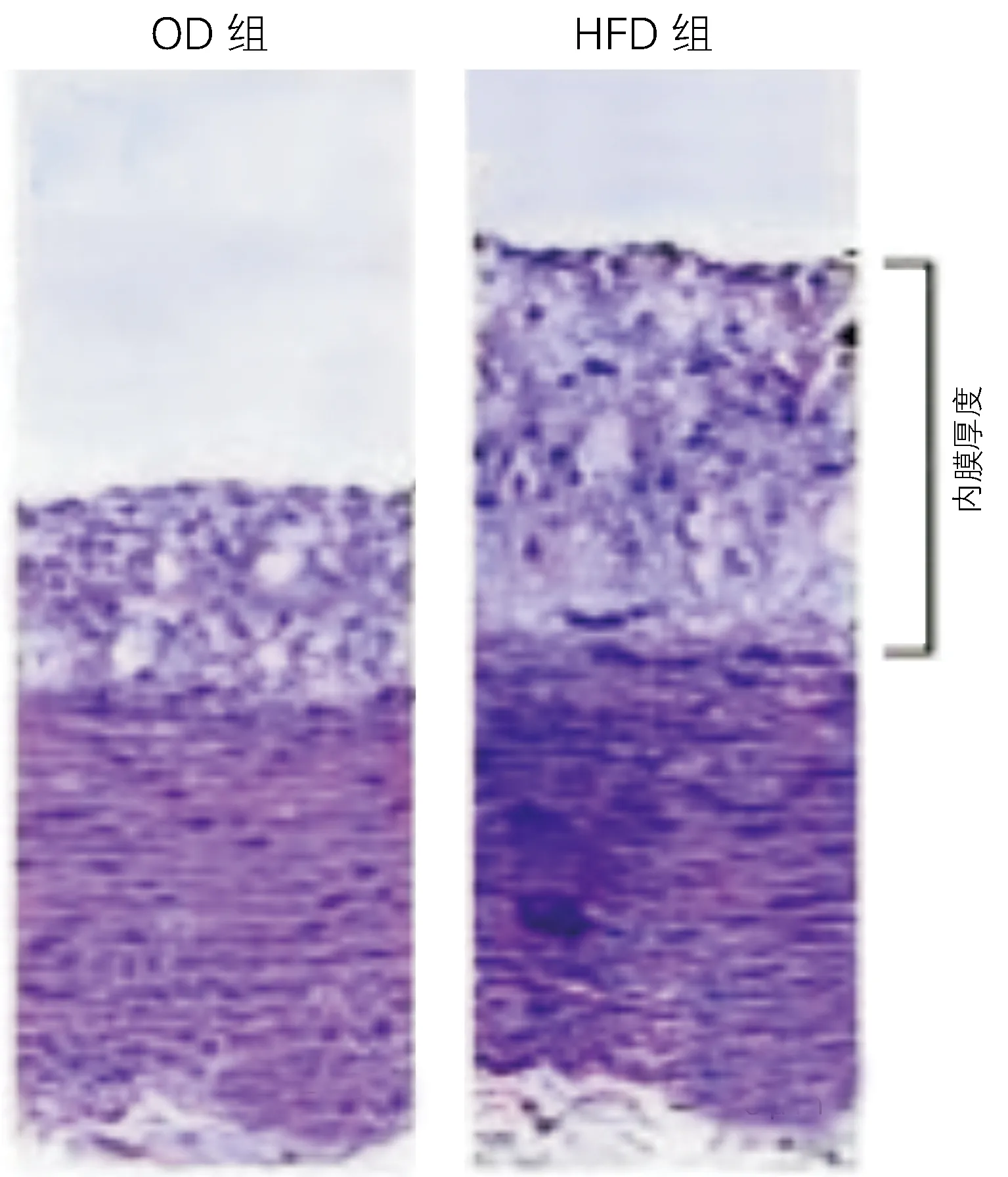
图1 两组兔子血管内膜厚度
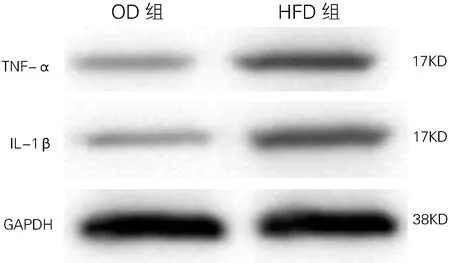
图2 两组兔血管内膜IL-1β和TNF-α蛋白表达(Western Blot)
3 讨 论
高脂饮食已经成为许多人的日常饮食常态,特别是年轻人。但长期高脂饮食容易引发多种疾病,例如糖尿病、肥胖、心血管疾病、胆囊炎和癌症等[9,10]。高脂饮食引起肥胖和动脉粥样硬化被临床重点关注[2]。流行病学调查研究显示高脂饮食人群肥胖和动脉粥样硬化发病率明显高于普通饮食者[8,10]。高脂饮食与肥胖和动脉粥样硬化可能存在一定的相关性。
本研究结果揭示高脂饮食可上调兔子血管内膜炎性因子的表达。以高脂饮食诱导动脉粥样硬化模型为研究对象,我们发现高脂饮食不仅影响一些常规血脂指标的改变,而且上调血液炎性因子IL-1β和TNF-α水平,且Western blot检测显示增生的血管内膜IL-1β和TNF-α蛋白表达增加。提示高脂饮食可以引起炎性因子水平的变化,或可予动脉粥样硬化有关。
本研究高质饮食可引起血液脂质检测参数的改变,实验结果发现高脂饮食兔子体重明显高于普通饮食的兔子,说明了高脂饮食与引发肥胖有关,但对于高脂饮食引起肥胖的明确机理还不清楚。
有研究表明炎性因子IL-1β和TNF-α高表达引起血管内膜的增生[13-15],此与HFD实验组兔子血管内膜增生明显高于OD组一致。TNF-α高表达还引起细胞的凋亡或组织的坏死[15],炎性因子水平升高可能与动脉粥样硬化引起血管内皮的损伤、坏死或破裂相关。因此,即高脂饮食可能通过上调炎性因子IL-1β和TNF-α高表达引起肥胖或动脉粥样硬化。
本研究的结果还存在一些不足之处:1)虽然观察到高脂饮食可上调炎性因子水平,但高脂饮食上调炎性因子的机理未知;2)实验研究检测的仅仅是颈总动脉内膜,其它器官组织未作检测。3)是否还存在着其它因素影响实验结果还未明确;4)炎性因子种类多,各因子作用不一样,本研究只检测IL-1β和TNF-α因子。
综上所述,高脂饮食影响血脂指标,可能是高脂饮食脂质代谢紊乱相关,导致肥胖的重要原因之一。 同时高脂饮食促进血液炎性因子IL-1β和TNF-α水平增高,且明显上调血管内膜炎性因子IL-1β和TNF-α的表达,但高脂饮食上调炎性因子的机理尚不清楚,有待进一步的研究。

