Gd-EOB-DTPA增强MRI对肝细胞癌术后早期复发的预测价值
赵其煜,戚元刚,郭守芳,张洪,刘浅浅,陈盈秀,姬慧君,李万湖*
作者单位:1.山东第一医科大学附属肿瘤医院(山东省肿瘤医院)影像科,济南250117;2.山东第一医科大学(山东省医学科学院),济南250117
肝细胞癌(hepatocellular carcinoma,HCC)是癌症相关死亡的主要原因之一,严重威胁人类健康的疾病。对于肝功能保存良好的HCC患者,根治性切除术是主要治疗方法[1]。然而,由于HCC由肝动脉及门静脉双重血供、侧支循环形成等因素导致HCC难以完全坏死[2],存在复发率高的风险。高达70%的HCC 患者在术后五年内出现复发[3],而HCC根治性切除术后1年内的早期复发(early recurrence,ER)与预后不良密切相关[4]。以往的研究已经确定了一些病理因素来预测HCC 术后ER,如微血管侵犯、组织学分级和血管内癌栓等[5-7]。然而,这些病理特征只能在术后评估。磁共振成像已成为诊断HCC的重要非侵入性工具,通过术前MRI 特征及定量参数评估ER 的应用仍然有限。本研究创新性地引入参数病灶与肝脏对比增强比(lesion-to-liver contrast enhancement ratio,LLCER)评估术后ER,弥补了这些局限性。钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)是一种肝细胞特异性对比剂,静脉注射可增加MRI肝实质的对比度[8],从而提高病变的检出率。基于此,本研究旨在探讨术前Gd-EOB-DTPA 增强MRI 影像特征及定量参数对HCC 术后ER的预测价值。
1 材料与方法
1.1 研究对象
回顾性分析2016 年1 月至2020 年5 月在山东第一医科大学附属肿瘤医院行HCC 根治性切除术的患者资料。纳入标准:(1) HCC 根治性切除术前未接受过放化疗、消融及栓塞等治疗;术后经病理证实为HCC;(2)术前均进行了Gd-EOB-DTPA增强MRI扫描;(3)术后定期随访至少1年。排除标准:(1)存在其他严重影响患者生存期的疾病;(2)肿瘤侵犯门静脉或静脉者;(3)术后合并其他恶性肿瘤和(或)远处脏器转移者。
最终本研究纳入68 例术前完成Gd-EOB-DTPA 增强MRI 且病理证实为HCC 的患者,其中术后随访ER者18 例为ER 组,无ER 者50 例为对照组。收集两组患者的临床资料,包括性别、年龄、Child-Pugh分级、甲胎蛋白(alpha-fetoprotein,AFP)水平、乙型病毒性肝炎病史、病理分级。 根据Edmondson-Steiner 病理分级系统[9]将HCC 分为Ⅰ~Ⅳ级,非低分化(高分化、中分化)HCC为Ⅰ、Ⅱ级,低分化HCC为Ⅲ、Ⅳ级。本研究经过山东第一医科大学附属肿瘤医院(山东省肿瘤医院)医学伦理委员会批准(批准文号:SDTHEC-2021008008),免除受试者知情同意。
1.2 术后随访
所有患者术后1 年内每隔2 个月定期随访一次,复查肝功能、AFP 水平及腹部超声等指标监测复发情况,当AFP 水平升高或超声发现新病灶时,进一步行腹部增强CT 或MRI 评估。肝内复发定义为残肝内出现新病灶,经穿刺或二次手术病理证实为复发,或具有典型的影像学特征,显示为肝动脉期病灶增强并且在门静脉或延迟期强化减低。ER 定义为根治性手术切除后1年内复发[10]。
1.3 MRI检查
1.3.1 检查方法
采用荷兰Philips Ingenia 3.0 T 超导型磁共振扫描仪,使用8通道腹部相控阵线圈采集图像。常规MRI扫描序列包括:横断面T1WI、抑脂T2WI和DWI。扫描参数如下:T1WI:TR 495 ms,TE 10 ms,FOV 340 mm;抑脂T2WI:TR 4213 ms,TE 120 ms,FOV 340 mm;DWI:采用平面回波成像技术,TR 7099 ms,TE 5 ms,FOV 340 mm,b 值分别取0 和800 s/mm2。对于Gd-EOB-DTPA 增强MRI,获得平扫、增强的动脉期(20~35 s)、门静脉期(60 s)、移行期(3 min)和20 min的肝胆期(hepatobiliary phase,HBP)图像。采用增强T1 高分辨率各向同性容积采集(enhanced T1 high-resolution isotropic volume excitation,e-THRIVE)序列,使用MR透视团注检测技术确定动脉期成像的时机,以2 mL/s的速度经高压注射器自动静脉注射对比剂Gd-EOB-DTPA (德国拜耳医药保健有限公司,10 mL/瓶,181.43 g/L),总剂量为0.025 mmol/kg,随后立即用20 mL生理盐水冲洗导管。
1.3.2 图像分析
所有患者采集的图像均传送至荷兰Philips 工作站,由2名经验丰富的诊断医师(分别为工作5年的住院医师和工作15 年的副主任医师)共同对病灶进行分析,2 名医生均知道病变为HCC,但对临床特征、实验室检查、病理分级和术后随访情况不知。双方经协商达成一致,若对结果有异议,由第3 名工作30年的主任医师给出最终判断。观察以下指标:(1)病灶大小:在病灶边缘界定最清晰的序列中,每个病灶在轴位平面上的最大直径;(2)病灶形态:根据病灶的边缘轮廓,分为类圆形和不规则形;(3) HBP瘤周低信号:位于肝胆期病灶边缘外的肝实质内不规则楔形或火焰状低信号区域[11];(4)卫星结节:与主病灶具有相似MRI 特征且<2 cm 的病灶,位于主病灶周围2 cm 以内[12];(5) HBP 病灶与肝脏对比增强比(LLCER):使用ROI 的圆形区域测量HCC 和邻近肝实质的平均信号强度(signal intensities,SI),HCC 的ROI 尽可能地放置在病灶的范围内,而邻近肝实质的ROI 大于1.5 cm2,并且没有局灶性信号改变和大血管的影响。LLCER=[(SITpost/SILVpost)-(SITpre/SILVpre)]/(SITpre/SILVpre),SITpre、SITpost、SILVpre和SILVpost分别对应于平扫和HBP图像上病灶和肝实质的信号强度。
1.4 统计分析
应用SPSS 24.0 软件进行统计学分析。符合正态分布的计量资料用±s表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料用中位数(四分位数) [M (P25~P75)]表示,两组间比较采用Mannn-whitneyU检验。两组间计数资料的比较采用χ²检验。Logistic 回归分析筛选HCC 术后ER独立预测因素并构建预测模型。ROC 曲线评估预测模型的诊断价值。P<0.05 为差异有统计学意义。
2 结果
2.1 参数LLCER值对病理分级的预测
共纳入68 例HCC 行根治性切除术的患者,其中非低分化HCC 47 例,低分化HCC 21 例。对于参数LLCER值,在非低分化HCC和低分化HCC中测量值分别为-20.287±12.141、-27.581±11.374 (P=0.023)。
2.2 ER组和对照组临床及影像资料的组间比较
两组患者间的性别、年龄、Child-Pugh 分级、AFP水平、乙型病毒性肝炎病史、病灶大小差异无统计学意义,P>0.05 (表1、2)。两组在病理分级、病灶形态、HBP 瘤周低信号、卫星结节及参数LLCER 值的比较,差异有统计学意义,其中ER 组患者LLCER 值低于对照组,P<0.05 (表1、2,图1)。
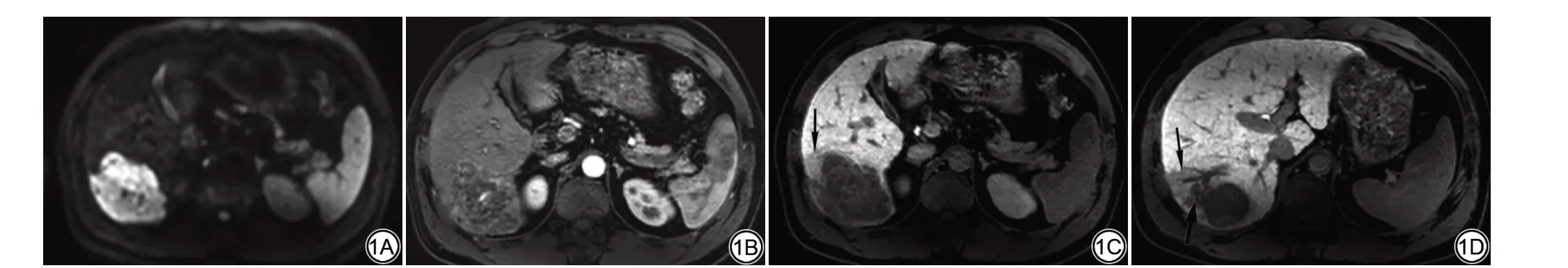
图1 男,58 岁,肝右叶低分化HCC,术后6 个月发现复发。术前肝右叶示一不规则形肿块,A:DWⅠ(b 值=800 s/mm2)呈高信号;B:动脉期病灶周围不规则环形强化;C:肝胆期示瘤周低信号(细箭);D:肝胆期示瘤周低信号(细箭)和卫星结节(粗箭)Fig.1 A 58-year-old male with poorly differentiated HCC in the right lobe of the liver was found to have recurrence 6 months after resection.Before the resection,the right lobe of the liver showed an irregular mass.A:DWⅠ(b=800 s/mm2)showed high signal;B:Ⅰrregular ring enhancement around the lesion in the arterial phase;C: Hepatobiliary specific phase showed low signal around tumor (thin arrow); D: Hepatobiliary specific phase showed low signal around tumor (thin arrow) and satellite nodules(thick arrow).

表1 ER组和对照组患者的临床特征比较Tab.1 Comparison of clinical characteristics between ER group and control group
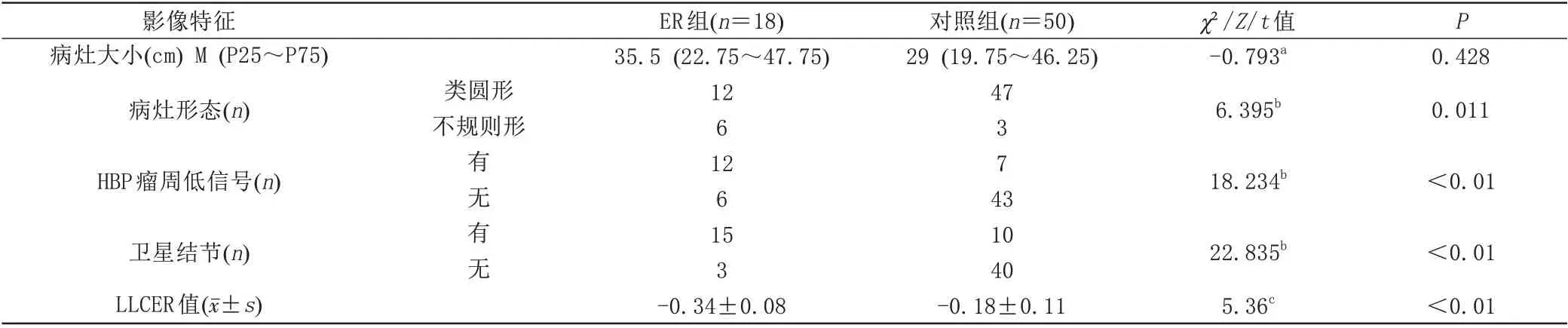
表2 ER组和对照组患者的Gd-EOB-DTPA增强MRⅠ特征比较Tab.2 Comparison of Gd-EOB-DTPA enhanced MRⅠfeatures of patients in the ER group and the control group
2.3 HCC术后ER多因素Logistic回归分析
以上述分析中有统计学意义的病理分级、病灶形态、HBP 瘤周低信号、卫星结节及参数LLCER 值为自变量,以是否出现ER 为因变量,进行多因素Logistic 回归分析。结果显示,HBP 瘤周低信号、卫星结节及参数LLCER 值是HCC 术后ER 的独立预测因素,其中LLCER 值与ER 呈负相关(表3)。
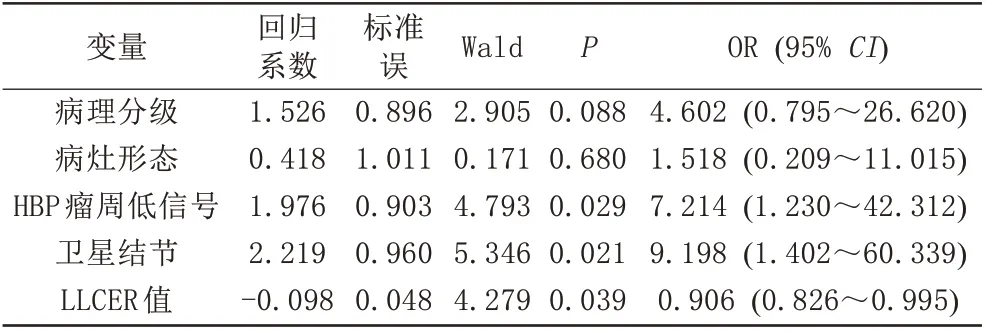
表3 HCC术后早期复发多因素Logistic回归分析Tab.3 Multivariate Logistic regression analysis of early recurrence of hepatocellular carcinoma after resection
2.4 ROC曲线对HCC术后ER预测模型的效果分析
以多因素分析筛选出的HBP瘤周低信号、卫星结节及参数LLCER 值3 项指标构建预测模型,绘制ROC曲线,并计算AUC,根据AUC 来评价该模型的预测效能。结果显示,该模型预测HCC 术后ER 的AUC 为0.94,95%CI为0.883~0.997,敏感度为0.889,特异度为0.840 (图2)。
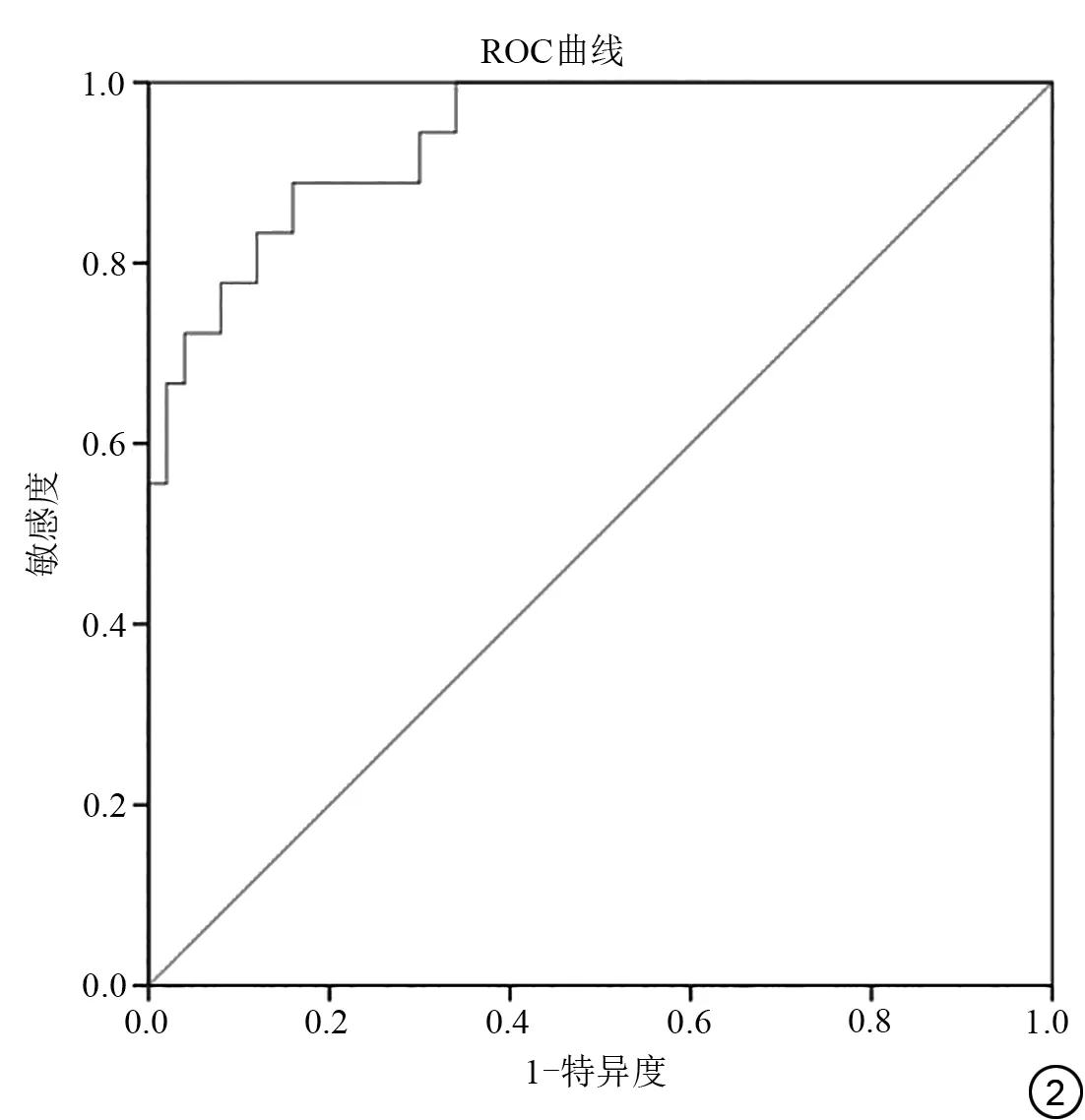
图2 HCC术后早期复发预测模型ROC曲线Fig. 2 ROC curve of early recurrence prediction model for hepatocellular carcinoma after resection.
3 讨论
ER是HCC 根治性术后预后不佳的重要因素。术前有效评估并预测HCC 的ER,对临床治疗决策的调整、预后的评估具有重要意义。Choi 等[13]研究发现HCC 术后复发与病灶在动脉期和门静期的强化方式无关,而HBP 信号高低是术后复发的影响因素。因此,本研究通过对HCC根治性切除术后患者的临床资料、术前Gd-EOB-DTPA 增强MRI 特征及HBP 定量参数进行回顾性分析,结果发现,一些术前MRI特征及HBP定量参数可以评估HCC术后ER,这在以往文献中鲜有报道。另外,本研究分析了HCC 病灶在HBP 的强化程度与病理分级的关系,还发现参数LLCER值可以预测HCC病理分级。
3.1 Gd-EOB-DTPA 增强MRI 的影像特征对HCC 术后ER的预测
Gd-EOB-DTPA 是一种肝胆特异性MRI 对比剂,在肝胆期由于病灶不摄取对比剂,呈低信号;而正常肝脏组织摄取对比剂,呈高信号,从而提高了小及微小肝癌的检出率[14]。既往研究表明,术前Gd-EOB-DTPA增强MRI 有助于预测HCC 的术后ER[9,15-17]。本研究发现HBP 瘤周低信号和卫星结节是HCC 根治性术后ER的独立预测因素。HBP 上出现瘤周低信号的一个可能机制是肿瘤对微血管侵犯引起瘤周灌注改变,从而影响有机阴离子转运多肽转运体的功能,导致瘤周肝细胞摄取Gd-EOB-DTPA 减少[15]。卫星结节是存在于主病灶周围的小病灶,它的存在代表HCC中肿瘤扩散和肝内转移的风险增加[18]。Wei等[1]通过对HCC根治性切除术后ER风险分层的研究,发现瘤周低信号和卫星结节可用于术前分层肝切除术后ER 的风险。Ahn等[9]研究发现瘤周低信号是HCC ER的预测因素(P<0.05)。Plessier等[19]报道,在28例有卫星结节的HCC患者中,有7例复发,而在41 例无卫星结节的患者中无一例复发(P<0.001)。Xu等[20]报道卫星结节是HCC术后复发的独立危险因素。这些结果表明,HBP 瘤周低信号和卫星结节的存在促进肿瘤的进展和复发,与本研究结果一致,因此HBP瘤周低信号和卫星结节可以用于术前评估HCC术后ER。
3.2 定量参数LLCER 值对HCC 术后ER 及病理分级的预测
Kitao等[21]研究揭示肝胆期的信号强度与OATP8的表达水平相关。OATP8是肝细胞膜上的有机阴离子转运肽,可摄取Gd-EOB-DTPA。OATP8 表达水平在HCC 形成过程中显著降低,因此随着HCC 的进展,HBP 信号逐渐降低[22]。同时一些研究表明,注射Gd-EOB-DTPA 后肿瘤强化程度与病理学分级相关,病理分级越高,肿瘤与正常肝组织的肝功能差异越明显,正常肝细胞数量越少,信号越低[21,23]。Choi 等[13]认为,在HBP 图像上表现为等或高信号的HCC 比表现为低信号的HCC的术后肿瘤复发时间要长得多,而且是一个重要的预后因素。然而,实际临床中大部分HCC 病灶在HBP 呈低信号,HBP 呈等或高信号的病灶十分少见[24],因此这种定性指标的临床意义不大,所以一些定量参数的出现将在预测HCC 术后ER 中体现更大的价值。有研究表明Gd-EOB-DTPA 增强MRI 的定量参数—肿瘤对比强化率(contrast enhancement ratio,CER)和HCC 的病理分级相关[21,24]。但是参数CER值忽略了周围肝组织的肝细胞功能状态的差异情况,因此存在一定的缺陷,而参数LLCER 值可以反映HCC 病灶和周围肝组织的情况。LLCER 定量参数分析曾用于肝脏良性病变的评估,其在区分局灶性结节增生和肝细胞腺瘤方面具有很高的敏感度和特异度[25]。Mulé[26]等认为,使用LLCER 对Gd-BOPTA 增强MRI 中的HBP 肿瘤强化程度进行定量分析,可以准确地预测HCC病理分级以及手术切除后无复发生存率。然而,据我们了解,有关参数LLCER值对HCC 术后ER 的预测价值未见报道。我们的研究表明,与非低分化(Ⅰ~Ⅱ级)相比,低分化(Ⅲ~Ⅳ级) HCC 的参数LLCER 值明显降低,与Mulé 等[26]报道结果一致。在多因素分析中,参数LLCER值与术后ER呈负相关,即随着LLCER值的降低,ER率升高,因此参数LLCER值可以用于术前评估HCC术后ER。
3.3 病理分级及病灶形态对HCC术后ER的预测
Shimada 等[27]在研究中发现HCC 病理分化程度是影响长期生存和10 年内有无复发的独立因素,恶性程度越高,就会形成新的血管,更容易侵犯周围的肝实质,导致复发[28]。但也有研究认为病理分级不能预测术后复发[29]。病灶形态是HCC ER的重要危险因素,既往有研究认为,形态不规则,代表了更具侵袭性的生物学行为,ER 率升高[30,31]。在本研究中,虽然单因素分析两组HCC 的病理分级及病灶形态差异均有统计学意义,但是多因素分析结果均不是ER 的独立预测因素,我们推测,可能是因为肝癌术后ER组样本量较小或其他预测因素的影响。因此,HCC 病理分级及术前MRI 病灶形态特征的评价仍然是值得重点关注的因素,未来需要进行更大样本量的研究。
3.4 本研究的不足
本研究的局限性在于,一是本研究为单中心回顾性研究,样本量较少,存在选择性偏倚,需要大样本的进一步证实;二是HCC 的平扫和HBP 信号强度是在病灶的最大横截面上测量的,而不是在整个肿瘤中测量的。全肿瘤分析可以对异质肿瘤的LLCER 测量进行更精确的评估,还可以提高重复性,这是我们今后的研究方向。
综上所述,HCC 根治性切除术后ER 与HBP 瘤周低信号、卫星结节及参数LLCER 值等多种因素有关,由上述因素构成的预测模型对HCC 术后ER 有一定预测价值。
作者利益冲突声明:全体作者均声明无利益冲突。

