非编码RNA对肺源性心脏病的表观遗传调控
李冠烈,申 翱,余细勇
(广州医科大学药学院,广东省分子靶标与临床药理学重点实验室,呼吸疾病国家重点实验室药理学组,广州 511436)
心血管病是全球死亡率最高的疾病,具有致死、致残率高且生活质量降低的特点,常见类型包括原发性高血压、风湿性心脏病、动脉粥样硬化和肺源性心脏病(肺心病)等[1]。其中肺源性心脏病(pulmonary heart disease/cor pulmonale,PHD)通常指因肺组织或肺动脉及其分支发生病变(如肺部疾病、肺血管病变、胸廓畸形、呼吸中枢障碍等)引起肺循环阻力增加,引发肺高压(pulmonary hypertension,PH),从而使右心发生组织重塑(包括心肌肥厚、心肌纤维化等),最终发展为右心衰竭的一种心血管病[2]。
我国肺心病患者至少有500万,其中14岁以上人群慢性肺心病的患病率为4.8‰,并随年龄增长而患病率增高[3]。肺心病晚期引起严重并发症,导致人体多器官功能衰竭,病死率高达55%,严重危害人们的健康。目前该病采用对症治疗,使用机械通气、抗生素、利尿剂、强心剂和血管扩张剂等来维持肺功能和氧饱和度,现有治疗手段均以延缓基础疾病进展为目的,对心肺已形成的组织损伤无法修复[4]。因此,亟待寻找能够逆转心肺重构进程、有效治疗肺心病的新靶点、新技术、新药物,从而改善患者的生存状况,并减轻其医疗负担。
表观遗传是指在DNA序列未发生改变的情况下,基因表达发生了可遗传的变化。表观遗传调控主要涉及DNA甲基化、组蛋白多种翻译后修饰以及非编码RNA(non-coding RNA,ncRNA)调控等[5]。表观遗传深度参与了个体的发育分化和众多疾病的病理进程,其中ncRNA已被发现在心血管病的发生和发展中有重要作用,有望成为肺心病治疗的重要新靶点。国内外缺乏对于ncRNA在肺心病中作用机制的归纳总结,本文整理了与肺心病疾病表型相关的ncRNA研究,以ncRNA为例探讨了肺心病表观遗传调控的研究现状。
1 非编码RNA
ncRNA是不编码蛋白的转录物,能够控制DNA甲基化、影响组蛋白修饰、调控 mRNA 的转录、稳定性和翻译,当ncRNA 失调时可破坏功能性蛋白表达的生理平衡,影响疾病的发展。根据转录本的长度,ncRNA大致分为短ncRNA和长ncRNA,本文将主要介绍研究中常见的3种:短ncRNA主要包含在不同物种间高度保守的microRNA(miRNA/miR);而长ncRNA(lncRNA)则是大于200个核苷酸的ncRNA;另外还有一种结构特殊的环状RNA(cirRNA),虽然近年才被发现,但由于其物种间保守性和稳定性而备受关注。
miRNA通常在细胞核内由RNA聚合酶Ⅱ转录成pre-miRNA,随后经核酸酶Dicer剪切产生成熟的miRNA,与mRNA碱基序列互补、抑制mRNA的翻译,从而调节由它们介导的细胞功能。lncRNA相对于miRNA在机体生理过程中的功能更为丰富,可以和DNA、RNA、蛋白质等多种生物大分子相互作用,作为信号、诱饵、向导或支架来控制基因的表达。同时,lncRNA在体内具有很高的组织特异性,而在物种之间的保守性较低,只有约12%的lncRNA可在人类之外的其它生物中找到。cirRNA的作用机制是通过海绵化miRNA或直接与RNA结合蛋白相互作用从而调控机体生理进程,由于反向剪接形成的封闭环状RNA结构不受RNA外切酶影响,相对线性RNA更稳定。
ncRNA调控在不改变DNA序列的情况下影响生理进程,一方面能直接调控下游蛋白表达,另一方面能影响DNA甲基化或组蛋白修饰从而实现向上调节。例如lncRNA TUG1与miRNA海绵化反应上调了组蛋白去乙酰化酶HDAC3,后者刺激细胞内ROS的产生从而加重缺血性心肌病的病理进程[6]。近年来通过调控ncRNA的表达从而影响疾病的发生和发展已经成为研究的热门,筛选肺心病中差异性表达的ncRNA并用siRNA或抑制剂等手段调控ncRNA或许是治疗肺心病的新思路与靶点,见Fig 1。
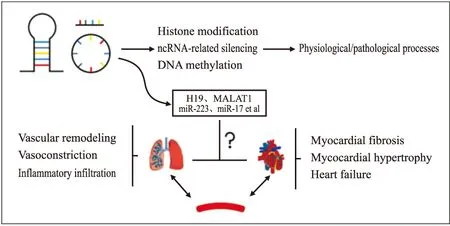
Fig 1 Potential mechanisms of non-codingRNA in cardiopulmonary remodeling
2 肺心病中的非编码RNA研究
由于ncRNA在发育分化和疾病进程中的重要调控作用,在心血管领域和肿瘤领域已有大量ncRNA的研究。然而目前ncRNA 在肺心病中的研究仍较少,已有报道中多数是心脏或肺组织中ncRNA 的作用机制研究(如ncRNA 在心脏发育分化、心脏病发生和发展,或者是肺动脉高压中血管重塑、炎症浸润中的作用等),专注于探索肺心病中ncRNA在心、肺重塑过程的机制研究尚未见报道。
肺心病的表型特征主要体现在心脏和肺组织的病变重塑两个方面,并具有时序性。心脏方面有缺氧、高压导致的心肌肥大、纤维化等,长期负荷将转为心力衰竭[7];肺组织由于不同的原发疾病如慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)、肺动脉高压(pulmonary artery hypertension,PAH)和肺栓塞(pulmonary embolism,PE)等所造成的病变不同,主要导致肺部炎症浸润、肺血管内膜增生、血管收缩导致的动脉压力增高等[8]。本文根据肺心病的病理生理特征,整理了ncRNA在肺心病中的相关研究文献(Tab 1),并针对部分ncRNA在下文中重点阐述。
2.1 肺血管重塑/细胞增殖迁移凋亡肺血管重塑主要包括肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)和肺动脉内皮细胞(pulmonary artery endothelial cells,PAECs)的增殖、迁移和分化等。PAH的典型特征之一是动脉肌化和肥大导致的血管丛样病变。外部条件的刺激(如缺氧、药物毒素暴露和DNA损伤等)会导致血管各类细胞(内皮细胞、平滑肌细胞、成纤维细胞)应激而产生血管壁增厚、血管内径变窄以及灌注阻力增加等表型改变。尽管尚不能确定哪种细胞主导了疾病表型的改变,但血管细胞之间存在串扰;当组织分化成熟时,平滑肌细胞不再增殖或迁移,而是通过募集内皮细胞前体来促进血管稳定,后者通常分化为平滑肌样细胞[9]。
已有多项研究表明ncRNA在血管重塑中有重要作用。其中在PAH患者肺组织和低氧条件下的PASMC 中发现lncRNA Ang362,miR-221和miR-222的表达显著增加,lncRNA Ang362的过表达促进了PASMC的增殖和迁移,而抑制lncRNA Ang362具有相反的作用;实验证明lncRNA Ang362上调了PASMC中miR-221和miR-222的表达并激活了NFκB信号通路,通过使用miR-221和miR-222抑制剂均减弱了lncRNA Ang362导致的增殖和迁移作用,并增加了细胞的凋亡[10]。

Tab 1 ncRNA in PHD phenotypes
另一研究发现,PAH 患者中lncRNA SMILR和Rho蛋白表达上调,而miR-141 表达下调,实验证明SMILR直接与miR-141 相互作用并对其表达负调控,减少SMILR的表达能够抑制缺氧诱导的PASMC增殖和迁移。此外,miR-141的过表达可通过与RhoA 结合而抑制 RhoA/ROCK 途径,从而抑制与细胞增殖相关的信号通路。该研究通过抑制SMILR可以显著抑制野百合碱(MCT)诱导的PAH大鼠的RhoA/ROCK 活化和血管重塑,表明抑制SMILR可有效提高miR-141的表达,进而抑制 RhoA/ROCK通路以调节PAH的血管重构并降低血压[11]。
肺部疾病中ncRNA调控血管重塑的研究还有很多,多与肺血管平滑肌细胞或内皮细胞的增殖、迁移和凋亡有关。值得注意的是,这些ncRNA调控不同信号通路却表现出类似的表型变化,说明肺心病的发病机制非常复杂。
2.2 血管炎症和血管收缩血管周围炎症和血管收缩是肺心病常见病理状态,由于血管收缩的缺氧缺血环境以及免疫反应导致的级联反应将加重肺部病变,进而产生继发性右心功能障碍[12]。ncRNA在炎症发生中通常有调控作用,例如lncRNA H19被发现与炎症有关,在MCT诱导的PAH大鼠/小鼠血清和肺中高表达,同时AT1R被H19通过PDGF-BB刺激后的miR let-7b上调表达。H19和AT1R的过表达可以促进PASMC的体外增殖,而敲除H19基因可保护小鼠免受MCT注射后造成的肺动脉重塑和PAH侵害[13]。
另一研究发现,在患有严重PH的人或牛的肺动脉中分离出的成纤维细胞中,miR-124表达下降、调控糖代谢的PKM蛋白两种变体PKM2/PKM1比值上升。由于PKM2会引发细胞增殖和炎症因子IL-1β的表达,过表达miR-124经由剪接因子PTBP1可达到修复PKM2/PKM1比值的目的,从而阻止糖代谢紊乱、减少细胞增殖和炎症反应[14]。
肺部病变的表型特征除血管过度增殖外还包括血管收缩。由内皮细胞分泌的旁分泌生长因子(如血管内皮生长因子)或血管活性介质(如内皮素-1和5-羟色胺)的释放失调将使血管收缩,血管压力上升结合血管增殖从而形成肺动脉高压。miR-130/301家族是PH中多种促增殖信号通路的调节剂,同时其还通过调节血管舒缩效应子参与不同细胞类型间的通讯。例如miR-130/301-PPARγ轴可调节血管活性因子内皮素-1,可作为PAEC和PASMC之间血管沟通和血管舒缩张力的调控介质[15]。
2.3 TGF-β/Smad信号通路有许多潜在因素可以促成PH的发生和发展,骨形态发生蛋白受体2(BMP-RII)被发现与疾病直接相关,超过70%家族性PAH患者和20%特发性PAH患者出现BMP-RII突变[16]。缺氧环境下导致的肺动脉血管重塑通常可在恢复正常供氧后逆转,但BMP-RII基因的表达缺失会导致内皮细胞的线粒体功能障碍,并阻碍复氧后的血管重塑逆转过程[17]。
BMP属于转化生长因子β(TGFβ)家族,控制细胞的增殖、分化和凋亡,并在胚胎发育和维持组织稳态中发挥重要作用。近年来有研究发现ncRNA能通过调控BMP信号通路来改善PH中的血管重塑表型。Rothman等在PH患者或PH动物模型中检测到miR-140-5p水平的降低,抑制miR-140-5p表达能够促进PASMC的体外增殖和迁移,而过表达miR-140-5p则能够阻止PAH大鼠模型中的疾病进程。进一步发现miR-140-5p的靶点E3泛素连接酶SMURF1是BMP信号传导的调节物,敲低SMURF1能够改变BMP信号传导。通过增强miR-140-5p或抑制SMURF1的表达能够调控BMP信号传导进而减轻PH中的血管重塑[18]。
外源性BMP-RII递送至内皮细胞是恢复BMP-RII表达和功能的方法,但考虑到由病毒载体递送带来的限制(安全性、特异性、蛋白表达量等),该技术还难以应用于临床。而ncRNA对BMP-RII信号的调节是一种潜在的替代治疗方法,可以预防和逆转肺血管重构,也许能够开发成有效治疗肺心病的手段。
2.4 继发性右心重塑在肺心病中,由肺血管增殖和收缩引发的肺动脉高压会造成心脏后负荷增大并进入代偿阶段,当心脏失代偿时产生组织重塑和功能障碍,长期病变转化为心力衰竭。右心室衰竭是PH患者死亡的主要原因,病理状态下右心室对肺血管阻力的适应能力与肺血管变化有关,是患者维持心脏功能和生存的主要决定因素[19]。在多个生存研究中已经证实了右心室在PH中的重要性,许多与右心室功能直接相关的血液动力学因素已经被确定为肺心病死亡率的重要预测指标,例如平均肺动脉压、右心室压、心输出量和心脏指数等[20]。
从正常的心脏解剖结构上看,来自肺的后负荷较低,右心壁肌较薄且顺应性要比左心更高。当由于肺部疾病引起心脏后负荷增加时,右心响应压力刺激收缩增强并且容积扩大,右心扩张意味着壁肌张力的增加,同时增加了心肌的需氧量和降低了血液灌注[21]。在缺血缺氧和高压的环境下心肌细胞发生一系列复杂的变化以及细胞外基质增加,涉及到氧化应激、免疫激活和心肌细胞凋亡等病理进程[22]。
这种继发性的右心重塑损伤主要包括心肌肥大、心肌纤维化、心力衰竭和炎症浸润等,而促成因素不仅仅只有后负荷增加,否则针对降低后负荷的治疗应取得预期的疗效,而并非停留于维持心肺功能的阶段[23]。心肺之间可能存在密切的物质交换从而导致继发性心脏病的发生,ncRNA作为调控生理进程的调节剂在两者之间扮演着重要角色。例如从右心衰竭患者的组织中发现miR-126表达下调, 且SPRED-1蛋白是miR-126的下游分子。SPRED-1增加会导致RAF和MAPK激活的减少,从而降低了右心微血管的密度,并引发心脏重塑病变;而miR-126过表达能够促进内皮细胞的血管生成并且在MCT诱导的PAH大鼠中改善心脏血管密度和心脏功能[24]。
PH患者内皮细胞分泌的ncRNA被发现能够引发继发性心脏重塑。miR-424(322)在PH患者中表达上调,实验证明miR-424(322)通过靶向SMURF1来维持BMP-RI信号传导;缺氧会诱导PAECs分泌miR-424(322),而心肌细胞吸收miR-424(322)后会导致SMURF1的下调,表明ncRNA的调控与心肺重塑密切相关[25]。另一项研究表明,miR-140在PAH大鼠右心肥厚中被上调,其靶点MFN1(线粒体融合蛋白1)被下调。miR-140的增加和MFN1的减少均与右心室收缩压(RVSP)和右心肥厚的增加呈线性相关[26]。
研究表明,肺心病中的低氧环境驱动了心脏特异性ncRNA的表达,通过诱导小鼠肺泡缺氧引发心肌缺氧,然后进行心脏组织ncRNA差异性表达的测序,筛选出显著性下调的ncRNA。miR-146b-5p在低氧环境下被抑制,TRAF6作为下游靶标物同样降低表达,同时诱导促炎性IL-6和CCL2(MCP-1),提示缺氧诱导的miR-146b-TRAF6-IL-6/CCL2(MCP-1)轴可能驱动心脏纤维化和功能障碍[27]。
事实上,虽然少部分研究已表明,ncRNA在PH中的血管重塑或右心重塑中有重要作用,通过调控ncRNA的表达能够影响PH的疾病进程,但没有解释心肺串扰,以及后负荷增加如何引发继发性心脏病的产生。有研究显示在PH中由肺部产生的ncRNA经外泌体传递到心脏被吸收,进而产生了继发性心脏重塑,提示外泌体在心肺串扰中起重要作用[28],但深入的机制还有待进一步研究。
3 结语
除了ncRNA,研究表明其他类型的表观遗传调控也参与了肺心病的发生和发展。例如Boucherat等[29]在PAH患者和大鼠模型中发现组蛋白去乙酰化酶HDAC6显著上调,HDAC6将Ku70维持在低乙酰化状态,阻止了Bax转运至线粒体并防止细胞凋亡;抑制HDAC6可以减少PASMC增殖以及提高抗凋亡能力,而在体内实验中能够改善PAH的疾病进程。此外,HDAC6缺陷的小鼠能够抵抗慢性低氧引起的PAH,提示HDAC6功能丧失有助于预防PAH。同样,Archer等[30]证明在PAH患者和大鼠模型中SOD2(超氧化物歧化酶-2)的下调是由于其增强子和启动子区域中CpG岛被选择性过甲基化导致的,而DNA甲基转移酶抑制剂5′-氮杂-2′-脱氧胞苷可以逆转SOD2的下调,这种表观遗传变化激活了HIF-1(缺氧诱导因子-1),并在PASMC中产生了抗细胞增殖、抗凋亡的表型。因此,从表观遗传调控的多个角度去研究肺心病,有助于进一步揭示心肺重塑的病理机制,从而为逆转疾病进程和提高治疗效果奠定基础。
ncRNA的发现使人们对疾病的理解进入了更深的层次,大量研究表明在心、肺重塑中ncRNA均起到了重要作用,并且出现了基于调控ncRNA表达的化合物或药物,为肺心病的治疗提供了新选择。国内外对于ncRNA分别在肺动脉高压和心脏疾病中的调控作用机制已有大量研究和总结,但从心肺系统整体发病机制角度探讨ncRNA在肺心病中的作用尚未有报道,本文主要归纳了在肺部疾病所引发右心或全心重塑的相关ncRNA研究。事实上,现阶段大多数相关研究只涉及细胞方面的实验,未能结合动物实验验证调控ncRNA的治疗效果,无法揭示肺部病变如何引发继发性心脏重塑的生理进程。此外,ncRNA在肺心病的研究中比较常见的是miRNA和lncRNA,而cirRNA在肺心病中的作用机制研究较少;cirRNA具有保守性高、稳定性好的特点,在肺心病的研究中潜力巨大,值得研究者注意。
肺心病的临床治疗还处于延缓病理状况、无法有效逆转疾病进程的阶段,ncRNA不仅在作为治疗靶点开发新的治疗措施中展示出极大的潜力,同时能够作为疾病标志物,从而提高预后水平,通过调控ncRNA揭示心肺重塑中的表观遗传调控并干预疾病的发生发展将成为治疗肺心病的新思路。

