一株纤维素酶真菌的筛选鉴定及产酶条件优化
罗奉奉,付 跃,黄秀艳,黄文彬,陈慧珍,覃拥灵,3*
(1.河池学院 化学与生物工程学院,广西 河池 546300;2.微生物及植物资源开发利用广西高校重点实验室,广西 河池 546300;3.河池学院 农业生物技术应用研究中心,广西 河池 546300)
地球上每年纤维素的产量约为2 000亿t,如果不加以利用,不但会造成资源浪费,还会污染环境。纤维素的处理与利用是解决粮食短缺、能源危机、环境污染和生态平衡等问题的有效途径[1-3]。纤维素结构复杂,难以分解,是制约其应用的主要原因[4],因此如何高效的利用纤维素成为研究热点[5]。目前通常采用酸碱化处理等化学方法和汽爆及蒸汽加热等物理手段降解纤维素,不仅成本高,而且对环境不友好[6-8]。纤维素酶能将纤维素水解成容易利用的单糖或寡糖,可作为动物饲料使用,也可作为发酵生产乙醇的原料,对解决能源问题具有重要意义。除此之外,纤维素酶广泛应用于造纸、纺织、食品等领域[9-10]。纤维素酶是一类多种酶相互协同作用的酶系,主要包括葡聚糖内切酶、葡聚糖外切酶和β-葡萄糖苷酶,在这三类酶的协同作用下能够将纤维素降解为葡萄糖,葡聚糖内切酶作用于纤维素的非结晶区,将纤维素切割成聚合度不同的短链纤维素;葡聚糖外切酶从短链纤维素的非还原端开始水解β-1,4糖苷键,释放纤维二糖;最后在β-葡萄糖苷酶的作用下将纤维二糖水解为葡萄糖[11-12]。
高产纤维素酶菌株少,因此筛选高产纤维素酶产生菌成为研究热点。微生物蕴含丰富的纤维素酶资源,研究表明,能够分泌纤维素酶的微生物主要为真菌,包括木霉属(Trichoderma),青霉属(Penicillium),曲霉属(Aspergillus)和根霉属(Rhizopus)等[10],虽然真菌比细菌生长周期长[13],且易污染,但其酶系较全。因此,本研究以原始森林土壤样品为材料,经初筛、复筛,成功筛选到一株高产纤维素酶产生真菌,并进行分子生物学鉴定,且通过单因素和正交试验确定最佳产酶条件,为木质纤维素的高效利用提供了理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土壤样品:采集自广西环江县原始森林腐烂木材下的土壤;甘蔗渣:南宁糖业股份有限公司东江糖厂。
1.1.2 化学试剂
羧甲基纤维素钠(carboxymethyl cellulose-Na,CMC-Na)(分析纯):山东西亚化学股份有限公司;刚果红(分析纯):中国远航试剂厂;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):天津市光复精细化工研究所;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DNA Marker:天根生化科技(北京)有限公司;四水酒石酸钾钠(分析纯):天津市科密欧化学试剂有限公司;葡萄糖(分析纯):国药集团化学试剂有限公司;whatman一号滤纸:天津欧杰科技有限公司;微晶纤维素(分析纯)、水杨苷(分析纯):成都格列普生物科技有限公司;琼脂粉(生化试剂):北京索莱宝生物科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:削皮马铃薯200 g/L,葡萄糖20 g/L,琼脂15 g/L,水1 000 mL,pH自然。115 ℃灭菌30 min。
牛肉膏蛋白胨培养基:蛋白胨0.5 g/L,酵母膏4.0 g/L,NaCl 5.0 g/L,琼脂10 g/L,水1 000 mL。121 ℃灭菌20 min。
筛选培养基:CMC-Na 2 g/L,(NH4)2SO42 g/L,K2HPO41 g/L,MgSO4·7H2O 0.5 g/L,NaCl 0.5 g/L,水1 000 mL,琼脂15 g,pH自然。121 ℃灭菌20 min。
固体发酵培养基:按质量分数配制40 g,蔗渣15%,麸皮10%,Mandels营养盐液75%。115 ℃灭菌30 min。
Mandels营养盐液:(NH4)2SO41.4 g/L,KH2PO42 g/L,CaCl20.3 g/L,MgSO4·7H2O 3 g/L,FeSO4·7H2O 5 mg/L,MnSO41.6 mg/L,CoCl22.0 mg/L,ZnCl21.7 mg/L,蒸馏水1 000 mL。115 ℃灭菌30 min。
1.2 仪器与设备
AYP124电子天平:日本岛津公司;SW-CJ-1F洁净工作台:苏净集团苏州安泰空气技术有限公司;J-E冷冻离心机:美国贝克曼库尔特有限公司;HWS-24电热恒温水浴锅:上海一恒科学仪器有限公司;DW-86L388A海尔医用低温保存箱:青岛海尔特种电器有限公司;BCD-322WRM2MPCA冰箱:广东海信冰箱营销有限公司;EasyCycler梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:德国AnalytikJena公司;DYCP-31DN电泳仪:北京六一生物科技有限公司。
1.3 方法
1.3.1 初筛
将采集的土样用研钵研细,准确称量10 g土样于装有90 mL无菌水的250 mL三角瓶中,置于28 ℃、180 r/min条件下振荡培养30 min,梯度稀释10-1、10-2、10-3、10-4、10-5、10-6,取10-3、10-4、10-5、10-6梯度各100 μL涂布于以羧甲基纤维素钠为唯一碳源的筛选平板上,置于30 ℃的生化培养箱中倒置培养7 d。用接种环挑取菌落在PDA平板上划线,于28 ℃的生化培养箱中倒置培养3 d,每个梯度做3个平行。用无菌牙签挑取单菌落接种于新的筛选平板上,于28 ℃生化培养箱中倒置培养3 d。待长出菌落后用0.2%的刚果红溶液染色30 min,再用1 mol/L NaCl溶液脱色15 min,测定水解圈直径与菌落的直径,并计算其比值(H值)。从中选取H值较大的菌株进行复筛[14]。
将初筛得到的菌种划线分离至PDA平板上,倒置于30℃培养箱中倒置培养4 d。菌种成熟后接种于PDA斜面中,同样条件下培养4 d,待菌株成熟后于4 ℃冰箱保存备用[15]。
1.3.2 复筛
取PDA斜面,用10 mL生理盐水将菌体洗下,取1 mL菌悬液接种至发酵培养基中,置于30 ℃的生化培养箱中培养5 d,每天早晚各翻动一次,每株菌做3个平行。发酵完成后向三角瓶中加入200 mL无菌水,40 ℃恒温水浴1 h,4层纱布过滤,将滤液在6 000 r/min,4 ℃的条件下离心10 min,上清液即为粗酶液,4 ℃冰箱保存备用。
1.3.3 分析检测
根据文献[16-17]测定粗酶液葡聚糖内切酶酶活、β-葡萄糖苷酶酶活和滤纸酶活。
葡聚糖内切酶酶活测定:采用0.02 mol/L的pH4.8的柠檬酸-柠檬酸钠缓冲液配制1%CMC-Na为底物,测定内切葡聚糖酶活力。将1 mL 1%CMC-Na置于50 ℃的水浴锅中预热5min,加入0.5mL适当浓度酶液,50 ℃保温反应30 min;待反应结束后,立即加入3 mL的DNS试剂,补足去离子水定容10 mL体积,沸水浴5 min,用自来水冷却至室温,测定波长540 nm条件下的吸光度值,依据葡萄糖标准曲线计算反应产生的葡萄糖浓度确认酶活。酶活定义:在上述条件下,1 mL粗酶液每分钟水解产生1 μmol还原糖所需要的酶量为1个酶活力单位(U/mL)。
β-葡萄糖苷酶酶活测定:采用0.02 mol/L的pH4.8的柠檬酸-柠檬酸钠缓冲液配制1%水杨苷溶液为底物,0.5 mL适当浓度的酶液和1%水杨苷溶液1 mL底物混匀,50 ℃反应30 min,添加3 mL DNS试剂终止反应,沸水浴6 min 然后冷水浴,测定波长540 nm处的吸光度值。酶活定义:在上述条件下,1 mL粗酶液每分钟水解产生1 μmol还原糖所需要的酶量为1个酶活力单位(U/mL)。
滤纸酶酶活测定:将1条whatman一号滤纸条[1cm×6cm;(50±1)mg]折叠放入试管底部,加1 mL pH 4.8的柠檬酸-柠檬酸钠缓冲液和0.5mL适当浓度的酶液混匀,30 ℃反应60 min;对照管为沸水浴6 min灭活的粗酶液。然后用DNS法测定还原糖的生成量,比对葡萄糖标准曲线计算反应产生的葡萄糖浓度确认酶活。酶活定义:在上述条件下,1 mL粗酶液每分钟水解产生1 μmol还原糖所需要的酶量为1个酶活力单位(U/mL)。
还原糖含量测定采用DNS法[18-19]。
1.3.4 菌株分子生物学鉴定
菌株选用通用引物ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3')、ITS4(5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增ITS序列。PCR扩增体系:Template1μL,引物各1μL,2×TaqPCR Mix 12.5 μL,双蒸水(ddH2O)9.5 μL。扩增条件为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸90 s,进行30次循环;72 ℃再延伸10 min,PCR产物8 ℃保温60 min。用浓度为0.8%的琼脂糖凝胶验证PCR产物,将验证成功的产物送华大基因公司测序。利用Cluster W软件将测序拼接后的序列与GenBank中的相似序列进行多种比对,再通过MEGA7.0软件中基于Kimura-2的邻接(neighborjoining,NJ)法(bootstrap=1000次)构建具有产纤维素酶活的菌株以及相关相似菌株的系统进化树[20-21]。
1.3.5 混合碳源对发酵产酶的影响
选取蔗渣、玉米杆、米糠、花生壳共4种碳源[22]各5 g,各加入3 g麸皮作为氮源,各加入30 mL 营养盐液,121 ℃灭菌30 min,接种107个孢子,每组做3个平行,28 ℃恒温培养箱发酵3 d后提取粗酶液,采用酶标仪在540 nm处测吸光度值,计算酶活力。按照蔗渣∶麸皮=1∶4的比例,设计四组:1.5%蔗渣+6.0%麸皮(0.5 g蔗渣+2.0 g麸皮),3.0%蔗渣+12.0%麸皮(1.0 g蔗渣+4.0 g麸皮),4.0%蔗渣+16.0%麸皮(1.5 g蔗渣+6.0 g麸皮),5.0%蔗渣+20.0%麸皮(2.0 g蔗渣+8.0 g麸皮),6.0%蔗渣+24.0%麸皮(2.5 g蔗渣+10.0 g麸皮),各加入30 mL营养盐液。121 ℃灭菌30 min,接种1 mL种子液,每组做3个平行,28 ℃恒温培养箱发酵3 d。3 d后提取粗酶液,在波长540 nm处测定吸光度值,计算酶活力。
1.3.6 产酶条件优化
在优化好的培养基基础上考察发酵温度(24 ℃、27 ℃、30 ℃、33 ℃、36 ℃)、初始pH(3、4、5、6、7、8、9)、接种量(1.5%、3.0%、4.5%、6.0%、7.5%)、Mandels营养盐液添加量(80%、83%、86%、89%、91%)和发酵时间(24 h、36 h、48 h、60 h、72 h)对纤维素酶(葡聚糖内切酶、β-葡萄糖苷酶和滤纸酶酶)酶活的影响[22-23]。一般情况下,滤纸酶活能够表现纤维素酶的综合酶活力,因此在单因素优化的基础上,以滤纸酶活(Y)为评价指标[24],分别选取发酵温度(A)、初始pH(B)、接种量(C)和发酵时间(D)为考察因素设计正交试验,采用L9(34)正交试验设计,优化菌株产酶条件。正交试验因素与水平见表1。

表1 产纤维素酶条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for cellulase-producing conditions optimization
1.3.7 数据处理
数据采用3次试验的重复平均值和标准差进行统计,分析采用Microsoft Excel 2016、正交设计助手V3.1进行试验设计和结果分析。
2 结果与分析
2.1 菌种初筛
鉴定平板上长出菌落后,经刚果红染色液染色,氯化钠溶液脱色后产生明显透明圈,水解效果图见图1。

图1 纤维素酶产生菌水解效果Fig.1 Hydrolysis circle of cellulase-producing strain
筛选平板以羧甲基纤维素钠为唯一碳源,羧甲基纤维素钠能够被刚果红染成红色,由于该菌株能够分泌纤维素酶,故将周围的羧甲基纤维素钠分解,不能着色,产生水解圈,水解圈直径与菌落直径比值越大说明酶产量越高,因此可以根据透明圈直径与菌落直径的比值定性判定高产菌株,部分高产菌株经刚果红染色、氯化钠脱色后产生的透明圈直径与菌落直径比值见表2。

表2 部分筛选菌株的H值Table 2 H value of some screened strains
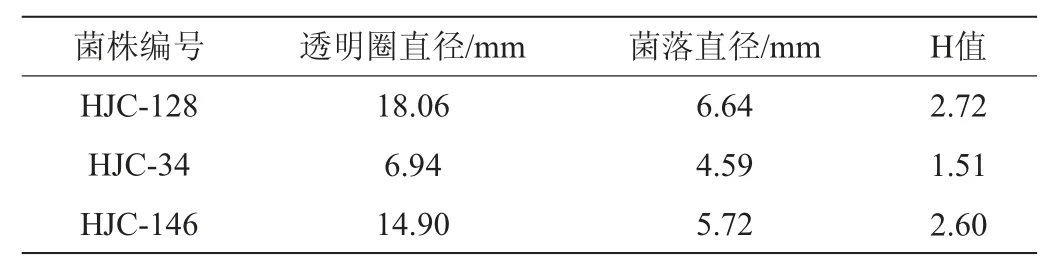
续表
由表2可知,经过羧甲基纤维素平板初筛,刚果红染色后,酶产量较高的为菌株HJC-46、HJC-79、HJC-106,其透明圈直径与菌落直径比值分别为4.92、4.23和4.30。因此,选择这3株菌做进一步复筛。
2.2 菌种复筛
将初筛结果比较好的3株菌进行发酵产酶复筛,结果见图2。由图2可知,葡聚糖内切酶酶活从高到低依次为菌株HJC79>HJC106>HJC46;β-葡萄糖苷酶酶活从高到低依次为菌株HJC79>HJC46>HJC106;滤纸酶活从高到低依次为菌株HJC79>HJC106>HJC46。滤纸酶活代表综合酶活力,从发酵结果来看,3株菌中菌株HJC-79结果最好,其葡聚糖内切酶酶活力、β-葡萄糖苷酶酶活力和滤纸酶活分别为0.986 U/mL、1.092 U/mL、0.563 U/mL。因此,选择菌株HJC-79进行下一步试验。
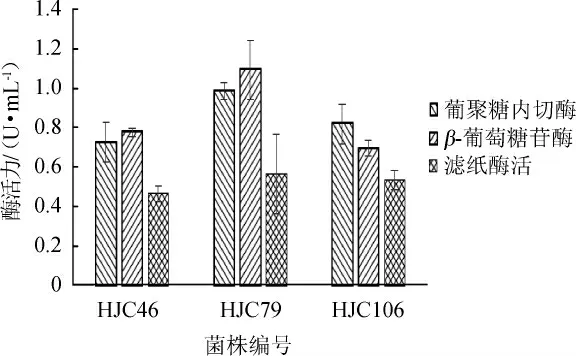
图2 筛选菌株发酵产酶结果Fig.2 Results of enzyme production of screened strains
2.3 菌种鉴定
2.3.1 菌落形态
将菌株HJC-79接种于PDA平板上,于30 ℃的生化培养箱中倒置培养3 d,菌落形态见图3。
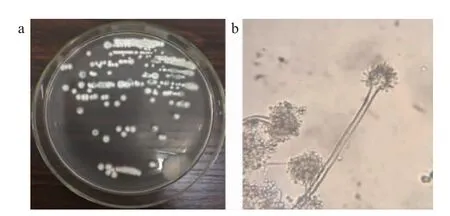
图3 菌株HJC-79菌落(a)和细胞(b)形态Fig.3 Colony (a) and cell (b) morphology of strain HJC-79
由图3可知,菌株HJC-79从筛选板中选出接种于PDA培养基上,待长出菌落后观察,该菌落呈灰白色和圆形,边缘不齐整,呈齿状,表面光滑,不透明,而细菌的背部呈淡黄色;显微镜观察菌丝光滑,分支状,分生孢子头为放射状,顶囊呈半椭圆形或半圆形;分生孢子为球形或近球形。初步鉴定为曲霉属(Aspergillussp.)。
2.3.2 分子生物学鉴定
采用MEGA7.0软件中NJ法构建系统进化树,结果见图4。由图4可知,菌株HJC-179与杂色曲霉菌MF22539聚于一支,经测序对菌株HJC-79的ITS序列进行比对分析,从GenBank数据库中选取部分相似序列,发现菌株HJC-79 ITS序列与之相似性最高,高达100%。因此,鉴定菌株HJC-179为杂色曲霉(Aspergillus versicolor)。

图4 菌株HJC-79基于ITS基因序列的系统发育树Fig.4 Phylogenetic tree of strain HJC-79 based on ITS gene sequences
2.4 培养基组分对菌株HJC-79发酵产酶的影响
碳源能诱导纤维素酶合成。玉米杆、蔗渣、花生壳、米糠作为唯一碳源,不同碳源对纤维素酶酶活的影响见图5。
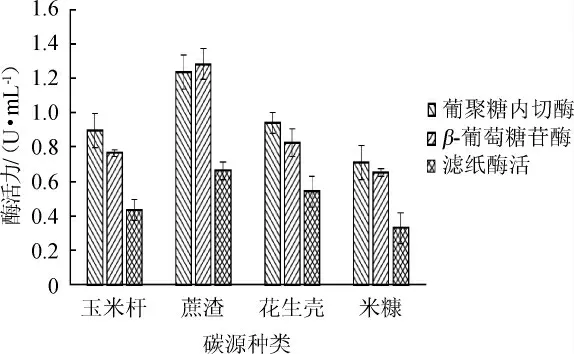
图5 不同碳源对纤维素酶酶活的影响Fig.5 Effect of different carbon sources on cellulase activity
由图5可知,蔗渣为唯一碳源时,葡聚糖内切酶、滤纸酶活及β-葡萄糖苷酶3种酶活力相对较高,分别是1.234 U/mL、1.282 U/mL、0.663 U/mL,因此确定最佳碳源为蔗渣。
碳氮比是有机物中碳总含量与氮总含量的比值,对微生物生长有十分重要的作用。本试验设计碳氮比=1∶4的比例,固体培养基总质量对酶活的影响见图6。

图6 固体培养基总质量对纤维素酶酶活的影响Fig.6 Effect of total mass of solid medium on cellulase activity
由图6可知,在蔗渣∶麸皮=1∶4条件下,3.0%蔗渣+12.0%麸皮(1 g蔗渣+4 g麸皮)发酵生产的3种纤维素酶的酶活力都是最高的,分别为1.39 U/mL、1.456 U/mL、0.782 U/mL。因此,确定3.0%蔗渣+12.0%麸皮作为基本发酵培养基的碳氮源。
2.5 发酵条件对菌株HJC-79发酵产酶的影响
2.5.1 发酵温度对发酵产酶的影响
温度对微生物的生长繁殖和新陈代谢都有着至关重要的影响,发酵温度太低或者太高都会使微生物生长受到不同程度的抑制。本实验考察不同发酵温度(24 ℃、27 ℃、30 ℃、33 ℃、36 ℃)对纤维素酶酶活的影响,结果见图7。

图7 不同发酵温度对纤维素酶酶活的影响Fig.7 Effect of different fermentation temperature on cellulase activity
由图7可知,随着发酵温度在24~33 ℃范围内的升高,纤维素酶酶活力逐渐升高;当发酵温度为33 ℃时,葡聚糖内切酶酶活、β-葡萄糖苷酶酶活和滤纸酶活最高,分别为1.523 U/mL、1.456 U/mL、0.828 U/mL;当发酵温度>33 ℃之后,纤维素酶活呈现降低趋势。因此,最适发酵温度为33 ℃。
2.5.2 初始pH值对发酵产酶的影响
pH对微生物吸收营养物质和新陈代谢过程中酶的活性存在不容忽视的影响,所以适中的pH值对菌种发酵起促进作用。初始pH值对酶活的影响见图8。

图8 不同初始pH值对纤维素酶酶活的影响Fig.8 Effect of different initial pH value on cellulase activity
由图8可知,初始pH值在3~4范围内,纤维素酶酶活力随着初始pH升高而升高;当初始pH值为4时,葡聚糖内切酶酶活、β-葡萄糖苷酶酶活和滤纸酶活最高,分别为1.608 U/mL、1.496 U/mL、0.886 U/mL;初始pH值>4以后纤维素酶酶活呈现下降趋势。因此,最适初始pH值为4。
2.5.3 接种量对发酵产酶的影响
在一定的发酵体系内,接种量大小受限于代谢、生长和繁殖速度,接种量过小导致发酵周期延长等,过大则导致发酵体系溶氧不足、菌体容易衰老等。适当的接种量能使菌种更好地发酵产酶。接种量对酶活的影响见图9。
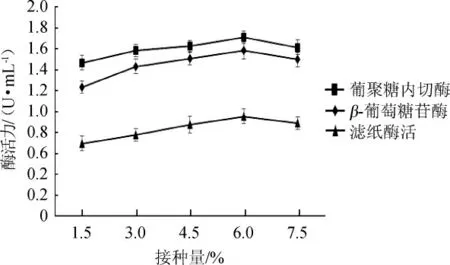
图9 不同接种量对纤维素酶酶活的影响Fig.9 Effect of different inoculum on cellulase activity
由图9可知,接种量为1.5%~6.0%时,纤维素酶酶活力随着接种量升高而升高;当接种量达到6.0%时,葡聚糖内切酶酶活、β-葡萄糖苷酶酶活和滤纸酶活最高,分别为1.712 U/mL、1.584 U/mL、0.954 U/mL;当接种量>6.0%之后,纤维素酶酶活逐步下降。因此,最适接种量为6.0%。
2.5.4 营养盐液添加量对纤维素酶活的影响
营养盐液可以给微生物的生长代谢提供营养物质,某些离子可以促进微生物发酵。营养盐液对纤维素酶酶活的影响见图10。

图10 不同营养盐液添加量对纤维素酶酶活的影响Fig.10 Effect of different nutrient salt solution addition on cellulase activity
由图10可知,营养盐液添加量在80%~89%范围内,纤维素酶酶活力逐渐升高;当营养盐液添加量为89%时,葡聚糖内切酶酶活、β-葡萄糖苷酶酶活和滤纸酶活最高,分别为1.823 U/mL、1.654 U/mL、1.023 U/mL;当营养盐液添加量>89%之后,纤维素酶酶活逐步下降。因此,最适营养盐液添加量为89%。
2.5.5 发酵时间对发酵产酶的影响
微生物在发酵前期,酶慢慢积累,到了发酵后期,菌体可利用的营养物质变少,菌株发生了衰老,发酵时间对酶的产生有重大的影响。发酵时间对纤维素酶酶活的影响见图11。
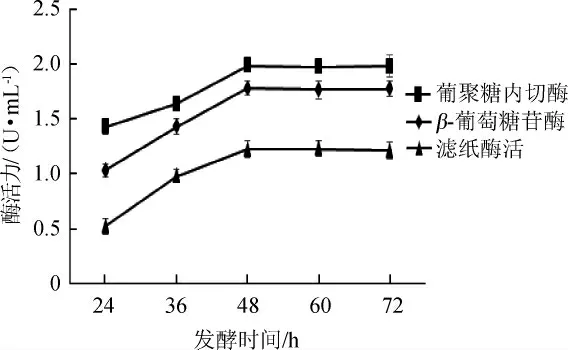
图11 不同发酵时间对纤维素酶酶活的影响Fig.11 Effects of different fermentation time on cellulase activity
由图11可知,随着发酵时间在24~48 h范围内增加,纤维素酶酶活逐渐升高;当发酵时间为48h时,葡聚糖内切酶酶活、β-葡萄糖苷酶酶活和滤纸酶活最高,分别为1.986 U/mL、1.782 U/mL、1.224 U/mL;当发酵时间>48 h之后,纤维素酶酶活逐步下降。因此,最佳发酵时间为48 h。
2.6 正交试验优化产酶条件
选取采用正交设计助手V3.0进行试验方案设计,按照方案进行试验,每组做3个平行。正交试验结果见表3。
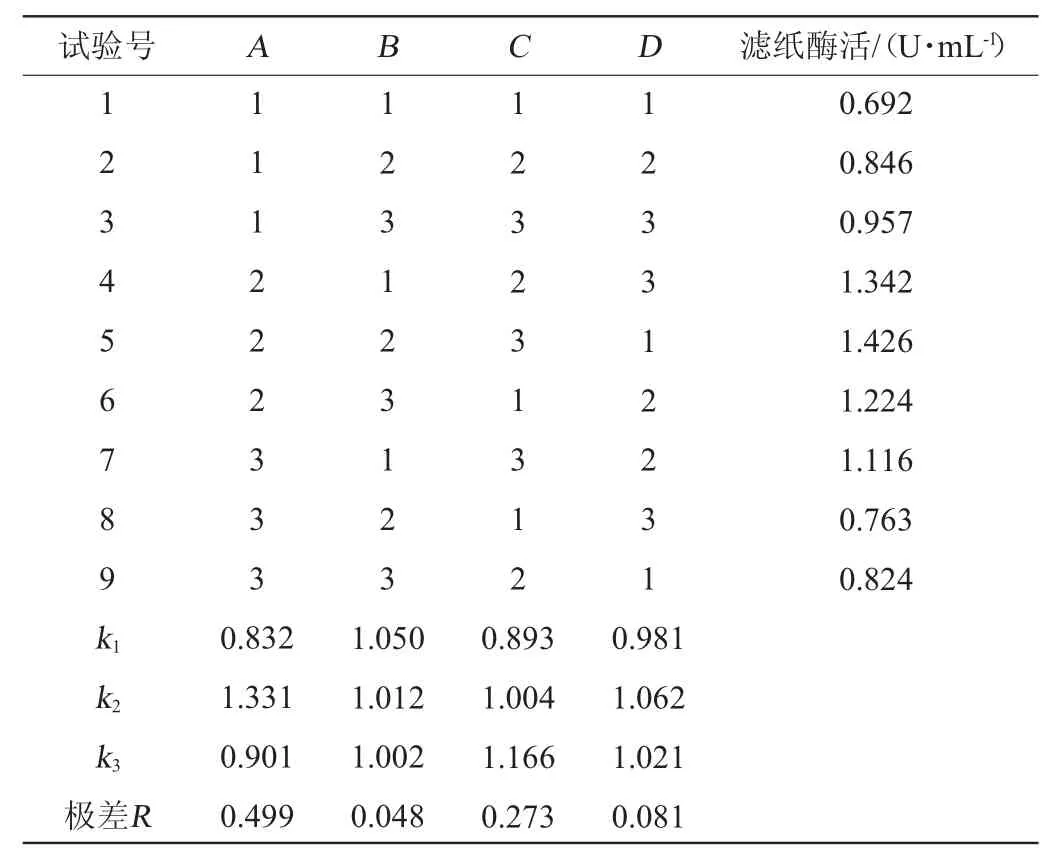
表3 产酶条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for cellulase-producing conditions optimization
由表3可知,最优产酶条件组合为A2B2C3D2,即发酵温度为33 ℃,初始pH值为4,接种量为9.0%,发酵时间为48 h。在此优化条件下,葡聚糖内切酶、β-葡萄糖苷酶和滤纸酶活分别为2.224 U/mL、1.926 U/mL、1.534 U/mL。
3 结论
研究从环江原始森林筛选出一株纤维素酶高产真菌HJC-79,经菌落形态观察、ITS序列分析鉴定其为杂色曲霉(Aspergillus versicolor)。利用单因素实验和正交试验对菌株HJC-79的培养基成分和发酵条件进行优化,确定其最佳发酵培养基为蔗渣、麸皮和营养盐液,最适添加量分别为2%、9%和89%;最佳产酶条件为发酵温度33 ℃,初始pH值4,接种量9.0%,发酵时间48h。在此优化条件下,葡聚糖内切酶、β-葡萄糖苷酶和滤纸酶活分别为2.224 U/mL、1.926 U/mL、1.534 U/mL,相比优化前分别提高了125.55%、76.37%和172.47%。

