有机酸与钙质砂反应过程及其动力学研究
潘杰,李鹏飞,李越煊,王萍,董元华,刘云
(1.中国科学院南京土壤研究所土壤环境与污染修复重点实验室,江苏 南京 210008;2.兰州交通大学 化学与生物工程学院,甘肃 兰州 730070;3.中国科学院大学,北京 100049)
碳酸盐矿物在自然界中的形态呈现多样化[1-2],它的溶蚀与环境问题紧密联系[3-4]。碳酸盐矿物的溶蚀影响矿物与土壤间的转化[5-9]和油气储存与开采[10-12]。热带海洋区域的珊瑚岛礁,主要成分为珊瑚砂,俗称钙质砂,属于碳酸盐矿物的一种[13-15],研究钙质砂溶蚀中不同组分的溶蚀顺序及速率对于深入了解岛礁的演变具有重要意义。小分子有机酸可由植物根系、植物残体及土壤中微生物分泌产生[16-19],可电离产生H+,也可为微生物提供更多碳源[20-23]。目前已有文献报道小分子有机酸对碳酸盐矿物的溶蚀[24-25],且在溶蚀过程中,Ca2+、Mg2+等金属离子的析出较为明显,在微生物固化[26-29]、工程建筑领域也有应用[30]。
本研究选取不同浓度乙酸、苹果酸对钙质砂进行溶蚀,通过浸泡、淋溶模拟实验,比较钙质砂的溶蚀速率,并分析溶蚀后的钙质砂的组成,探讨溶蚀过程及机理。
1 实验部分
1.1 材料与仪器
HCl、乙酸、苹果酸均为分析纯;钙质砂,取自南海某岛礁。
QHZ-12B组合式型全温度恒温振荡箱;BSA124S型分析天平;Optima 8000 型原子发射光谱仪;Nicolet 8700型红外光谱仪;isss-120644 型X射线衍射仪;MERLIM型扫描电子显微镜。
1.2 实验方法
1.2.1 钙质砂的预处理 钙质砂用自来水和去离子水反复浸泡清洗,直到浸泡液的电导低于30 μS/cm。 在70 ℃烘干,筛取1~2 mm的钙质砂备用。
1.2.2 溶蚀实验 称取钙质砂5.00 g,加入到250 mL,锥形瓶中,分别与浓度为1,10,100 mmol/L的100 mL乙酸、苹果酸溶液混合,加盖硅胶塞,隔绝空气。于30 ℃、185 r/min的摇床振荡,不同时间点取出锥形瓶,用隔膜真空泵(50 μm滤膜)快速过滤,测定滤液的pH和Ca2+、Mg2+的浓度,对溶蚀后的钙质砂进行XRD及SEM分析。
Ca2+、Mg2+浓度采用原子发射光谱仪进行测定,使用Origin 6.5绘制曲线,Mg2+溶出动力学使用软件Matlab拟合。
1.2.3 淋溶实验 采用内径3.94 cm,高12.32 cm的100 mL注射器作为淋溶柱,将烘干后130 g的钙质砂(2~4 mm)放置于淋溶柱内,将孔径为75 μm的尼龙布平铺底部。以250 mL一次性输液瓶作为储液瓶,安装流速调节阀,储液瓶中乙酸、苹果酸的浓度分别为100,10,1 mmol/L。以去离子水、通入空气的去离子水以及1 mmol/L的盐酸溶液作对照。每50 mL取一次样,测定溶液中Ca2+、Mg2+浓度。采用间歇淋滤法,每24 h淋溶1次,每次250 mL,每50 mL收集一次淋出液,淋溶速率控制在20 mL/h,累积淋溶量1 050 mL。淋溶结束后,将剩余钙质砂在75 ℃下烘72 h称重量,与未淋溶前比较,计算损失量。
2 结果与讨论
2.1 有机酸对钙质砂的溶蚀
2.1.1 乙酸对钙质砂的溶蚀 图1为不同浓度乙酸与钙质砂反应时溶液中Ca2+、Mg2+浓度随时间的变化。


图1 不同浓度乙酸溶蚀钙质砂中Ca2+(A)和Mg2+(B)溶出反应动力学Fig.1 Dissolution kinetics of Ca2+(A) and Mg2+(B) respectively in calcium sands corroded by acetic acid at different concentrations
由图1(A)可知,乙酸浓度为100 mmol/L时,溶液中Ca2+浓度在0~1 h迅速上升,1~4 h小幅降低,而4~12 h缓慢增大,随后逐渐下降达到平衡浓度,72 h 时浓度为33.35 mmol/L;乙酸反应浓度为10 mmol/L时,溶液中Ca2+浓度在0~0.5 h迅速上升,在0.5~4 h缓慢上升达到峰值,后缓慢降低至平衡浓度,72 h 时,浓度为3.59 mmol/L;乙酸反应浓度为1 mmol/L时,Ca2+在0~2 h迅速攀升,后缓慢上升至平衡浓度,在72 h时,浓度为0.79 mmol/L。
由图1(B)可知,乙酸浓度为100 mmol/L时,Mg2+浓度在0~1 h迅速上升,后渐至平衡浓度,72 h时浓度为3.33 mmol/L;乙酸浓度为10 mmol/L和1 mmol/L时,Mg2+浓度在0~0.5 h急剧升高,后逐渐缓慢上升至平衡,72 h时浓度分别为0.64 mmol/L和0.32 mmol/L。
2.1.2 苹果酸对钙质砂的溶蚀 图2为不同浓度苹果酸与钙质砂反应时溶液中Ca2+、Mg2+浓度随时间的变化。
由图2(A)可知,苹果酸浓度为100 mmol/L时,溶液中Ca2+浓度在0~2 h时迅速上升,2~7 h时缓慢上升随后达到平衡,在72 h时浓度为72.26 mmol/L;当苹果酸浓度为10 mmol/L时,Ca2+浓度在0~2 h时迅速上升,2~10 h时缓慢上升随后达到平衡,其在72 h时浓度为9.82 mmol/L;苹果酸浓度为1 mmol/L时,Ca2+浓度在0~0.3 h时迅速上升,0.3~10 h时缓慢上升随后达到平衡,在72 h 时,其浓度为1.39 mmol/L。
由图2(B)可知,苹果酸浓度为100 mmol/L时,Mg2+浓度在0~4 h内迅速上升,4~10 h时缓慢上升随后达到平衡,在72 h时浓度为6.81 mmol/L;苹果酸浓度为10 mmol/L时,Mg2+浓度在0~0.67 h时迅速上升,在0.67~10 h时缓慢上升随后达到平衡,其在72 h时浓度为1.00 mmol/L;苹果酸浓度为1 mmol/L时,Mg2+在0~2 h时迅速上升,在2~48 h时缓慢上升逐渐达到平衡,在72 h时,其浓度为0.18 mmol/L。


图2 不同浓度苹果酸溶蚀钙质砂中Ca2+(A)和Mg2+(B)溶出反应动力学Fig.2 Kinetics of the dissolution of Ca2+(A) and Mg2+(B)respectively in calcareous sand corroded by malic acid at different concentrations
2.2 有机酸对钙质砂的淋溶
由于不同淋溶液淋出的Ca2+、Mg2+总量相差较多,为更加方便直观的比较不同处理组间的差异,分别将溶液中Ca2+、Mg2+淋出总量进行对数函数处理。
2.2.1 乙酸对钙质砂的淋溶 图3为不同浓度乙酸对钙质砂淋溶后Ca2+、Mg2+累积淋出量随淋溶量变化。
由图3可知,随着乙酸浓度的增加,Ca2+、Mg2+淋出量逐渐增大,1 mmol/L的HCl对钙质砂中Ca2+、Mg2+的淋出量远大于1 mmol/L乙酸淋出量,且与10 mmol/L乙酸淋出量相当。1,10,100 mmol/L乙酸对Ca2+的累积淋出量分别为39.72,235.10,1 345.43 mg, 对Mg2+的累积淋出量分别为3.60,11.24,62.30 mg。


图3 不同浓度乙酸淋溶钙质砂中Ca2+(A)和Mg2+(B)总量随淋溶量的变化图Fig.3 The change curves of the total Ca2+(A) and Mg2+(B)in acetic acid leached calcareous sand at different concentrations with the leached amount
2.2.2 苹果酸对钙质砂的淋溶 图4为不同浓度苹果酸对钙质砂淋溶后Ca2+、Mg2+累积淋出量随淋溶量变化。


图4 不同浓度苹果酸淋溶钙质砂中Ca2+(A)和Mg2+(B)总量随淋溶量的变化曲线图Fig.4 The change curves of the total Ca2+(A)and Mg2+(B) in malic acid leached calcareous sand at different concentrations with the leached amount
由图4可知,随着苹果酸浓度的增加,淋出Ca2+、Mg2+的量逐渐增大,且由于苹果酸为二元有机羧酸,因此苹果酸对Ca2+、Mg2+的淋出量都高于相同浓度乙酸对Ca2+、Mg2+的淋出量。1,10,100 mmol/L苹果酸对Ca2+的累积淋出量分别为66.86,437.28,3 353.75 mg,对Mg2+的累积淋出量分别为4.74,20.09,164.72 mg。
2.2.3 淋溶后的质量变化 将淋溶后钙质砂烘干、称重,与淋溶前比较,计算质量损失率,结果见表1。

表1 淋溶后钙质砂的质量损失Table 1 Quality loss of calcareous sand after leaching
由表1可知,随着苹果酸与乙酸浓度的增加,淋溶后钙质砂的质量损失率逐渐增大,且在相同浓度的情况下,苹果酸淋溶后的钙质砂质量损失率均高于乙酸淋溶后的钙质砂质量损失率。1 mmol/L的HCl淋溶后钙质砂的质量损失率大于相同浓度的乙酸与苹果酸淋溶后钙质砂的质量损失率。由于通入空气的去离子水中溶入CO2产生H2CO3,导致通空气的去离子水淋溶后钙质砂的质量损失率高于不通空气的去离子水淋溶后的质量损失率。
2.3 反应前后钙质砂的变化
2.3.1 反应前钙质砂表面分析
2.3.1.1 XRD 用 X 射线衍射仪对反应前的钙质砂进行物相分析,结果见图5。

图5 钙质砂的X射线衍射谱图Fig.5 X-ray diffraction spectra of calcareous sand
采用Jade 6.5分析软件将其与PDF卡片库中谱图对比,可知特征谱线3.408 5(111),3.285 1(021),2.708 9(012),2.491 2(102),2.379 1(112),1.980 5(221),1.884 9(202),1.817 9(132),1.745 9(113)与文石的谱图较为匹配;特征峰2.995 7(104)与镁方解石的特征峰符合;少量的杂峰表明,钙质砂中还含有少量的方解石。具体矿物组成见表2。
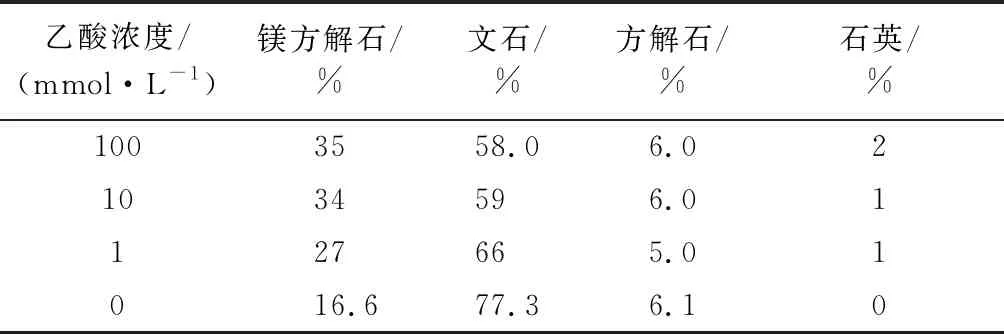
表2 不同浓度乙酸与钙质砂反应72 h后固相部分组成Table 2 Solid phase fractionation after reaction of acetic acidand calcareous sand for 72 h
2.3.1.2 SEM 图6为钙质砂放大不同倍数的SEM图片。

图6 钙质砂的扫描SEM图Fig.6 SEM of calcareous sand放大1 000倍图(A)和放大10 000倍图(B)
由图6可知,钙质砂表面凹凸不平,具有多孔结构,表面有许多条状物堆积在一起。
2.3.2 与乙酸反应后钙质砂的变化
2.3.2.1 XRD 图7为钙质砂与乙酸振荡溶蚀72 h后的XRD谱图。
与PDF卡片库对比可知,特征峰3.385 8(111),3.261 9(021),2.694 7(012),2.478 1(102),2.413 7(031),2.368 3(112),2.336 2(130),2.102 6(220),1.974 5(221),1.879 0(041),1.812 4(132),1.704 0(113)与文石卡片(99-0013)的特征峰相符;2.993 7(104),2.255 4(113)与镁方解石卡片(86-2336)特征峰相符;3.037 5(104)与方解石卡片(85-1108)的特征峰相符。相较于未反应前钙质砂组分无变化,但各组分间含量发生变化,见表2。
由表2可知,随着乙酸浓度的增加,文石的相对含量减小,镁方解石的相对含量增加。乙酸浓度为100 mmol/L时,文石含量减少了19.3%,镁方解石含量增加了19.4%。故对于乙酸溶蚀钙质砂,文石为主要的溶蚀对象。



图7 乙酸与钙质砂反应72 h后固体部分XRD谱图Fig.7 XRD of solids after reaction of acetic acid and calcareous sand for 72 h
2.3.2.2 SEM 图8为钙质砂与乙酸溶液振荡反应72 h后固相部分的SEM图片(放大10 000倍)。

图8 乙酸与钙质砂反应72 h后固体部分XRD谱图和SEM图Fig.8 XRD and SEM of solids after reaction of acetic acid and calcareous sand for 72 h
由图8可知,溶蚀后的钙质砂表面较原先平整,可能为乙酸溶蚀了文石组分,而溶蚀的镁方解石组分较少,生成少量的CaCO3沉淀,难以观察。
2.3.3 与苹果酸反应后钙质砂的变化
2.3.3.1 XRD 图9为钙质砂与不同浓度苹果酸振荡反应72 h后的XRD谱图。
与PDF卡片库对比可知,特征峰3.393 3(111),3.271 0(021),2.689 4(012),2.480 7(102),2.371 9(112),2.339 8(130),2.105 3(220),1.976 3(221),1.878 3(041),1.813 9(132),1.742 8(113)与文石卡片(99-0013)的特征峰匹配,特征峰2.983 9(104),2.250 0(113)与镁方解石卡片(86-2336)的特征峰匹配;特征峰3.029 5(104)为方解石的特征峰。同乙酸溶蚀总体趋势相同,钙质砂组分未发生变化,但组分含量发生了变化,见表3。



图9 苹果酸与钙质砂反应72 h后固体部分XRD谱图Fig.9 XRD of solids after reaction of malic acid and calcareous sand for 72 h

表3 不同浓度苹果酸与钙质砂反应72 h后固相部分组成Table 3 Solid phase fractionation after reaction of malic acid and calcareous sand for 72 h
由表3可知,随着苹果酸浓度的增加,钙质砂中的镁方解石含量逐渐降低,文石的含量逐渐增加。苹果酸浓度为100 mmol/L时,文石的含量增加了7.6%,镁方解石减少了6.5%,镁方解石为反应过程中主要溶蚀对象。
2.3.3.2 SEM 图10为苹果酸与钙质砂振荡反应72 h后固相部分放大5 000倍的SEM图。

图10 不同浓度苹果酸与钙质砂反应72 h后固相部分的SEM图Fig.10 SEM of solid phase fractions after reaction of malic acid and calcareous sand for 72 h(A)1 mmol/L;(B)10 mmol/L;(C)100 mmol/L
由图9(C)可知,较同等浓度的乙酸溶蚀SEM图,表面更为规则,且10(A)和10(B)表面较未溶蚀前变化不明显。
2.3.4 有机酸溶蚀的红外谱图 对有机酸浓度为100 mmol/L钙质砂溶蚀后的产物进行红外分析,结果见图11。



图11 不同处理钙质砂的红外谱图Fig.11 Infrared spectra of carbonate rocks treated with different organic reefs(A)未处理;(B)100 mmol/L乙酸;(C)100 mmol/L苹果酸
由图11可知,100 mmol/L的乙酸对钙质砂溶蚀后产物的红外谱图与未处理的基本一致,而苹果酸的溶蚀产物的检测中,在639,680,1 582,3 454 cm-1处有不同的特征吸收峰,其中3 454 cm-1是O—H伸缩振动吸收峰;1 582 cm-1为羧酸根的对称伸缩振动吸收峰,而DL-苹果酸的羰基吸收峰为1 739~1 701 cm-1,此处向低波数偏移,表明与钙形成了络合物。
2.4 讨论
钙质砂的主要成分为CaCO3及MgCaCO3。由浸泡溶蚀实验的Ca2+、Mg2+变化图可知,随着两种酸浓度的增加,溶出的Ca2+、Mg2+浓度增大,而在初始反应的1 h内,酸的浓度很高,电离产生的H+较多,溶蚀作用最为强烈,而后Ca2+、Mg2+浓度无大的变化,表明反应趋于平衡,此过程中极少有沉淀生成。淋溶实验中,钙质砂经苹果酸溶蚀后的质量损失大于乙酸,这是由于在同等浓度下,苹果酸电离产生的H+多于乙酸的,溶蚀作用也就更加显著。以上数据表明,溶蚀过程中,H+发挥着主要的作用,乙酸、苹果酸与钙质砂主要发生如下反应:

Ca2+(aq)+H2O(l)+CO2
(1)

Ca2+(aq)+ Mg2+(aq)+H2O(l)+CO2
(2)
在溶蚀过程中,乙酸与苹果酸根离子会与Ca2+产生络合物,溶蚀后产物X衍射分析表明,3种浓度乙酸溶液溶蚀的产物中并未找到乙酸钙的特征峰,且定量分析后也未发现乙酸钙沉淀的成分,可能是由于乙酸钙溶解度大,在水溶液中很难会产生沉淀,或产生极少量沉淀,难以检测到,对产物进行红外分析也未发现乙酸钙的存在。在苹果酸溶蚀产物的XRD谱图中也未发现与苹果酸钙相符的特征峰,随后对其浓度为100 mmol/L的苹果酸溶蚀产物进行红外分析,观察到了苹果酸钙官能团的特征吸收峰。
在小分子有机酸溶蚀钙质砂的过程中不仅存在Ca2+离子的溶出反应,而且存在Ca2+被酸根离子固定络合的反应以及碳酸钙的重结晶的反应,溶液中测得的Ca2+浓度不能代表钙质砂溶出Ca2+的实际浓度,因此不能简单的通过数学模型对溶液中Ca2+离子浓度进行动力学模拟,故本研究中只对溶液中Mg2+浓度进行了动力学模拟。通常,盐类矿物溶解动力学多数受扩散过程、表面反应过程以及扩散过程和表面反应过程的综合影响[31-32]。当体系中溶解的离子浓度主要受扩散作用的影响时,可以用Stumm微分方程(方程3)来表示[33],当溶解过程同时受扩散过程和界面反应过程影响并伴有化学反应时,可用Srumm的修正方程(方程4~6)来表示。通过在matlab程序中运用方程(3~6)对钙质砂中Mg2+溶出的溶解动力学进行计算拟合发现,方程(3)对Mg2+浓度随时间的变化曲线的拟合度较高,因此我们推测Mg2+的溶出主要受扩散过程的影响。对溶出曲线进行拟合[34-35],具体动力学方程见表4,由动力学方程可知,随着乙酸浓度的逐渐增大,表观速率常数逐渐增加,随着苹果酸浓度的逐渐增大,表观速率常数逐渐减小。
dC/dt=K(Cs-Ct)n
(3)
dC/dt=K(Cs-Ct) +K2
(4)
dC/dt=K(Cs-Ct)n+Ct-K2
(5)
dC/dt=K(Cs-Ct)n(Ct-K2)
(6)
式中,Cs为溶液中溶解离子平衡时浓度,Ct为t时刻溶解离子的浓度,K为表观速率常数,n为反应级数。

表4 不同体系中Mg2+的溶解动力学方程Table 4 Dissolution kinetics equation of Mg2+ in different concentrations of oxalic acid system
3 结论
(1)有机酸溶蚀钙质砂的过程中,Ca2+、Mg2+为主要的溶出物,且Ca2+、Mg2+的溶出速率及程度随乙酸、苹果酸浓度的增加而增大;苹果酸对钙质砂的溶蚀速率及程度强于乙酸。
(2)Ca2+、Mg2+的溶出过程中,主要受扩散过程的控制,可通过Stumm微分方程对其中的Mg2+进行拟合。
(3)在模拟溶蚀过程中,钙质砂中的文石、镁方解石组分含量发生主要的变化。
(4)不同浓度乙酸与苹果酸对钙质砂的淋溶模拟实验发现,这一过程能够显著地减少钙质砂的质量比例,且随着酸浓度的增大,淋溶导致的质量损失也会逐渐变大。
——详解淄博文石皴纹及赏石文化

