一种海洋来源蜡样芽孢杆菌α-半乳糖苷酶基因的克隆表达及功能鉴定
江超峰,李悝悝,李唐,车佳,3,尹恒*
(1.中科院大连化学物理研究所 辽宁省碳水化合物重点实验室,大连市糖类农用制剂工程研究中心,辽宁 大连 116023; 2.中国科学院大学 化学科学学院,北京 100049; 3.大连海洋大学 食品科学与工程学院,辽宁 大连 116023)
α-半乳糖苷酶(α-Gal; EC3.2.1.22)是可专一性水解α-半乳糖苷键的糖苷水解酶,如棉子糖家族(RFOs)、半乳甘露聚糖、刺槐豆胶、瓜尔豆胶等[1]。基于氨基酸序列,α-半乳糖苷酶在碳水化合物活性酶(CAZy)数据库(http://www. cazy.org)中归属为糖苷水解酶(GH)家族中的第4、27、36、57、97、110家族[2]。其中,大多数α-半乳糖苷酶属于GH27和GH36,目前,这两个家族的酶也是α-半乳糖苷酶中研究最广泛的[3]。而GH4家族中α-半乳糖苷酶主要来源于古细菌和细菌,目前研究相对较少。研究人员发现,大部分被报道的GH4家族酶活性依赖于NAD+及二价阳离子,有些还需要依赖如二硫苏糖醇(DTT)、β-巯基乙醇等还原剂,到目前为止,只在GH4家族中发现了这种依赖NAD+进行糖苷水解反应的酶[4]。基于底物特异性,α-半乳糖苷酶主要被分为两大类。一类针对低分子量的底物起作用,如4-硝基苯基-α-D-吡喃半乳糖苷(pNP-α-Gal,pNPG)、蜜二糖、水苏糖和棉子糖;另一类则对高聚合度的半乳甘露聚糖和低分子量底物都起作用[5]。
在食品行业中,α-半乳糖苷酶被广泛应用,制糖产业中棉子糖的存在会抑制甜菜糖浆中蔗糖的结晶,生产过程中,通过加入α-半乳糖苷酶进行酶促反应消耗棉子糖,能明显提高产率[6]。
海洋中含有丰富的多糖资源与独特的微生物体系,因此,海洋来源的微生物是多糖降解酶的重要来源之一。本研究中,从海洋鹿角菜中筛选得到蜡样芽孢杆菌Bacilluscereus,获得了一个新的GH4 α-半乳糖苷酶基因BcgalA,成功构建重组质粒,转入大肠杆菌宿主中进行诱导表达和纯化,测定了其对pNP-α-Gal与棉子糖的活性,以期为探究GH4 α-半乳糖苷酶的结构与功能提供样本,同时也为α-半乳糖苷酶的工业应用提供新的选择。
1 材料与方法
1.1 材料
蜡样芽孢杆菌由辽宁省大连市黑石礁海域腐烂鹿角菜中筛选得到。EscherichiacoliTop10和EscherichiacoliBL21(DE3)由中科院大连化物所1805组实验室保存。
pNP-α-Gal、pNP、棉子糖购自Sigma-Aldrich公司 (USA);限制性核酸内切酶、T4 DNA连接酶购自Thermo Fisher公司(USA);Prime STAR HS DNA聚合酶、rTaq DNA聚合酶购自宝生物(大连)工程有限公司;DNA全基因提取试剂盒购自天根生化科技(北京)有限公司;葫芦巴胶、瓜尔豆胶、刺槐豆胶均购自上海柯原实业有限公司。
LB培养基(液体,1 L)中含有Tryptone 10 g、Yeast Extract 5 g、NaCl 10 g,pH为7.0;固体培养基中含有15 g琼脂。
1.2 方法
1.2.1 蜡样芽孢杆菌α-半乳糖苷酶基因BcgalA的克隆 根据蜡样芽孢杆菌α-半乳糖苷酶BcgalA在NCBI上的序列(登录号WP_002170672.1),设计C-末端带有6 ×His-tag 基因的一对引物,BcgalA-F:5′GCGCGCCATGGCAAAAATTACATTT 3′;BcgalA-R:5′CGAGCTCGAGGATTGTC TCCACAACTGCTTC 3′,下划线分别为NcoI 和XhoI的酶切位点。以蜡样芽孢杆菌DNA为模板,克隆BcgalA基因。 PCR反应体系(100 μL):模板DNA 1.5 μL,10 mmol/L基因特异性引物4 μL,Prime STAR HS DNA聚合酶0.5 μL,dNTP Mixture(各10 mmol/L) 8 μL,5×PS Buffer 20 μL,用ddH2O补足至100 μL。PCR反应条件: 95 ℃下预变性 3 min;94 ℃下循环变性30 s,68 ℃下退火复性30 s(每个循环降0.5 ℃),72 ℃下延伸3.5 min,共进行30 个循环;最后在72 ℃下再延伸5 min。PCR扩增产物经10 g/L琼脂糖凝胶电泳分离、DNA胶回收试剂盒进行胶回收。
1.2.2 表达载体的构建 胶回收产物在37 ℃下用NcoI和XhoI 双酶切消化6 h,与同样酶切后的pET28a通过T4 DNA 连接酶室温连接12 h,将产物转入E.coliTOP 10 感受态细胞,在含Kan抗性的平板上37 ℃下生长过夜,用通用引物5′TAATACGACTCACTATAGG和3′GCTAGTTATTGCTCAG- CGG进行菌落PCR验证后,提取质粒送北京六合华大基因科技股份有限公司测序,将测序正确的质粒命名为pET28a-BcgalA,再将其转入E.coliBL21(DE3)中。
1.2.3BcGalA诱导表达与表达条件优化 挑取转入BcgalA的E.coliBL21(DE3)单菌落,接入10 mL 含50 μg/mL Kan 的LB液体培养基中,200 r/min、37 ℃恒温振荡过夜培养,按1∶50的比例接种于含50 μg/mL Kan的500 mL LB 液体培养基中,200 r/min、37 ℃扩大培养。当菌液OD600 nm为0.6~0.8时,加入终浓度为0.1 mmol/L的IPTG,200 r/min、30 ℃诱导培养12 h。优化后诱导条件改为180 r/min、16 ℃诱导表达24 h,以12 000 r/min离心10 min后收集菌体。
1.2.4 重组蛋白纯化 将超声破碎收集获得的菌体(300 W,超声/间隔时长 3 s/15 s,30 min),在4 ℃下以12 000 r/min冷冻离心40 min,收集上清液。经Ni-NTA亲和层析柱纯化蛋白,即用Bind Buffer(0.1 mol/L pH 7.4 Tris-HCl、0.3 mmol/L MnCl2、1 mmol/L TCEP)平衡柱子,取上清液上样,用Bind Buffer冲洗柱子后,依次用含40 mmol/L、250 mmol/L咪唑的Bind Buffer洗脱收集,上清液沉淀与洗脱液均由10%(质量分数)SDS-PAGE分析蛋白分离纯化,蛋白质量浓度由Bradford法测定。
1.2.5BcGalA活性的测定 采用pNPG法[7]与DNS法[8]测定酶活性,采用DNS法测定天然产物的活性。
pNPG法是以OD405 nm值(y)为纵坐标,硝基苯酚(pNP)含量(x)为横坐标,绘制标准曲线。
将pNPG溶于缓冲液(100 mmol/L Tris-HCl(pH 8.0)、3 mmol/L MnCl2、5 mmol/L NAD+、1 mmol/L TCEP)中,使其终浓度为100 mmol/L,取2 μL酶液(8.91 mg/mL)与100 μL的pNPG混合。37 ℃下温育10 min,加入800 μL 0.5 mol/L的Na2CO3终止反应,最后加入100 μL的ddH2O。于405 nm处测定OD值,用pNP生成量来表示酶活力。对照组加灭活的酶液,其余操作与试验组相同。
DNS法是以OD540 nm值(y)为纵坐标,半乳糖含量(x)为横坐标,绘制标准曲线。
用相同缓冲液配制5 g/L天然产物的底物溶液,取2 μL酶液(8.91 mg/mL)与100 μL底物混合。37 ℃下反应40 min,加入100 μL DNS终止反应,煮沸10 min,最后加入800 μL的ddH2O,于540 nm处测定OD值,用半乳糖生成量表示酶活力,对照组加灭活的酶液,其余操作与试验组相同。
单位酶活定义:37 ℃下1 min释放1 μmol的半乳糖需要的酶量定义为一个酶活单位(U)。
1.2.6 生物信息学分析 通过生物信息学分析,对α-半乳糖苷酶结构域及理化性质等方面进行分析与预测[9]。α-半乳糖苷酶BcgalA基因序列编码的氨基酸理化性质及亲疏水性预测由ExPASy网站(https://web.expasy.org/protparam/)在线完成。通过ENDscript/ESPript(http://espript.ibcp.fr/ ESPript/cgi-bin/ESPript.cgi)对序列进行比对作图。用Mega7.0软件构建进化树[10]。
2 结果与分析
2.1 BcgalA基因的克隆
通过PCR扩增获得C-末端连接6×His-tag的BcgalA基因,获得一条约1 300 bp条带(图1),符合BcgalA基因全长1 326 bp,并将其切胶回收。
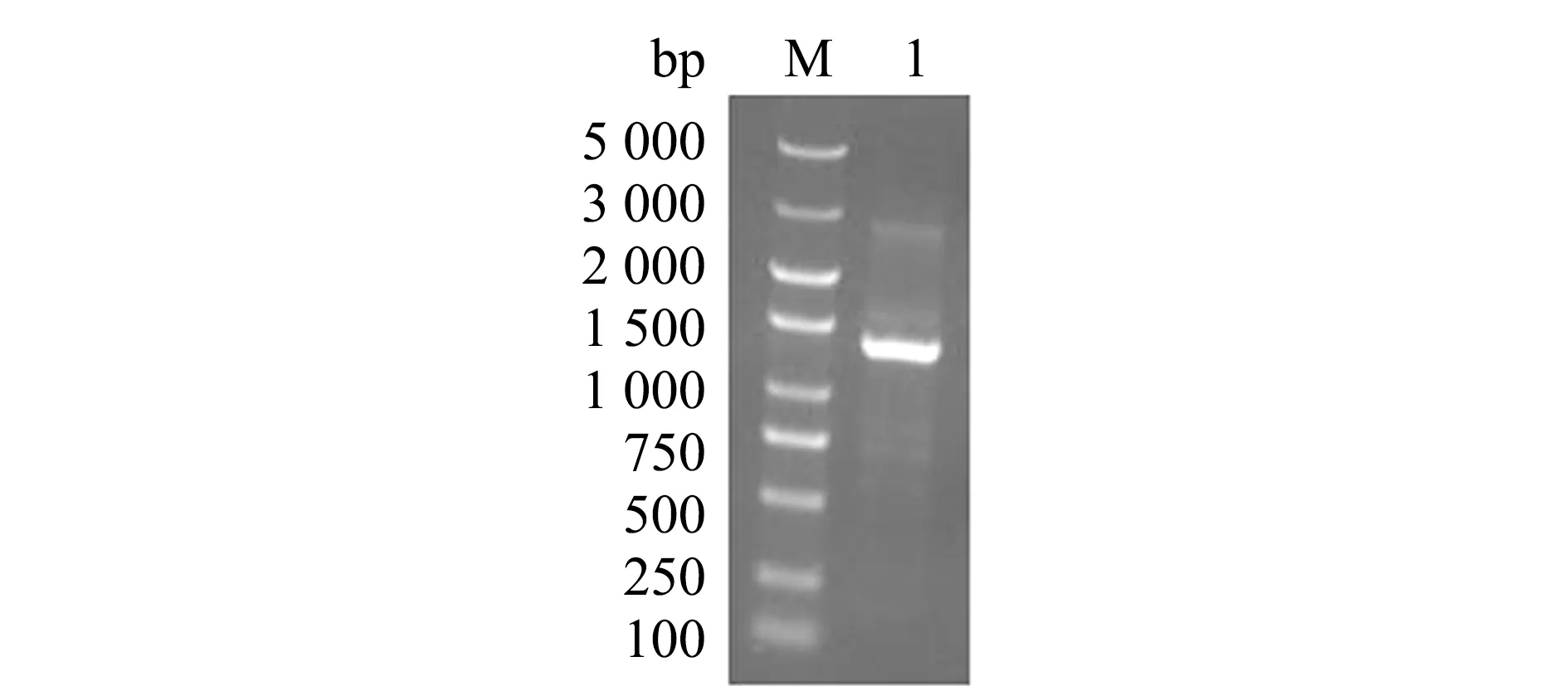
M—核酸标准BM5000+;1—α-半乳糖苷酶基因扩增产物。M—Marker;1—amplification product of α-galactosidase gene.图1 α-半乳糖苷酶基因的电泳检测Fig.1 Electrophoretic detection of α-galactosidase gene
2.2 表达载体的构建
将BcgalA与pET28a质粒连接后转入E.coliTOP10感受态细胞中,提取质粒进行基因测序,将测序结果匹配的重组质粒命名为pET28a-BcgalA。
2.3 BcgalA基因及其编码氨基酸序列分析
BcgalA基因全长为1 326 bp,其编码的BcGalA蛋白由441个氨基酸组成,该蛋白的理论相对分子质量为50 380,等电点为6.12,总平均亲水性为-0.379,不稳定指数为35.98,属于稳定蛋白。
2.4 BcGalA诱导表达与条件优化
超声破碎诱导表达后的菌体,离心获得含有目的蛋白的上清液。如图2(a)所示,通过SDS-PAGE分析发现,30 ℃、200 r/min诱导获得的BcGalA,主要以包涵体的形式存在,因此,优化诱导表达条件,通过降低诱导时转速与温度达到减少包涵体的目的。如图2(b)所示,16 ℃、180 r/min诱导获得的BcGalA,大部分存在于上清液中,通过优化诱导表达条件,减少了蛋白包涵体,提高了上清液中的蛋白含量,为后续蛋白纯化、酶活力测定等试验奠定了基础。

M—Marker;1—诱导前上清液;2—诱导后上清液;3—诱导后沉淀;4—流穿液;5—粗酶;6—破菌后沉淀;7—40 mmol/L咪唑洗脱液;8—250 mmol/L咪唑洗脱液。M—Marker;1—supernatant before induction;2—supernatant after induction;3—insoluble fractions after induction;4—remaining components after passing through the Ni column;5—crude extract of BcGalA;6—insoluble fractions of cell extract of BcGalA;7—eluent of 40 mmol/L imidazole;8—eluent of 250 mmol/L imidazole.图2 BcGalA纯化结果Fig.2 Purification of BcGalA
2.5 BcGalA分离纯化
目的蛋白的C端带有6×His-tag,因此,采用Ni-NTA亲和层析柱分离纯化BcGalA。从图2(b)可见,用40 mmol/L咪唑洗脱大部分杂蛋白后,250 mmol/L 咪唑能够成功洗脱目的蛋白,且条带单一,与目的蛋白BcGalA大小基本一致。
2.6 BcGalA活性检测
对纯化后的蛋白进行Buffer置换与蛋白浓缩,测得其蛋白质量浓度为8.91 mg/mL,并进行酶活力鉴定,如表1所示。在37 ℃、pH 8.0条件下,BcGalA酶水解pNP-α-Gal、棉子糖的比活力分别为(1.498±0.034)、(0.261±0.012)U/mg,但对半乳甘露聚糖无水解活性。
2.7 BcGalA的进化树构建与多序列比对
将BcGalA与GH4家族中其他来源的α-半乳糖苷酶进行比对,采用邻接法(Neighbor-joining method)构建系统进化树(bootstrap为1 000),结果发现,BcGalA与来源于枯草芽孢杆菌Bacillussubtilis的α-半乳糖苷酶聚为一支,亲缘关系最近(图3)。但该枯草芽孢杆菌来源的α-半乳糖苷酶仅进行了基因测序与功能注释,尚未开展其他研究。

表1 BcGalA底物特异性Tab.1 Substrate specificity of BcGalA

图3 GH4家族不同来源α-半乳糖苷酶的系统进化树Fig.3 Phylogenetic tree showing the relationship between BcGalA and α-galactosidase from other sources of GH4
将BcGalA与其他GH4中的α-半乳糖苷酶及6-磷酸-β-葡萄糖苷酶进行多序列比对,结果如图4所示,发现BcGalA中含有GXGS与NAD+结合的“指纹”模体,验证了BcGalA为GH4家族中的α-半乳糖苷酶。
3 讨论
3.1 BcGalA酶学性质比较
本研究中,在活性测定过程中发现,与GH4家族中来源于Bacillusmegateriu的BmelA相同[11],BcGalA在碱性条件下才具有活性,在pH为6.8的Tris-HCl缓冲液中BcGalA基本不具活性,这与其他倾向于在酸性或中性pH条件下发生反应的大部分α-半乳糖苷酶不同(表2)。此外,与其他菌株来源的α-半乳糖苷酶相比,除嗜热的芽孢杆菌,同样来源于海洋的巨大芽孢杆菌Bacillusmegaterium的α-半乳糖苷酶在能够耐受稍高温度的情况下,最适温度则相对偏低,猜测是因为该酶来源于海洋细菌,故最适温度不高。通常海洋来源细菌中的α-半乳糖苷酶具有20~40 ℃最适较低温度的特征,利于在肠道温度下反应的食品和饲料中应用。

Mel4A—来源于Bacillus halodurans (Accession: NP 243094)的α-半乳糖苷酶; MelA—来源于 Escherichia coli K12 (Accession: NP 418543)的α-半乳糖苷酶;CelF—来源于Escherichia coli (Accession: P17411)的6-磷酸-β-葡萄糖苷酶;▲—预测的NAD+结合氨基酸残基。Mel4A—α-galactosidase from Bacillus halodurans (Accession: NP 243094); MelA—α-galactosidase from Escherichia coli K12 (Accession: NP 418543); CelF—6-phosphate-β-glucosidase from Escherichia coli (Accession: P17411);▲—predicted NAD + binding amino acid residues.图4 源于GH4家族糖苷水解酶氨基酸的序列比对Fig.4 Amino acid sequence alignment derived from GH4 glycoside hydrolase
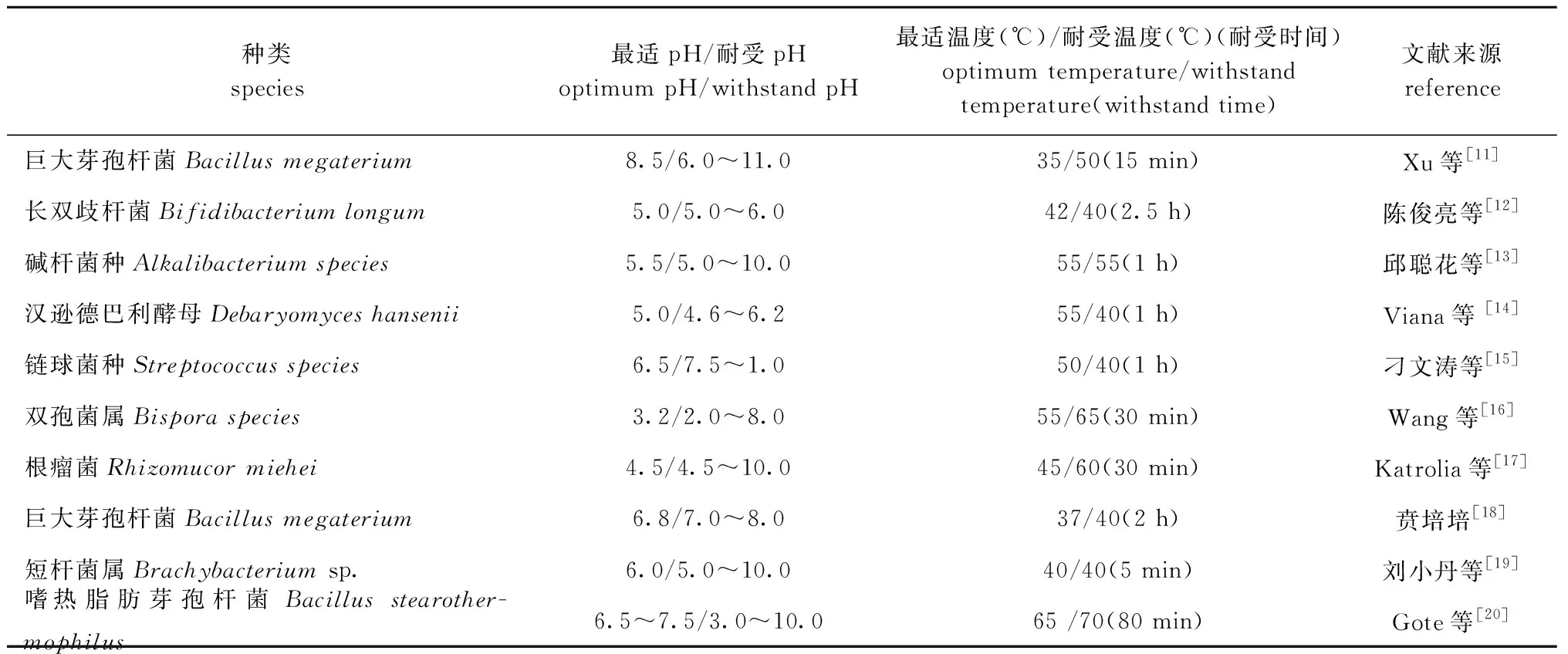
表2 部分α-半乳糖苷酶的酶学性质Tab.2 Several enzyme properties of α-galactosidase
3.2 BcGalA底物特异性
本研究中,对α-半乳糖苷酶BcGalA底物特异性进行测定显示,BcGalA水解pNP-α-Gal、棉子糖的比活力分别为(1.498±0.034)、 (0.261±0.012)U/mg(表1),这表明,BcGalA酶对pNP-α-Gal的水解活力高于对棉子糖的活力;而BcGalA对葫芦巴胶、瓜尔豆胶、刺槐豆胶等聚糖无水解活性,说明BcGalA是一种只能降解低分子量底物的α-半乳糖苷酶,这种底物特异性与同样为GH4家族来源于E.coli的K12MelA[21]及来源于Bacillushalodurans的重组Mel4A(rMel4A)类似[2],其原因可能是这些α-半乳糖苷酶的底物结合口袋不足以容纳更大分子量的底物。目前,针对α-半乳糖苷酶分为降解低聚寡糖和半乳甘露聚糖两类的原因尚不明确,通过底物共结晶等方式研究降解机制有助于了解α-半乳糖苷酶结构与降解模式的关系,加深对α-半乳糖苷酶的理解。此外,Heravi等[22]发现了Bacillussubtilis利用棉子糖家族(RFOs)的系统,同时也观察到在BacillusmegateriumVHM1中,该系统无法被更复杂的底物(如瓜尔豆胶或刺槐豆胶)诱导[23]。因此,推测在Bacilluscereus中也存在类似的棉子糖利用系统,仅由棉子糖等寡糖进行诱导,无法由聚糖诱导,而BcGalA在通路下游起到利用这些寡糖的作用。
3.3 BcGalA具有GH4水解酶特征
在水解糖苷键时需要NAD+,这种情况是GH4家族中的酶所特有的[24],同时研究发现,GXGS模体对NAD+的结合和活性均有至关重要的作用[25]。Yip等[26]探究了GH4家族需要NAD+与二价金属离子的原因,NAD+的存在表明存在氧化还原反应,与通用的糖苷酶机制不一致,金属离子在催化过程中不被消耗,并且在催化反应的末期未形成NADH,该水解反应不存在直接亲核取代步骤。该机制涉及阴离子过渡态,而不是在其他糖苷酶机制中广泛存在的阳离子过渡态,解释了GH4家族需要NAD+与金属离子的原因。从该家族的底物可以观察到广泛的底物特异性,是因为催化的关键位置在底物的C2和C3周围,而不是底物异头异构中心附近,且其具体催化位点并不确定,需要通过活性位点结构的微小变化适应广泛的底物特异性,因此,本研究中,通过特定的NAD+结合位点来判断是否属于GH4,结果显示,BcGalA具有GH4水解酶特征(图4)。
4 结论
1)海洋中含有丰富的多糖资源,海洋微生物是多糖降解酶的重要来源。本研究中从海洋来源的蜡样芽孢杆菌中克隆得到一个属于糖苷水解酶第4家族的α-半乳糖苷酶基因BcgalA,并利用基因工程技术将目的基因重组到表达载体pET28a上,成功构建了大肠杆菌原核表达菌株。
2)诱导表达的BcGalA纯化后成功获得了单一且清晰的条带,在37 ℃、pH 8.0条件下测得对pNPG-α-Gal、棉子糖的比活力分别为(1.498±0.034)、(0.261±0.012) U/mg,并对半乳甘露聚糖无活性,属于GH4中能降解寡糖而不能降解聚糖的α-半乳糖苷酶,与目前结构已解析的α-半乳糖苷酶同源性较低,揭示其具有独特的降解机制,具有进一步研究的价值。

