肝细胞癌患者血清癌基因和抑癌基因蛋白水平变化*
陈少华,吴 哲,魏志鸿,陈 鹏
肝癌为临床常见的恶性肿瘤之一,属全球第二大癌症死亡原因,主要包括胆管细胞癌和肝细胞癌(hepatocellular carcinoma,HCC),其中HCC近年来发病率呈逐年增长趋势,占我国肝癌总数的83.9%~92.3%,而在世界范围内占原发性肝癌(PLC)的70%~85%[1]。HCC形成过程较为复杂,致病因素包括病毒感染、代谢紊乱、过度饮酒、高黄曲霉毒素接触等[2-4]。报道显示,诸多基因,包括癌基因和抑癌基因,可能与肝癌的发生、细胞增殖和转移及预后密切相关,其中抑癌基因所编码的蛋白质可促使癌细胞增殖受抑,而癌基因表达产物可于体外诱导正常细胞转化,于体内诱发癌肿的发生。在某些因素影响下癌基因与抑癌基因表达异常,致使正常细胞癌变[5]。HCC的发生可能涉及癌基因转化基因(N-ras)、增殖相关基因(C-myc)、成纤维细胞生长因子(fibroblast growth factor,FGF)2、丝/苏氨酸激酶(PLK)1和抑癌基因铁调素(hepcidin)、清道夫受体(scavenger receptor class A,SCAR)A5和细胞周期依赖性蛋白激酶抑制剂(P16)等[6]。本研究检测了HCC患者血清癌基因N-ras、C-myc、FGF2、PLK1和抑癌基因Hepcidin、SCARA5、P16蛋白水平,旨在探寻HCC的发病机制,为HCC早期诊断提供新的标志物,并为其治疗提供新的靶点,现报道如下。
1 资料与方法
1.1 一般资料 2017年7月~2020年7月我院收治的慢性乙型肝炎(CHB)患者40例,代偿期乙型肝炎肝硬化(LC)患者25例,失代偿期乙型肝炎肝硬化31例,HCC 50例。诊断符合慢性乙型肝炎防治指南(2015年更新版)》[7]和《原发性肝癌诊疗规范(2011年版)》[8],排除精神疾患、混合细胞型肝癌、胆管细胞癌、转移性肝癌、其他部位恶性肿瘤、入组前半年内已行手术、介入或放化疗治疗、妊娠或哺乳期妇女。另选择同期健康体检者40例,男20例,女20例;年龄20~65岁,平均年龄为(45.8±3.0)岁。本研究获得我院医学伦理委员会批准,所有入组人员签署知情同意书。
1.2 血清检测 采用ELISA双抗体夹心法检测血清癌基因N-ras、C-myc、FGF2、PLK1和抑癌基因Hepcidin、SCARA5、P16蛋白(北京鼎国生物有限公司,美国Biotek公司生产的Epoch2型酶标仪)。
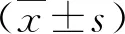
2 结果
2.1 不同肝脏疾病患者血清癌基因蛋白水平比较 与健康人比,慢性乙型肝炎、代偿期乙型肝炎肝硬化、失代偿期乙型肝炎肝硬化和HCC患者血清癌基因N-ras、C-myc、FGF2和PLK1蛋白水平显著升高(P<0.05),而以肝细胞癌组升高最显著(P<0.05,表1)。
2.2 不同肝脏疾病患者血清抑癌基因蛋白水平比较 与健康人比,慢性乙型肝炎、代偿期乙型肝炎肝硬化、失代偿期乙型肝炎肝硬化和肝细胞癌患者血清抑癌基因Hepcidin、SCARA5和P16蛋白水平显著降低(P<0.05),而以肝细胞癌患者降低最显著(P<0.05,表2)。

表1 不同肝脏疾病患者血清癌基因蛋白水平比较
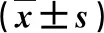
表2 不同肝脏疾病患者血清抑癌基因蛋白水平比较
3 讨论
肝癌属世界上第六大常见癌症,其发生伴随着原癌基因的激活和肿瘤抑制基因的失活等多个阶段和过程。发病较为隐匿,恶性程度高,进展速度较快,复发转移早,病死率高。对于肝癌的防治研究一直是我国临床和基础研究的热点[9]。HCC是肝癌最常见的亚型,近年来其死亡率在全球范围内呈上升趋势,其发病机制尚未完全明确,可能是内源性因素(如过度饮酒、环境因素等)与外源性因素(如乙型或丙型肝炎病毒感染等)共同作用的结果[10]。报道认为,癌症的发生是由多种癌基因共同作用的结果,而肝细胞的癌变属多基因参与、多步骤发展的复杂生物学过程,其本质是由细胞原癌基因激活与抑癌基因失活所致[11]。由原癌基因激活和抑癌基因失活所致的癌变本质上是以基因突变和扩增、染色体易位、基因插入等形式的基因突变诱发的,这类突变经异常调控细胞周期或信号传递致使肿瘤生长,故癌基因或抑癌基因突变产物可作为细胞癌变的可靠指标[12]。N-ras、C-myc和P16等在肝癌患者存在异常表达,其具体的生物学发生机制尚未完全明确[13]。
本研究HCC组血清癌基因N-ras、C-myc、FGF2和PLK1蛋白显著高于健康人和各种慢性肝病患者,慢性乙型肝炎组、代偿期乙型肝炎肝硬化组和失代偿期乙型肝炎肝硬化组上述癌基因蛋白水平显著高于健康人,但各组之间并无显著性差异,表明血清癌基因N-ras、C-myc、FGF2和PLK1上调可能参与了HCC的发生和发展过程。HCC患者癌基因N-ras和C-myc呈高水平表达,两者均参与了HCC的恶性转化过程,并在HCC的发生发展过程中相互协同以维持HCC的恶性表型[14]。癌基因PLK1和FGF-2及抑癌基因SCARA5和Hepcidin在HCC发生、治疗和预后观察中有重要的意义,为HCC致病机理研究开辟了新的途径[15]。癌基因属一类可导致正常细胞向恶性转化的核酸片段,而抑癌基因属正常细胞中含有抑制细胞恶性增殖的基因,两者均正常存在于机体内。一旦两者在机体内失衡、失活或突变,则会导致肿瘤的形成。N-ras是人原发性肝癌中的一个转化基因,属于G蛋白家族,当出现点突变、染色体重排或基因扩增而被激活时,会引起细胞膜跨膜信号传递改变,促进细胞分裂增加,诱发异常分化,直至癌变,在HCC的形成和发展过程中发挥着重要的作用;C-myc属一类核蛋白调控基因,与肿瘤细胞增殖活性、细胞分化和凋亡有关,其与蛋白配体进行寡聚化后形成异二聚体复合物,可结合特异性DNA序列,激活或抑制诸多靶基因转录,干扰转录功能,引起细胞生长、分化和调亡[16];FGF2属细胞间信号分子,已被证实广泛参与人体细胞的生长代谢,可通过影响间叶细胞生长,诱导内皮细胞有丝分裂。FGF2还可刺激内皮细胞,促进血管生成,诱导血管细胞增殖、迁移和分化[17]。PLK1属于高度保守的丝/苏氨酸激酶,可从不同途径调节细胞周期的启动,其过表达能引起细胞有丝分裂检查点失控,导致基因组不稳定,加快增殖速度,促进消化道肿瘤的形成[18]。N-ras可能参与癌前肝细胞的增殖和恶性转化,对于HCC的形成和发展具有重大意义。C-myc在HCC患者呈现过度表达,其异常表达造成癌基因的激活,可能引起肝细胞异常增殖,导致肝细胞向恶性转化,引起癌变,与HCC的发生发展密切相关。FGF2可能与肝癌细胞的增殖转移有关,参与了HCC的发病过程。PLK1可与多种底物结合,调节细胞有丝分裂和胞质分裂等过程,其高表达可能直接导致了HCC的形成。
本研究HCC组抑癌基因Hepcidin、SCARA5和P16蛋白显著降低,而各组慢性肝病患者之间并无明显的改变,说明抑癌基因Hepcidin、SCARA5和P16的下调可能参与了HCC的发病过程。抑癌基因hepcidin、SCARA5和P16可能参与了HCC的发生和发展过程[19]。抑癌基因hepcidin主要在肝脏中合成,主要功能是进行铁调节。当其呈低表达时会促使肝癌细胞中铁蛋白释放铁离子入血清,同时强化人体小肠对铁离子的吸收,致使人体整个血清铁离子含量显著升高,而大部分HCC患者体内含铁量过高,故推测其是抗肿瘤防御机制的重要部分;SCARA5属清道夫受体家族新成员,可经干扰酪氨酸磷酸化激活FAK信号通路,调节癌细胞生长、增殖和迁移;P16是直接参与细胞周期调控的新型抑癌基因,其作用于CDK4或CDK6,抑制周期素D结合CDK4/CDK6,预防pRb磷酸化和E2F因子释放,将细胞周期阻滞于A期,从而促使细胞增殖受抑[20]。HCC细胞增殖往往需要氧,而氧需要铁运输。铁离子越多,癌细胞增殖就越快,故推测hepcidin是抗肿瘤防御机制的重要部分,与 HCC的发生和发展密切相关;SCARA5在HCC患者呈低表达,可能与SCARA5启动子区甲基化有关,或是其他基因组成的沉默复合物发挥了作用,具体机制还需要进一步的深入研究;P16失活可引起细胞过度增殖、细胞周期加速,在HCC的发生、发展和转移过程中发挥着重要的作用。

