同化和共代谢降解氯苯菌株的筛选与特性研究
郭江枫,邢志林,王永琼,曹 昆,张学炼,苟 芳,石云椿,刘莉莎,赵天涛 (重庆理工大学化学化工学院,重庆 400054)
氯苯(CB)是重要的有机溶剂和化工生产中间体,广泛应用于有机合成、医药、农药、制革等工业生产[1-3],导致CB 污染遍布全球,甚至南极大陆和北极积雪中均有检出[4-6],其化学性质稳定,挥发性强,已成为水、土壤、沉积物和大气环境中最普遍、最严重的氯代有机污染物之一[7-10].CB 已被美国环境保护署(USEPA)纳为优先控制污染物,其持久性和毒性作用对人类和生态环境构成了严重威胁,如何有效实现环境中CB 的去除已成为氯代有机污染物降解领域研究的热点.
研究者提出了许多物化法去除环境中CB,包括吸附[11]、化学氧化[12]、光化学氧化[13]、电化学[14]、等离子体[15]等.这些方法往往需要大量能量,且价格昂贵,无法进行广泛应用.与物化法相比,生物法具有耗能小、反应条件温和、处理成本低和二次污染小优势,在CB 降解中具有重要的应用潜力.CB 结构稳定,其生物降解性能依赖高效微生物菌株,国内外针对功能菌株分离已开展多年研究,已分离的能够降解CB 的纯菌株包含了十几个菌属,模式菌株主要有红球菌属(Rhodococcus)[16],伯克菌属(Pandoraea)[17],皮氏罗尔斯通菌属(Ralstonia)[18],葡萄球菌属(Planococcus)[19]和芽孢杆菌属(Bacillus)[20].已分离菌属主要来自于污染的土壤、泥浆和水体沉积物,CB 降解率约为70%~93.4%[21-23].CB 降解菌的分离纯化尽管已开展多年,但由于菌株的耐受浓度低,环境适应能力差,可用于环境中CB 修复的菌株还十分有限[24],已分离的功能菌株对CB 耐受性普遍低于150mg/L,CB 代谢速率为0.56~1.33mg/(L·h)[25-27],难以满足大规模应用的需要.挖掘高效CB 降解的生物资源一直是该领域关注的重点.
研究表明,厌氧条件下CB 可通过还原脱氯途径发生转化,但该过程CB 生物降解往往十分缓慢,且易形成致死及二次污染物[28];好氧条件下CB 可作为某些微生物的生长底物,为微生物提供碳源和能源发生转化;此外,好氧条件下CB 也可被微生物通过共代谢途径实现转化.与厌氧降解相比,CB 的好氧生物转化具有降解速率快,矿化彻底等优势,更适合环境原位生物修复应用[29],CB 好氧转化是当前关注重点.污染场地环境中氧化还原电位、有机质含量(生长底物)等的时空分布差异很大,而已分离的微生物对CB 降解往往只能通过一种途径,这进一步限制了单一功能菌株的应用范围[30].因此,筛选具有高耐受和广泛适应能力的CB 降解菌株,开展降解特性研究,对CB 污染场地的原位生物强化具有重要的理论和现实意义.
基于此,本研究基于CB 污染土壤筛选功能菌株并进行系统发育分析,考察CB 为底物条件下菌体的生长特性、CB 的耐受浓度和降解特性,及不同底物条件下CB 的共代谢降解特性,并分析了环境因子对菌株降解CB 的影响.研究结果将丰富CB 降解功能菌生物库,并为CB 类有机污染物的原位修复提供重要支撑.
1 材料与方法
1.1 样品采集
污染土壤采自重庆市大渡口区原重庆钢铁股份公司动力厂五万立方煤气柜周边污染土壤(106°29′20″E,29°28′30″N),该场地是上世纪40 年代配套型钢厂生产而建设,在2010 年随着重钢的搬迁逐步停产,该土壤污染物主要包括铅、镉等重金属,C3~C35 类石油烃及CB、五氯苯(PeCB)等氯代芳烃.污染土壤取4mm 筛下和2mm 筛上颗粒.
1.2 培养基配制
无机盐培养基:CaCl20.1g,MgSO4·7H2O 0.4g,NH4Cl 2.02g,KH2PO43.0g, Na2HPO4·12H2O 17.7g,NaCl 0.5g,蒸馏水1L,pH 值:6.5~7.0.
LB 培养基:酵母粉5.0g,蛋白胨10.0g,NaCl 5.0g,蒸馏水1L.
选择性培养基A:酵母粉5.0g,蛋白胨10.0g,NaCl 5.0g,蒸馏水1L,一定浓度的CB(阿法埃莎(天津)化学有限公司,分析纯),pH 值:6.5~7.0(固体培养基+1.5%~2.0%的琼脂).
选择性培养基B:CaCl20.1g,MgSO4·7H2O 0.4g,NH4Cl 2.023g,KH2PO43.0g,Na2HPO4·12H2O 17.7g,NaCl 0.5g,蒸馏水1L,一定浓度CB(固体培养基+1.5%~2.0%的琼脂).培养基所需药品来自于成都市科龙化工试剂厂,分析纯.
1.3 菌株的分离与鉴定
取污染土壤10g,置于装有100mL 去离子水的250mL 的锥形瓶中,在30℃、160r/min 的摇床中充分振荡3h.静置20min 后取上清液10mL 接种于装有100mL LB 培养基的250mL 锥形瓶中,同样条件培养72h.保存作为种子液.
取富集后种子液5mL 加入到装有50mL 选择培养基B 的125mL 血清瓶中,分别加入60,130,200mg/L 的CB,置于30℃、160r/min 摇床中培养.3d 后,取5mL 菌液接种选择培养基A 中,相同条件培养.以相同方式连续4 次传代培养,过程中连续监测OD600和CB 浓度变化.
将所获得混合菌进行梯度稀释,将稀释梯度为10-3、10-4和10-5的菌液涂布在选择性固体培养基B 中,CB 浓度为200mg/L,置于30℃的恒温培养箱中培养,观察到肉眼可见的菌落长出,挑取生长较快、个体较大的单菌落进行多次平板划线,直到得到单一菌株.将纯化菌株接种到以CB 为唯一碳源的液体培养基B 中传代培养.以上均要在无菌操作台中进行.
将纯化后的菌株在固体培养基上进行划线培养,待长出单个菌落后进行形态观察并进行革兰氏染色.取上 述细菌培养液 1~5mL 用 Mobio PowerSoil® DNA Isolation Kit 试剂盒提取样品中微生物总基因组 DNA,并利用通用引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R (5′-GGTTACCTTGTTACGACTT-3′)对细菌16S rRNA基因进行PCR 扩增.25 μL 扩增体系为:DNA 模板1 μL,1.1×T3Super PCR Mix22mL,27F (10μmol/L)和1492R (10μmol/L)各1 μL.PCR 扩增程序为:98℃3min;98℃ 10s,58℃ 10s,72℃ 10s,30 个循环;72℃2min.获得的PCR 产物取5μL 进行3%琼脂糖凝胶电泳,使用切胶回收目的片段进行DNA 测序,DNA 的测序委托四川擎科生物公司完成.降解菌16S rRNA基因序列通过BLAST 程序与GenBank 中核酸数据进行比对分析.利用MEGA 7.0 软件[31]进行聚类分析,设置Bootstrap 值为1000,采用Neighbor-joining法进行系统发育分析.
1.4 菌株生长曲线的测定

1.5 菌株对CB 的降解实验
1.5.1 同化降解实验 无菌条件下,功能菌株接种到含选择性培养基A 中,在30℃、160r/min 条件下培养5d,4000r/min 离心10min,去除上清液,用无机盐培养基(已灭菌)重悬,重复上述步骤2次,最终OD600=0.7.以此菌悬液为初始接种物.以CB 为唯一底物,设置培养基中CB 浓度为60~200mg/L,取2.5mL 上述菌悬液接种培养基中,30℃、160r/min 振荡培养,设置接种灭活菌液为对照组,所有组别一式3 份,每隔24h 取样,检测菌体生长和CB 浓度变化情况.
1.5.2 共代谢降解实验 以柠檬酸钠和琥珀酸钠为生长底物,浓度为4g/L,CB 为共代谢底物,CB 浓度为20~160mg/L.不同体系中接种对数期的菌悬液,使初始OD600达0.1 左右,聚四氟乙烯吕塞密封后于160r/min、30℃的摇床中培养,检测CB 浓度和菌体浓度变化情况.
1.5.3 环境因子影响试验 设置单因素实验,分别考察共代谢条件下温度(20,25,30,35,40℃),pH 值(4.0,5.0,6.0,7.0,8.0,9.0)和接种量(1%,2.5%,5%,7.5%,10%)对菌体生长及CB 降解的影响.在50mL 已灭菌的无机盐培养基中加入CB 以及0.2g 的柠檬酸钠作为碳源,并接种培养至对数生长期的菌悬液,使初始OD600达到0.1 左右,具塞密封后置于不同条件下培养,检测单一变量条件下菌体浓度和CB 浓度变化情况.
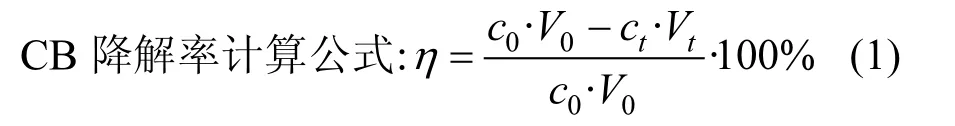
式中:η为CB 降解率;c0和ct分别表示CB 的初始浓度和t 时刻CB 浓度,mg/L;V0和Vt分别表示溶液初始体积和t 时刻液体体积mL.
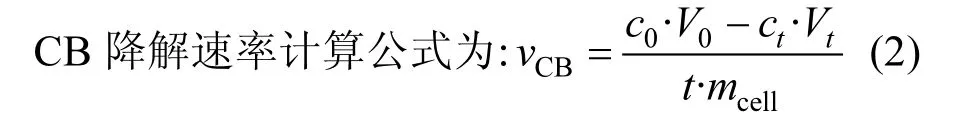
式中:VCB为CB 降解速率mol/(gcell·h);t 为时间,h;mcell为菌体浓度,mg/L;

式中:Scell表示细胞平均增长速率gcell/(molCB·h);ct'、c0'表示t 时间和初始时细胞的浓度,mg/L;Vt'、V0'分别表示t 时刻和初始时刻培养基体积,mL;
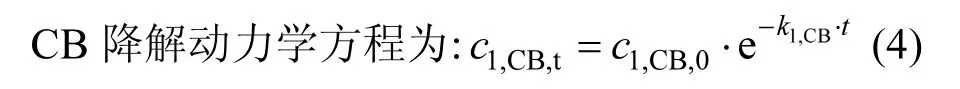
式中:c1,CB,0、c1,CB,t分别表示CB 初始浓度和第t 时刻CB 浓度,mg/L;k1,CB为CB 的降解速率常数.
1.6 分析检测
CB 浓度的测定:采用气相色谱(重庆川仪分析仪器有限公司,SC-8000)定量分析气相中CB 浓度,色谱柱为不锈钢色谱柱GDX04 2m;气相色谱条件:进样器温度、柱温和ECD 检测器温度分别为80,120和200 ℃;氮气为载气,载气流速为40mL/min;尾吹气速为 10mL/min;进样量为 0.5mL;基流补偿为0.00nA.
菌体浓度的测定:采用752 型紫外/可见分光光度计(上海舜宇恒平科学仪器有限公司),在600nm波长下测定菌体的吸光度(OD600).
数据用Excel 2016 软件统计和分析,origin 9.0做图.最大比生长速率(µmax,h-1)通过内插法计算.
2 结果与讨论
2.1 CB 降解菌的分离与鉴定
以CB 为唯一底物对菌液进行平板划线,经多次分离纯化,获得能以CB 为碳源和能源生长的菌株.该菌株在选择性固体培养基上培养3d 后,菌落呈圆形,乳白色或粉红色,菌落直径0.5~0.8mm,长0.9~2.0mm(图1(a));电镜扫描显示该菌株为短杆状,菌体长为1.0~1.5μm,直径为0.6~0.8μm,经革兰氏染色显示为阴性(G-).将菌株的16sRNA 基因序列通过NCBI BLAST 与GenBank 对比,构建基于16S rRNA基因的系统发育树,结果如图1(c)所示.比较发现该菌株与粘质沙雷氏菌Serratia sp. strain RJ-10-16、Serratia sp. strain RJ-10-14、Serratia marcescens strain AG2105、Serratia sp. strain KUJM3、Serratia marcescens strain DAP32 等菌株的同源性为99%,该菌株与CB 降解菌Escherichia sp. strain hermanii 同源 性 较 近, 与 Ralstonia pickettii strain L2 、Pseudomonas sp. JS6 和Labrys portucalensis strain F11 同源性相距很远,将其命名为Serratia marcescans TF-1(保藏号:M 2019674,专利号:201911162719.4).现有已报道的同类菌株可用于降解五氯酚[32]、氰化物[33]、甲硫磷[34]和柴油[35]等的物质,本文中分离的菌株是首次发现的具有CB 降解功能的沙雷氏菌.对TF-1 进行生长曲线的测定,通过Boltzmann 方程模拟确定了TF-1 菌株的生长模型(图1(d)).该菌在0~20h 生长较慢,20h 之后迅速进入生长期,说明该菌能够较快的适应生长环境,70h 进入稳定期.在菌株培养50h 后,菌株的OD600达到约1.0,拟合得到最大比生长速率(µmax)为0.04h-1(R2=0.987).
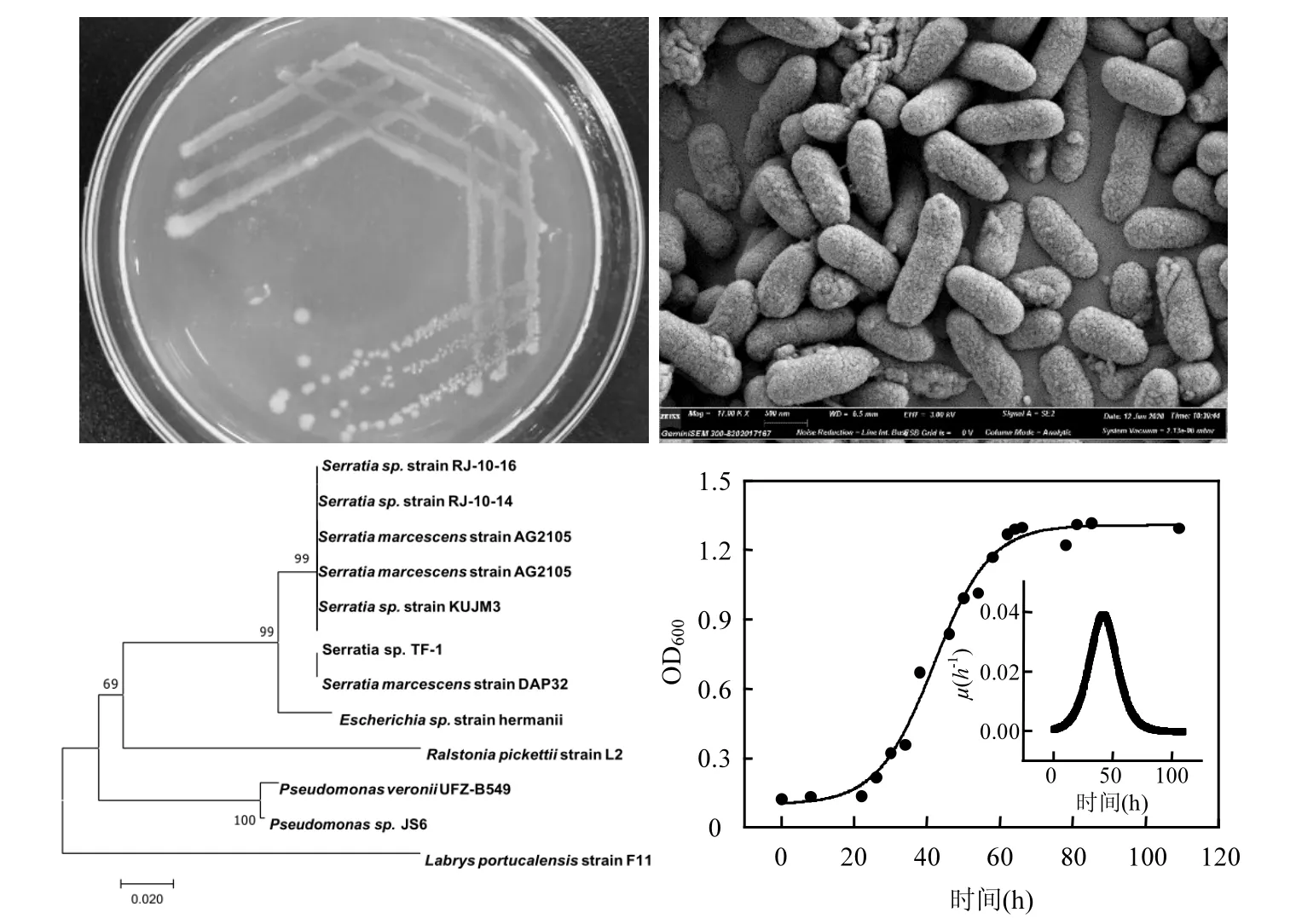
图1 TF-1 的菌落形态及生长曲线Fig.1 Colony morphology of strain TF-1 and construction of phylogenetic tree
分别以CB、葡萄糖、乳糖、乙酸钠、琥珀酸钠、柠檬酸钠、乙醇和苯酚为唯一碳源考察了TF-1 的底物范围,结果如表1所示.以葡萄糖为底物时,TF-1生长情况最佳,OD600值最大为0.52±0.031;其次以琥珀酸钠和柠檬酸钠底物时,TF-1 最大OD600值为0.37~0.49.以CB 和乳糖为底物时,TF-1 生长减缓,OD600的最大值为0.23~0.3,表明功能菌TF-1 对其利用难度较大.以苯酚和乙醇为唯一碳源时,功能菌TF-1 无增长,可能是因为苯酚的特殊结构以及乙醇的灭菌功能使得TF-1 对其难以有效的代谢,导致TF-1 无生长[36].
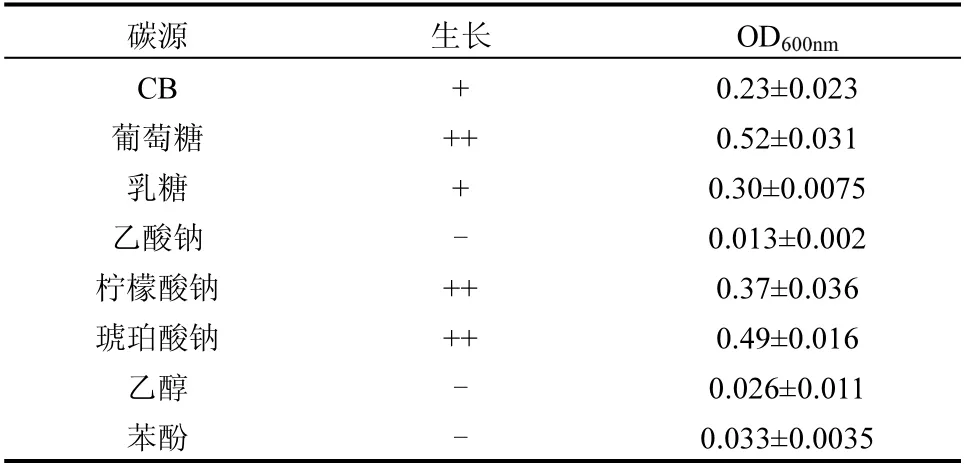
表1 Serratia marcescans TF-1 对不同碳源的利用情况Table 1 Growth of Serratia TF-1on Different Carbon Sources
2.2 TF-1 同化降解CB
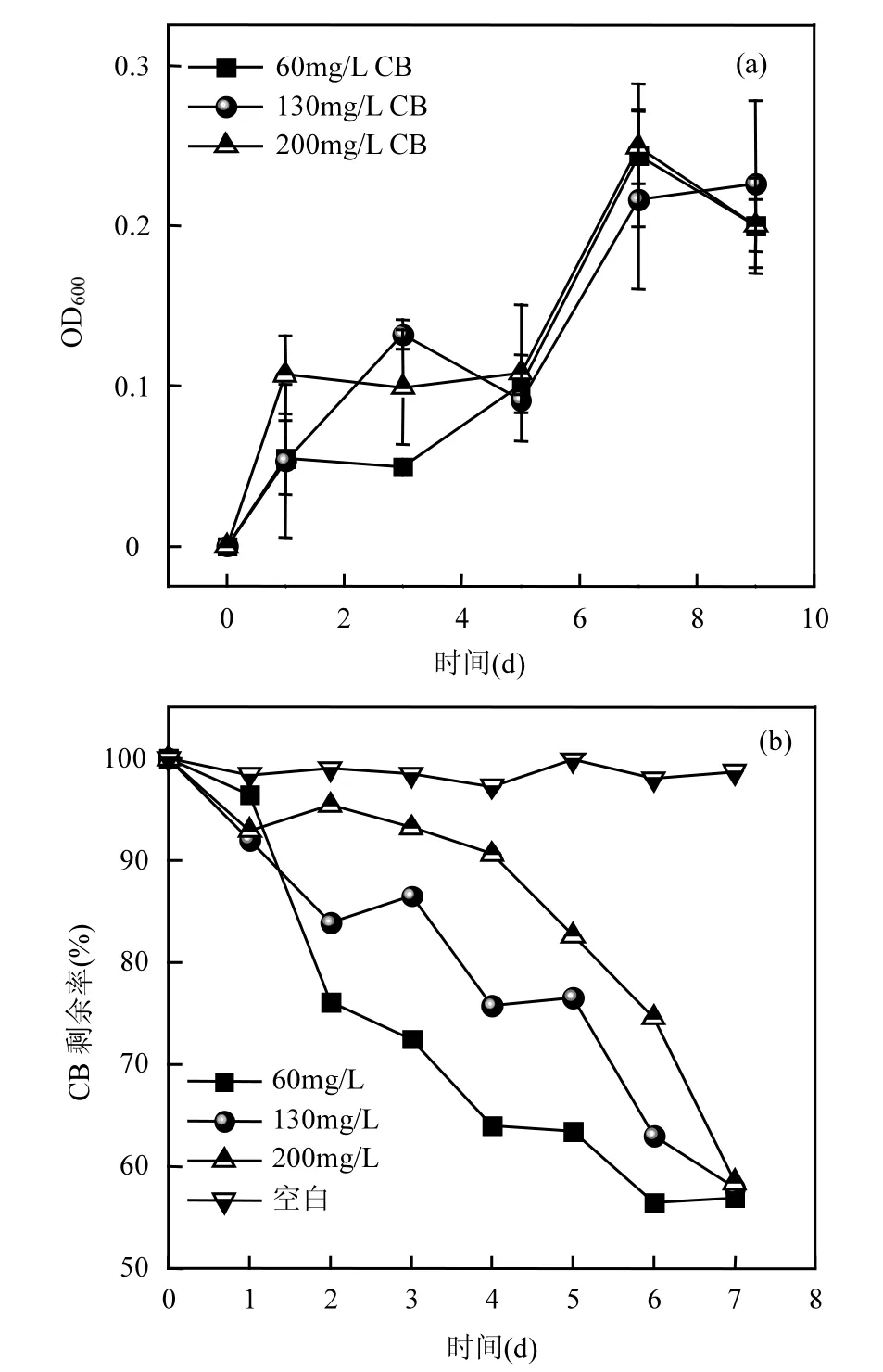
图2 以CB 为底物TF-1 的生长及CB 浓度变化曲线Fig.2 CB as substrate TF-1growth and CB concentration change
与其他生物降解方式相比,同化降解可直接将污染物转化为无机物,优势显著.考察以CB 为唯一底物TF-1 的生长情况及对其降解特性.不同CB 浓度下TF-1 的生长如图2(a)所示.实验条件下,TF-1 在所有浓度上均能生长,前4d 生长缓慢,OD600增加缓慢,第5d 进入对数期,最大比生长速率为0.015~ 0.42h-1,细胞平均增长速率为0.0063~0.022gcell/ (molCB·h). CB 剩余率随时间变化如图2(b)所示,空白组中CB 剩余率几乎无变化,实验组中CB 剩余率随时间逐渐减小,表明CB 被菌株消耗,相同时间内,CB 浓度越大,剩余率越大.CB 的降解特性参数如表2 所示.随着CB 浓度增大,CB 降解速率(VCB)逐渐减小,变化范围为1.35~4.47mol/(gcell·h),是当前已报道CB 降解速率的2 倍[21].随cCB增大,CB 降解能力下降, TF-1 对低浓度CB 利用率更高,表明CB对TF-1具有毒性作用;而最高菌体浓度无显著性差异,在cCB为200mg/L 的降解率仍有41.6%,表明该菌株具有高的CB 耐受性.
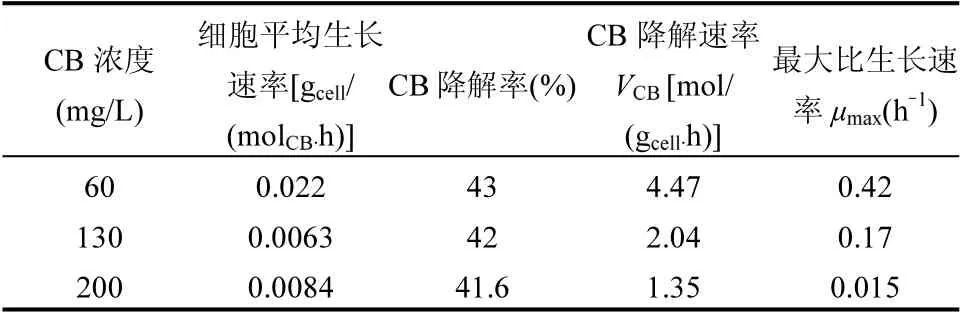
表2 CB 同化降解特征参数Table 2 Characteristic parameters of CB assimilation degradation
2.3 共代谢条件下CB 的生物转化
实验发现以葡萄糖和乳糖为底物时,无CB 降解,本文以琥珀酸钠和柠檬酸钠为底物考察了CB 的共代谢降解特性,结果如图3所示,与仅以CB为唯一碳源相比,琥珀酸钠和柠檬酸钠作为底物促进TF-1 生长.以琥珀酸钠为底物,cCB<60mg/L 时,对TF-1 生长的影响微弱;cCB>80mg/L 时,TF-1 生长显著抑制;以柠檬酸钠为底物,cCB<100mg/L 时,对TF-1 生长影响较小;cCB>120mg/L 时,TF 生长受到抑制,表明柠檬酸钠为底物TF-1 的耐受性更高.最大比生长速率µmax随cCB的变化如图3(e)所示,cCB<80mg/L 时,µmax(柠檬酸钠)(0.21~0.87h-1)>µmax(琥珀酸钠)(0.20~0.81h-1), cCB>80mg/L时,µmax(柠檬酸钠)(0.086~0.21h-1)<µmax(琥珀酸钠)(0.17~0.25h-1),说明在低CB 浓度下,柠檬酸钠为底物促进作用较强,在高CB 浓度下,以琥珀酸钠为底物更有优势,总体上µmax随着CB 浓度的升高而降低,说明功能菌TF-1 受到CB 的毒性作用增强.
共代谢条件下,CB 剩余率随时间变化如图3(b)、3(d)所示,其降解趋势基本相同,在cCB<20mg/L时,CB 的抑制毒性较小,5d CB 去除率为98%,随着cCB升高,CB 剩余率也逐渐升高, cCB为40~60mg/L时,CB 剩余率为20%左右,当cCB>80mg/L 时,CB 的降解影响较小,5d后CB剩余率基本维持在40%左右,分析原因可能是柠檬酸钠和琥珀酸钠均为小分子有机碳源,诱导TF-1 产生相关酶的能力相近[37].
TF-1 对CB 的降解符合一级动力学反应.动力学常数k 随cCB的变化如图3(f)所示.一阶动力学常数基本维持在6.8~13.9h-1之间.CB 降解率随cCB的变化如图3(g)所示.不同底物条件下,随cCB增大,CB降解率变化趋势相同,均随浓度增大而降低;cCB相同时,柠檬酸钠为底物的降解率略高(不超过5%).VCB随cCB的变化如图3(h)所示.cCB<80mg/L 时,VCB(柠檬酸钠)(0.15~0.47mol/(gcell⋅h))<VCB(琥珀酸钠)(0.17~0.48mol/(gcell⋅h)),cCB>80mg/L 时,VCB(柠檬酸钠)(0.61~1.11mol/(gcell⋅h))>VCB(琥珀酸钠)(0.56~0.95mol/(gcell⋅h)),表明在低浓度CB 污染时,琥珀酸钠为底物更利于CB 的降解,高浓度CB 污染时,柠檬酸钠为底物则更佳.共代谢降解速率受生长底物和共代谢底物浓度比的影响,该研究表明最适生长底物/共代谢底物浓度比受底物种类的影响.

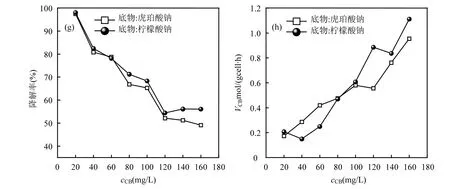
图3 TF-1 对CB 的共代谢降解特性Fig.3 Co-metabolic degradation properties of TF-1on CB
2.4 CB 生物降解的影响因素
温度、pH 值和接种量是微生物生长和有机物降解的重要影响因素,考察了3 个因子对TF-1 生长及CB降解的影响.温度对TF-1的生长及CB降解的影响如图4所示.由图4(a)可知,15℃条件下,4d内微生物几乎无生长,在20~35℃内,微生物均能生长,30℃ TF-1 生长速率最快,48h 达到稳定期.一定范围内温度升高,可促进微生物活性,但温度过高也会使酶活降低甚至失活,当温度达到40℃时,TF-1几乎无生长.综上,TF-1在20~35℃温度范围内生长良好,最适生长温度为30℃ .
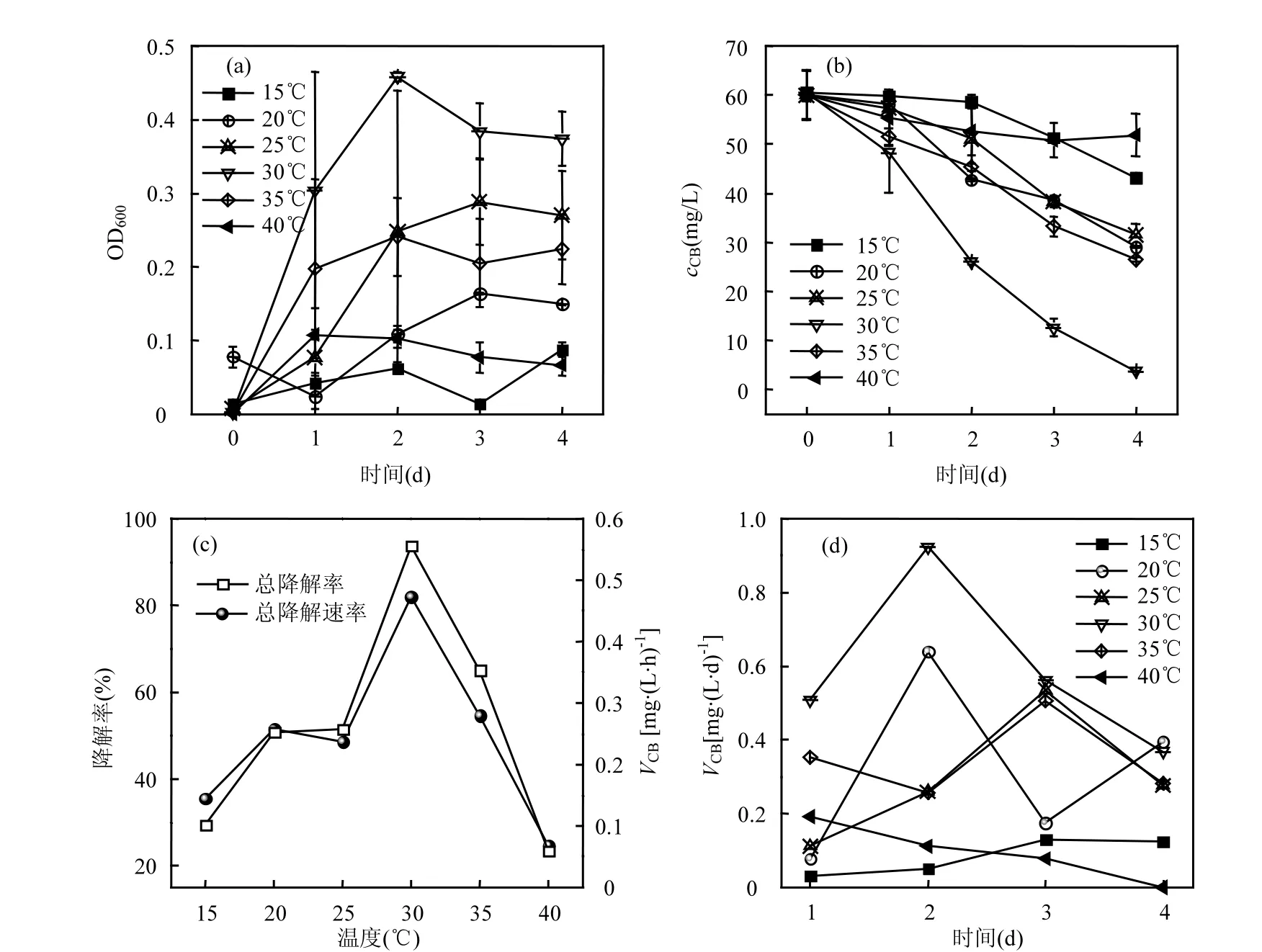
图4 温度对TF-1 的生长及CB 降解的影响Fig.4 Effect of temperature on the growth of TF-1and the degradation of CB
与生长情况类似,15℃时,由于TF-1 无生长,4d内cCB无显著变化;20~35℃范围内, cCB均有所下降,30℃时浓度下降最快(图4b),30℃时降解率和VCB最大,分别为93.7%和0.47mg/(L·h) (图4c),表明TF-1对CB 的最适共代谢降解温度为30℃ .不同温度条件下VCB随时间的变化如图4(d)所示,均在第2~3d VCB达到最大值,为0.11~0.92mg/(L·h),此时微生物浓度最大.
pH 值对TF-1 的生长及CB 的降解影响如图5所示.设置pH 值范围为4~10,pH 值在5~8 范围内,TF-1 生长无显著影响;pH 值为9 时,延迟期显著增大,7d 后,耐受性提高后,菌体浓度微量增大;当酸碱性持续增强,pH 值为4 或8 时,11d 内,菌体无生长(图5a).在各pH 值条件下, cCB均呈下降趋势,pH 值为7 时,cCB下降最快,表明该条件下菌体酶活性最强;pH 值为5、6、8 和9 时,cCB变化趋势基本一致;pH值为10 时CB 的残余量最高,为34.81mg/L,降解率最低为38%;pH 值为4 时,降解率为47%,表明在酸性条件或是碱性环境中均对CB 有降解能力(图5b).图5(c)为CB 降解率随pH 值的变化曲线,在pH 值为7时降解活性最强;进一步证实该菌属可适应多种酸碱环境,在中性环境中活性最强.图5(d)表示TF-1 每天的降解速率,从图中可以看出,在第2d 和第6d 均出现峰值,可能是因为初始TF-1 需要利用CB 进行繁殖生长,随着时间增长,TF-1 在胁迫条件下可能分泌的一些物质缓和了培养基中的酸碱度,在第6d 培养基中pH 值维持中性范围,TF-1 的活性得以恢复,所以导致第2d 和第6d 对CB 降解率均达到最大.
本实验选取的生物接种量为1%~10%,接种量对菌株TF-1 的生长及CB 降解的影响如图6 所示.随着接种量的增加,微生物的生长及CB 降解趋势基本一致(图6a、6b 所示),如图6(b)所示,接种量为1%、2.5%、5%、7.5%、10%时,CB 最终降解率无显著差异,降解菌生物量的升高短期内会促进CB的生物降解,但不影响最后的降解以及微生物的生长.图6(c)为不同接种量下CB 总降解率及总降解速率,降解速率接种量为5%时降解率和VCB达到最大值,分别为72%和0.19mg/(L·h).不同接种量条件下,VCB随时间的变化曲线如图6(d)所示.第6d VCB值最大,可能是因为在第6d相关酶量积累到了最大值从而提升了 VCB.综上所述,接种量为5%时是TF-1 的最适接种量.
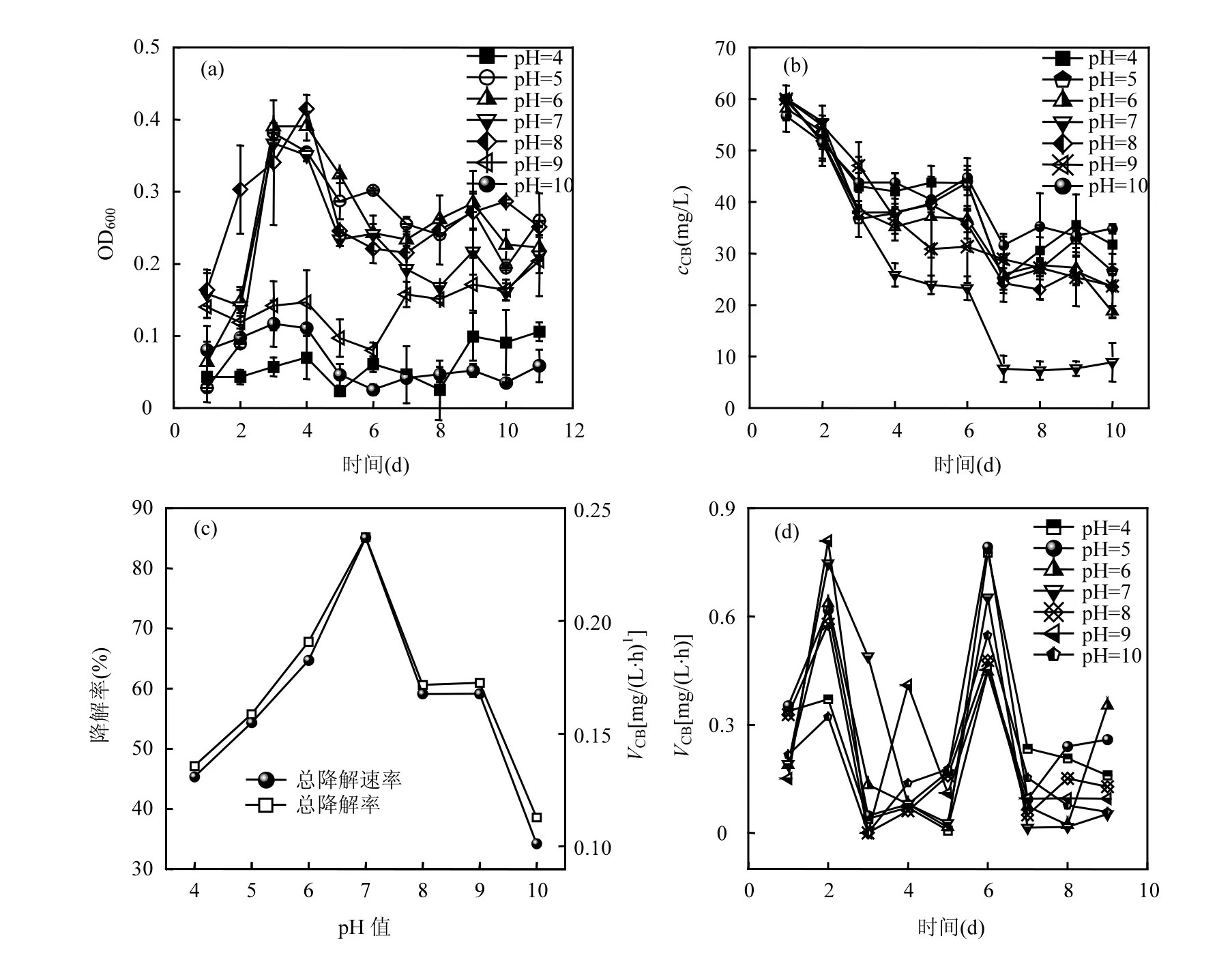
图5 pH 值对TF-1 生长及CB 降解的影响Fig.5 Effect of pH on TF-1growth and CB degradation
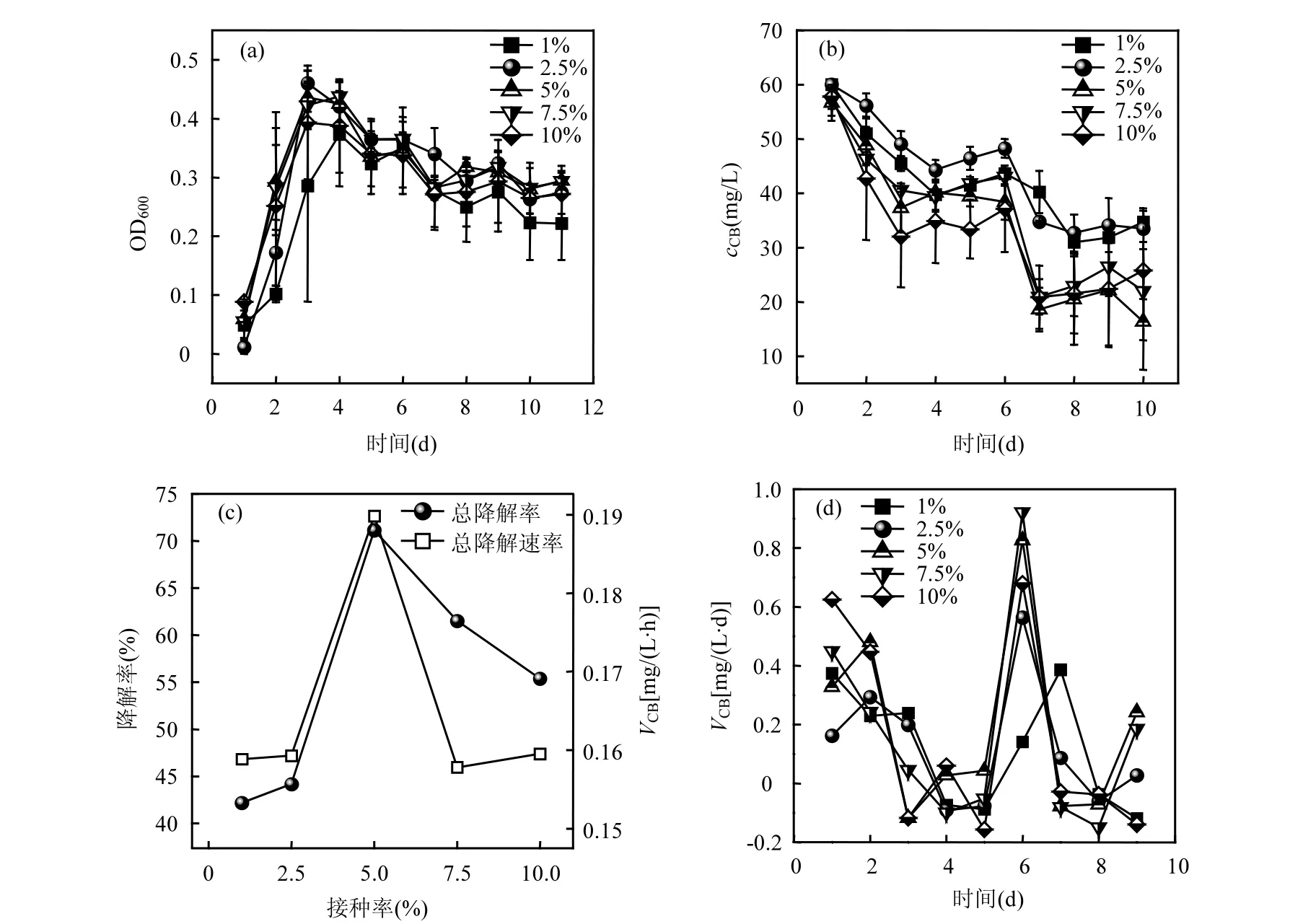
图6 接种量对TF-1 生长及CB 降解的影响Fig.6 Effect of inoculum on TF-1 growth and CB degradation
对CB 降解微生物进行了广泛调研,如表3 所示,与现有已知菌株相比,TF-1 的生长温度范围更广耐酸碱能力更强.TF-1 的 CB 耐受浓度超过200mg/L,远高于现有报道微生物的耐受浓度[21].污染场地环境复杂,作为持续性有机污染物,CB 降解困难,贫营养和富营养场地中均有污染,异养同化菌株在贫营养场地中适用性更强;研究表明,共代谢降解速率比同化速率更快,富营养场地中共代谢菌株适用性更强.当前功能菌株主要通过单一途径对 CB 进行降解,限制菌体的广泛使用,TF-1 不仅能够异养同化氯苯,还可以琥珀酸钠、柠檬酸钠等为底物共代谢降解CB,TF-1 适用范围更广,可为贫营养和富营养污染场地CB 的修复提供重要的生物资源.

表3 CB 降解的细菌比较Table 3 Comparison of CB degrading bacteria
3 结论
3.1 粘质沙雷氏菌Serratia marcescens TF-1 可利用葡萄糖、乳糖、柠檬酸钠、琥珀酸钠、CB 等多种有机物为底物进行生长.CB 为底物时TF-1 的µmax为0.022gcell/(molCB·h),VCB为1.35mol/(gcell·h),对CB 耐受性高于200mg/L;随cCB增大,VCB和µmax逐渐减小.
3.2 以琥珀酸钠和柠檬酸钠为底物,TF-1可共代谢降解CB.VCB最高分别为0.95 和1.11mol/(gcell⋅h),cCB<80mg/L时,柠檬酸钠更能促进微生物生长;当cCB>80mg/L,VCB(柠檬酸钠)(0.61~1.11mol/(gcell⋅h))>VCB(琥珀酸钠)(0.56~0.95mg/(L·h)),此时以柠檬酸钠为底物更利于CB 降解.
3.3 TF-1 在20~35℃范围内生长良好,30℃为最适生长温度,平均VCB为0.472mg/(L·h);TF-1pH值为5~9 时生长良好,最适pH 值为7,平均VCB为0.237mg/(L·h);接种量为5%时,CB 降解能力最强.TF-1 具有相对较高的CB 耐受性和耐酸碱特性,可同时进行同化和共代谢降解CB.

