2-18F-氟丁酸作为PET/CT 显像剂可行性的初步研究
董伟 璇 赵琦南 段小艺2 武 志芳 李思进 王红亮
1 山西医科大学第一医院核医学科,太原 030001;2 西安交通大学第一附属医院PET/CT 室,西安 710061
18F-FDG 可被大多数肿瘤细胞摄取而成为临床最常用的PET 正电子葡萄糖代谢显像剂。但任何显像剂均有其不足之处,如对于不以葡萄糖为主要能源物质的肿瘤细胞,患者静脉注射18F-FDG 后并不能引起肿瘤部位的高摄取,临床易漏诊[1],因此开发不同类型的新型显像剂以补充18F-FDG 的不足成为时下人们研究的热点。有研究结果表明,恶性肿瘤细胞除可利用糖酵解供能,还可通过脂肪酸代谢为其细胞增殖提供所需的条件[2-3],于是放射性核素标记的短链脂肪酸代谢型显像剂被不断开发。如早期用于评价心肌代谢显像的11C-乙酸盐对肝癌、前列腺癌、肾癌等肿瘤同样具有较好的诊断效果,但由于11C 的半衰期(20.4 m in)短,并不利于临床大规模应用[4]。因此2-18F-氟乙酸、2-18F-氟丙酸、18F-特戊酸以及4-18F-氟丁酸(4-18F-fluorobutyric acid,4-18F-FBA)等显像剂相继被开发[5]。除4-18FFBA 存在明显脱氟现象外[6],其余显像剂均具有一定的应用前景,特别是2020 年Dubash 等[7]将18F-特戊酸应用于健康人体,结果显示该显像剂在脑组织中的摄取较18F-FDG 更低,这提示其可能有利于对该部位病变的检出。本研究基于对4-18F-FBA脱氟原因的分析,设计合成2-18F-氟丁酸(2-18Ffluorobutyric acid,2-18F-FBA),通过增加空间位阻减少脱氟现象的发生,初步探讨2-18F-FBA 作为肿瘤PET/CT 显像剂的可行性。
1 材料与方法
1.1 仪器与材料
HM-10 型回旋加速器购自日本住友公司;m icro-PET/CT 扫描仪购自法国Inviscan 公司;高效液相色谱仪(high performance liquid chromatography,HPLC)配备高能放射性检测器、201 型紫外检测仪和薄层色谱扫描仪均购自美国Lab A lliance 公司;SN-697 型全自动放射免疫γ计数器购自上海日环光电仪器有限公司;CRC-15R 型放射性活度计购自德国西门子公司;C18 色谱分析柱(5 μm, 250 mm ×4.6 mm)购自英国Hichrom 公司;C18 色谱半制备柱(5 μm, 250 mm× 10 mm)购自日本YMC 公司;QMA(Sep-pak Light)柱和C18(Sep-pak Light)柱均购自美国Waters 公司。
1.2 试剂
K222(纯度98%)购自德国ABX 公司;无水K2CO3(纯度99.9%)、无水乙腈(纯度99.9%)均购自美国Sigma 公司;2-溴丁酸甲酯(纯度>97%)购自上海阿拉丁公司;2-19F-FBA(纯度>97%)购自杭州凡达化工;氢氧化钠(纯度>96%)购自成都科龙化工有限公司;去离子纯化水购自广东艾希德药业有限公司。
1.3 实验动物及细胞
美国癌症研究所(institute of cancer research,ICR)健康小鼠,雌性,体重20~25 g,由山西医科大学实验动物中心提供[无特定病原体级,实验动物许可证编号为SCXK(晋)2015-0001]。饲养环境为无特定病原体级动物房屏障环境,小鼠自由饮用无菌水和进食无特定病原体级鼠繁殖饲料,饲养温度18℃~25℃,相对湿度40%~70%。S180 肉瘤细胞购自中科院上海细胞库。
1.4 实验方法
1.4.1 2-18F-FBA 的合成
2-18F-FBA 的 合 成 路 线 如 图1 所 示。18F−经QMA 柱捕获后使用1.5 m L 的K222/K2CO3(K222:13 mg/m L、K2CO3:3 mg/m L)溶液(乙腈 : 水=10 :1,体积比)洗脱至反应瓶中,加热至110℃共沸蒸干除去溶剂,加入1 m L CH3CN 再次共沸干燥,待反应体系彻底干燥冷却后加入前体化合物2-溴丁酸甲酯的乙腈溶液(1 m L,8 mg/m L),密闭加热至120℃反应15 m in。反应结束后,使用HPLC法(C18 色谱半制备柱,流速3 m L/m in,流动相中乙腈的梯度条件:0~2 m im 10%、2~15 m in 80%、15~25 min 80%、25~35 m in 10%)进行分离纯化,收集16~18 m in 时中间体2-18F-氟丁酸甲酯,因含乙腈,需用固相萃取的方法去除有机溶剂。具体过程:用20 m L 纯水稀释后将溶液过C18 柱并用10 m L 纯 水 冲 洗,吹 干 后 使 用1 m L 2 mol/L 的NaOH 溶液水解5 m in,最后使用1.5 m L 纯水洗脱C18 柱,洗脱液经酸性阳离子交换柱和滤膜后保留待用。

图1 2-18F-氟丁酸的合成路线Figure 1 Synthesis of 2-18F-fluorobutyric acid
1.4.2 产品的质量控制
(1)目测产品的颜色和澄清度,使用精密试纸测定2-18F-FBA 的pH 值。
(2)检测产品的放射化学纯度。使用带有放射性检测器的分析型HPLC 仪分别测定2-18F-FBA 和2-19F-氟丁酸的保留时间,以及2-18F-FBA 的放射化学纯度,色谱条件:使用C18 色谱分析柱,流动相为乙腈(A)和水(B)的混合液,流速为1 m L/min,紫外检测波长为254 nm,流动相中乙腈(A)梯度条件与上述制备2-18F-FBA 条件一致。
(3)产品的稳定性检测。体外稳定性检测:室温下按照上述HPLC 分析条件测定2-18F-FBA 在生理盐水中60 m in 时的放射化学纯度。体内稳定性检测:2-18F-FBA(0.2 m L,7 MBq)经ICR 健康小鼠尾静脉注入体内,15 m in后收集尿液按照上述HPLC 分析条件测定放射化学纯度。
1.4.3 健康小鼠体内的生物学分布
ICR 健康小鼠18 只,随机分为6 组,每组3 只。小鼠尾静脉注射2-18F-FBA(0.2 m L,7 MBq),注射后分别于5、15、30、60、90、120 min 时于眼静脉取血后断颈处死,解剖取心脏、肺、肾脏、肝脏、脾脏、胃、大肠、脑、肌肉及骨等组织脏器及血液,分别称重并用γ 计数器测量各组织脏器的放射性计数,经衰变校正后计算每克组织百分注射剂量率(percentage activity of injection dose pergram of tissue,%ID/g)。%ID/g=每克组织的放射性计数/注入的总放射性计数×100%
1.4.4 肿瘤模型的构建
S180 肉瘤细胞用灭菌生理盐水配制成1×107个/m L的细胞浓度,接种于ICR 健康小鼠腹腔,每只小鼠腹腔注射0.2 m L,1 周后待腹腔充盈抽取1.2 m L腹水待用。随机选取ICR 健康小鼠6 只,在其前腋皮下注入含S180 肉瘤细胞的腹水0.2 m L,定期观察肿瘤的生长情况,待其生长至1 cm×1 cm×1 cm时,选取肿瘤处无溃烂的动物模型进行m icro-PET/CT 显像。
1.4.5 m icro-PET/CT 显像
随机选取S180 肉瘤荷瘤小鼠3 只,气体诱导麻醉后放置在37℃恒温的m icro-PET/CT 扫描床上,同时给予2%的异氟烷(加2 L/min 空气)维持麻醉,经小鼠尾静脉注射2-18F-FBA(0.2 m L,7 MBq),分别于30、60、90、120 m in 后行PET/CT静态采集。先行PET 采集,后行CT 扫描,PET图像选择单床位、600 s 旋转扫描方式进行采集,预处理执行衰减校正及随机事件校正,图像重建采用蒙特卡罗系统模型的3D OSEM(ordered subsets expectation maxim ization)算法。CT 图像扫描:管电压80 kV、管电流1 mA、曝光时间40 s,预处理选择160 μm 层厚,重建采用Feldkamp 滤波反投影算法,并执行射束硬化校正及环形伪影校正。采用仪器自带PMOD 软件进行图像分析,勾画小鼠肿瘤、肝脏、脑、肌肉等的容积感兴趣区(VOI),定量计算SUVmax。
1.4.6 统计学处理
应用SPSS 22.0 软件进行统计学分析。符合正态分布的计量资料以x¯±s表示,注射2-18F-FBA 后各个时间点生物学分布的数据比较采用Studentt检验(方差齐)。P<0.05 为差异有统计学意义。
2 结果
2.1 2-18F-FBA 的合成
2-18F-FBA 的合成时间约为40 m in,产品的放射化学产率为(40±5)%(经时间校正),比活度为50 GBq/μmoL。
2.2 产品的质量控制
2.2.1 澄清度和pH 值
2-18F-FBA 溶液澄清无颗粒,pH 值为7.2。
2.2.2 放射化学纯度
如图2 所示,2-18F-氟丁酸甲酯的保留时间为16~18 min,2-18F-FBA 的放射化学纯度>98%。2-18F-FBA 的放射峰与2-19F-FBA 的紫外吸收峰均为2 min,说明合成的2-18F-FBA 结构正确,其色谱图分别见图3、4。
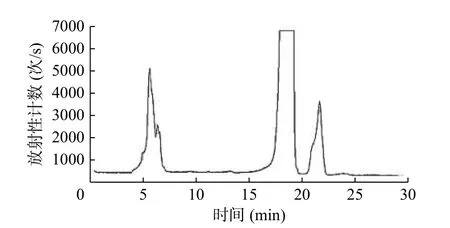
图2 2-18F-氟丁酸甲酯的放射化学纯度高效液相色谱图Figure 2 Radiochem ical purity high performance liquid chromatogram of 2-18F-fluorobutyric acid methyl ester

图3 2-18F-氟丁酸的放射化学纯度高效液相色谱图Figure 3 Radiochem ical purity high performance liquid chromatogram of 2-18F-fluorobutyric acid
2.2.3 稳定性
室温条件下2-18F-FBA 在生理盐水中放置60 min 以及在ICR 健康小鼠尿液中的放射性均未出现脱氟现象。
2.3 2-18F-FBA 在健康小鼠体内的生物学分布
由表1 可知,2-18F-FBA 注入健康小鼠体内5 m in 后在全身各主要脏器广泛分布,在肝脏、心脏以及肺的放射性摄取均较高,其他组织器官放射性摄取相对较低,特别是脑组织放射性摄取率在各个时间点均较低。代谢60 m in 后各脏器的放射性摄取趋于稳定,相对放射性摄取率大多低于2.5%ID/g;骨骼的放射性摄取随时间的延长均较低,但5 m in 与30、90 m in 比较,差异均无统计学意义(t=1.532、1.104,均P>0.05)。
表1 2-18 F-氟丁酸在美国癌症研究所健康小鼠体内的生物学分布( ±s,n=3)Tab le 1 The results of the biological distribution of 2-18F-fluorobutyric acid in institute of cancer reasearch healthy m ice ( ±s, n=3)

表1 2-18 F-氟丁酸在美国癌症研究所健康小鼠体内的生物学分布( ±s,n=3)Tab le 1 The results of the biological distribution of 2-18F-fluorobutyric acid in institute of cancer reasearch healthy m ice ( ±s, n=3)
注:%ID/g为每克组织百分注射剂量率
脏器 放射性摄取率(%ID/g)5 m in 15 m in 30 m in 60 m in 90 m in 120 m in血液 3.89±0.92 4.06±0.48 3.47±1.18 2.42±0.35 1.60±0.06 1.72±0.66心脏 5.02±1.63 3.13±0.56 2.92±0.66 1.83±0.42 1.33±1.52 1.37±0.47肺7.95±1.47 4.53±0.23 2.46±0.19 2.25±0.39 1.33±0.39 0.57±0.06肾脏 4.34±1.83 2.71±0.41 3.14±0.54 1.85±0.64 1.04±0.03 0.98±0.15肝脏 6.10±2.50 3.03±0.21 2.60±0.87 2.16±0.29 1.46±0.45 1.70±0.63脾脏 3.74±1.43 2.80±0.33 1.94±0.29 1.58±0.56 1.07±0.13 1.15±0.44胃2.99±1.00 2.05±0.05 2.19±0.45 1.15±0.14 0.80±0.10 0.84±0.30大肠 3.24±0.51 2.81±0.95 2.52±0.32 1.76±0.29 1.44±0.14 1.93±0.48脑2.79±1.63 2.21±0.20 1.75±0.27 1.55±0.51 1.32±0.10 1.09±0.35肌肉 4.32±1.86 3.30±0.42 2.13±0.44 2.02±0.44 1.32±0.19 1.10±0.20骨骼 3.55±1.00 2.19±0.08 2.58±0.58 2.80±0.77 2.54±1.03 2.05±0.94
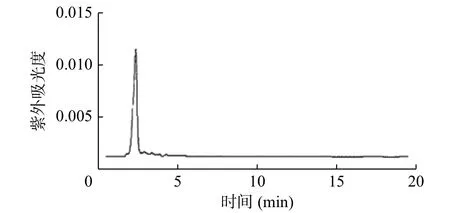
图4 2-19F-氟丁酸的紫外吸收高效液相色谱图Figure 4 Ultraviolet absorption high performance liquid chromatogram of 2-19F-fluorobutyric acid
2.4 m icro-PET/CT 显像
由图5 可见,注射2-18F-FBA 后30 min 小鼠肿瘤处放射性摄取显著,肝脏、肠道等其他组织器官摄取较低;注射显像剂60 m in 后可见肿瘤以及腹腔脏器,如肝脏、肠道处均有一定程度的放射性摄取,脑组织和骨骼在各时间点的放射性摄取均相对较低,与小鼠体内生物学分布结果一致。经测定,肿瘤的放射性摄取率在60 m in 时达到最大值,此时SUVmax为1.90±0.03,此后随时间延长放射性摄取逐渐减低。

图5 注射2-18F-FBA 后的S180 荷瘤小鼠在不同时间点的micro-PET/CT 显像图 FBA 为氟丁酸;PET/CT 为正电子发射断层显像计算机体层摄影术Figure 5 M icro-PET/CT imaging of S180 tumor-bearing m ice at different time points after injection of 2-18 F-FBA
3 讨论
随着临床需求的不断提高,18F-FDG 作为传统PET 正电子示踪剂的不足越来越明显,特别是近年来新开发的正电子放射性核素标记的成纤维细胞激活蛋白抑制剂(FAPI),由于较高的肿瘤/本底比值,可以在一定程度上弥补18F-FDG 的不足。随着分子生物学的不断发展,研究者发现恶性肿瘤细胞中脂肪酸代谢相关酶类物质表达明显增高,如脂肪酸合成酶(FAS)、乙酰辅酶A 合成酶(ACSS)等,这些参与脂肪酸代谢的相关酶类物质在健康组织中表达相对较低[8]。肿瘤细胞不仅利用脂肪酸的β-氧化为其供能,而且可以通过脂肪酸代谢为其恶性细胞增殖创造所需的微环境[9],因此研究者相继研发了一系列正电子放射性核素标记的脂肪酸类分子探针。丁酸为短链脂肪酸的一种,除参与上述作用外,还可作为组蛋白去乙酰化酶(HDAC)抑制剂通过影响组蛋白乙酰化转移酶和组蛋白去乙酰化酶抑制肿瘤的生长,在一定程度上起到抗癌作用[10]。
本研究参照合成2-18F-氟丙酸的方法[11]制备了2-18F-FBA,该工艺为18F 标记氟短链脂肪酸合成的常用方法。并采用HPLC 法对中间体2-18F-氟丁酸甲酯进行分离纯化,不仅可以很好地去除反应中的催化剂K222,而且还能去除未反应的前体2-溴丁酸甲酯,保证了2-18F-FBA 的化学纯度和安全性。与4-18F-FBA 相比,2-18F-FBA 在体内外均显示出较好的稳定性,在羧基的邻位有更大的基团-CH2CH3替换-H 后,更大的空间位阻影响代谢酶对底物的作用,使2-18F-FBA 的稳定性进一步得到了保证。以上研究结果表明,2-18F-FBA 制备工艺简单、易操作,产率较高,可使用常规多功能合成模块实现自动化制备。
体内生物学分布结果显示,2-18F-FBA 注入健康小鼠体内5 m in 后主要浓聚于肝脏、心脏和肺,且排泄较快,表明2-18F-FBA 主要经肝脏代谢,这一点与前期基础研究的结果一致[12],由于脑组织的放射性摄取较低,故2-18F-FBA 较18F-FDG 可能更有利于脑胶质瘤等病变的检出。2-18F-FBA 在各个时间点的骨骼摄取率均较低,进一步证实该显像剂在小鼠体内无明显脱氟现象,具有较好的体内稳定性。另外,2-18F-FBA 在肠道处有一定量的放射性摄取,其是否能应用于胃肠功能性疾病的诊断以及肠-脑循环的研究值得进一步探讨。
M icro-PET/CT 图 像 显 示,2-18F-FBA 注 射 后30 min 小鼠全身各组织器官均有不同程度摄取,尤其在肿瘤处放射性摄取显著,而此时肝脏、肠道等其他组织脏器的放射性摄取相对较低,考虑在注射2-18F-FBA 后进行早期显像(<30 m in)时肿瘤处是否同样出现高摄取,使肿瘤/本底比值更高有待进一步验证。骨骼未见明显的放射性摄取,进一步证实了2-18F-FBA 未发生脱氟现象。S180 肉瘤荷瘤小鼠在注射2-18F-FBA 后60 m in 时肿瘤摄取显著,脑组织在各时间点的放射性摄取率相对较低,与生物学分布结果一致,进一步提示该显像剂对于脑肿瘤的诊断可能更具优势。另外,2-18F-FBA 在各时间点的肠道处均有一定量的放射性摄取,这与设计初衷是相符的,表明2-18F-FBA 对于炎症性肠道疾病的诊断可能存在一定价值。有文献报道,丁酸是结肠、盲肠主要的能源物质,具有保护肠道和抗炎症、肿瘤等作用[13]。
综上所述,2-18F-FBA 在S180 肉瘤荷瘤小鼠肿瘤处有较高的放射性摄取,由于肝脏和肠道也有一定量的放射性摄取,对于这些部位肿瘤病变的检出可能存在一定影响。2-18F-FBA 有望成为一种新型的短链脂肪酸代谢型PET/CT显像剂,其细胞摄取机制及代谢特征有待进一步研究。

