蒙古黄芪种子消毒剂的筛选及愈伤组织诱导
张 芳,薄越洋,樊彦彤,何 瑞,张 洁
(山西农业大学信息学院,山西太谷 030800)
蒙古黄芪(Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao)为豆科黄芪属多年生草本,以根入药,其味甘微温,具有补气固表、利尿、抗病毒等功效,对肢体麻木、肾炎浮肿、创伤不易愈合等疗效显著,被称为“补药之长”,是临床常用中药之一[1-3]。在现代医学研究中,特别是在我国2020 年初出现的新冠肺炎治疗过程中,发现黄芪对于缓解新冠肺炎病情和抑制病毒的扩散具有显著的效果[4]。随着黄芪研究和应用的不断扩展,野生资源多濒临灭绝,人工种植也由于黄芪种子萌发率低等原因而影响其大量栽培,无法满足市场需求[5]。利用植物组织培养快速繁殖黄芪不仅可在短期内培养大量优质苗,还可为开展黄芪毛状根转基因研究提供基础材料。
组培快繁是保护植物种质资源和扩繁种苗的有效途径,近年来对黄芪组培快繁开展了许多研究工作。洪森荣等[6]研究表明,KT 和2,4-D 均可促进膜荚黄芪试管苗带芽茎段根和芽的再生。张延红等[7-8]以蒙古黄芪茎段为外植体,筛选了初代培养和继代培养的适宜培养基,并研究了温度和pH 对黄芪组织培养的影响。郭生虎等[9]以膜荚黄芪无菌苗为外植体,研究了不同激素种类及其浓度配比对愈伤组织诱导率、丛生芽诱导率、再生苗生根率的影响,并筛选出适宜的培养基配方。这些研究多以带芽茎段、无菌苗下胚轴为外植体开展相关试验,对不同外植体进行比较筛选的研究不多。另外,由种子萌发的无菌苗是诱导愈伤组织的良好外植体,但黄芪种子本身萌发率偏低[10],消毒处理不当则会影响无菌苗的获得。因此,筛选适宜的消毒剂是初代培养成功的关键因素之一,周吉林[11]研究表明,采用98%的浓硫酸灭菌黄芪种子3 min 效果较好。升汞和次氯酸钠也具有良好的消毒灭菌作用[12],但目前尚未见对黄芪种子灭菌效果的相关研究。
本试验以蒙古黄芪种子为试验材料,以0.1%HgCl2和2%NaClO 对其进行灭菌处理,获得无菌苗,分别以黄芪无菌苗下胚轴和叶片为外植体诱导愈伤组织产生,以筛选最适诱导培养基,并通过绘制愈伤组织生长曲线,确定其继代培养周期,旨在为黄芪组织快繁及开展转基因相关研究提供技术支撑。
1 材料和方法
1.1 试验材料
供试材料为蒙古黄芪种子,购自山西省种子公司。
1.2 试验方法
1.2.1 黄芪种子的灭菌和萌发 选取优质饱满的黄芪种子,剥去种皮,用75%酒精浸泡30 s,无菌水冲洗3 次;再分别用0.1%HgCl2和2%NaClO 灭菌不同时间(表1),无菌水冲洗4 次后,接种到MS 培养基上(琼脂6 g/L、蔗糖25 g/L、pH 值5.8),置于(25±1)℃培养箱进行暗培养;每个处理接种6 瓶,每瓶8 粒,每隔1 d 观察记录黄芪种子的发芽率(当胚根长比种子高1/2 时,即为黄芪种子发芽)。

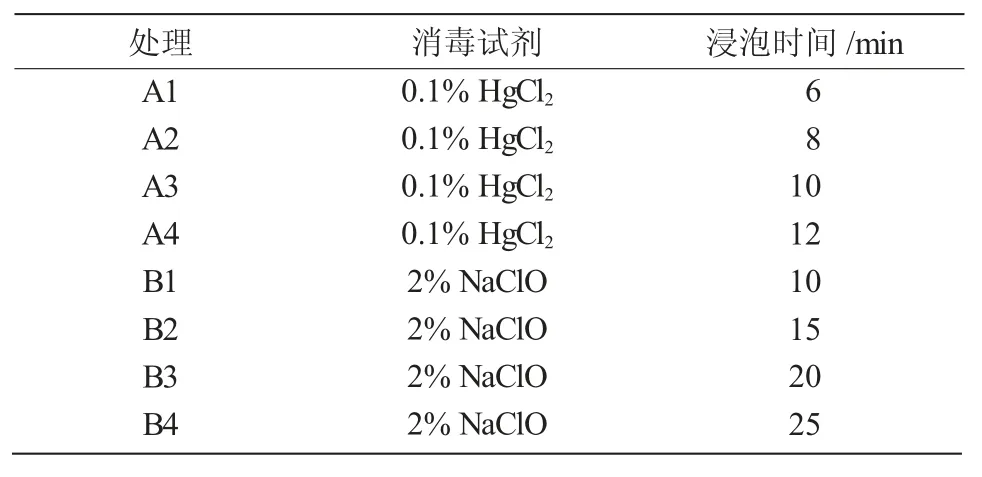
表1 2 种消毒剂不同处理时间
1.2.2 以下胚轴为外植体的愈伤组织诱导 种子萌发后,置于温度为(25±1)℃、光周期为16 h/8 h(光/暗)、光强为2 000 lx 的温室内培养,得到无菌苗。以黄芪无菌苗的下胚轴为外植体,接种到附加不同质量浓度NAA、2,4-D 和6-BA 的MS 培养基中(表2),置于温度为(25±1)℃进行暗培养诱导愈伤组织;每个处理接种8 瓶,每瓶接种5 个。25 d 后统计愈伤组织的诱导个数,计算诱导率,并观察其生长情况。1.2.3 以叶片为外植体的愈伤组织诱导 取黄芪无菌苗叶片切成大小约为2 mm×2 mm 的小块,接种于添加不同质量浓度的NAA、2,4-D 和6-BA 的MS 培养基中(表3)。培养条件同1.2.2。每个处理接种8 瓶,每瓶接种5 个。接种25 d 后统计愈伤组织的诱导个数,计算诱导率,并观察其生长情况。


表2 诱导黄芪下胚轴愈伤组织的不同激素配比

表3 诱导黄芪叶片愈伤组织的不同激素配比
1.2.4 愈伤组织继代周期的确定 将下胚轴和叶片诱导获得的愈伤组织分别转接入1.2.2 和1.2.3试验筛选出的最适培养基中进行增质量研究。每5 d测定一次愈伤组织鲜质量,培养30 d,并绘制其生长曲线。
2 结果与分析
2.1 不同消毒剂及处理时间对黄芪种子萌发的影响
黄芪种子接种第8 天开始出芽,第25 天黄芪种子萌发情况统计结果如表4 所示。

表4 2 种消毒剂不同灭菌时间对黄芪种子萌发的影响
从表4 可以看出,0.1%HgCl2处理中,A3 处理(10 min)的种子萌发率和芽体平均高度最高,分别为73%和13.7 cm;A1、A2 处理种子灭菌不完全,仍有污染现象;A4 处理可能对种子的毒害作用较大,抑制种子的萌发和生长。2%NaClO 处理中,B3 处理(20 min)的种子萌发率最高,为68%;B2 处理的种子萌发后芽体平均高度最高,为12.6 cm。综上可见,0.1%HgCl2灭菌处理10 min 为蒙古黄芪种子的最适灭菌方法。
2.2 激素对黄芪无菌苗下胚轴诱导愈伤组织的影响
由表5 可知,培养基中单独附加2,4-D(C1~C4)时,C2(MS+1.0 mg/L 2,4-D)的愈伤组织诱导率最高,为83%,且愈伤组织生长健壮,质地疏松适度,褐化较轻;2,4-D 质量浓度过高或过低时,愈伤组织诱导率明显下降,且生长缓慢,组织易产生硬块褐化。单独附加不同质量浓度6-BA(C5~C8)时,愈伤组织诱导率最高也仅为43%,且生长情况较差,色白无光泽,褐化程度严重,延长培养时间则逐渐死亡。单独添加不同质量浓度NAA(C9~C12)时,愈伤组织诱导率随NAA 质量浓度增加而逐渐提高,当质量浓度达到3.0 mg/L 时,愈伤组织诱导率最高,为63%,愈伤组织呈淡黄色,逐渐发生褐化。故附加单一激素时,C2 为最适培养基。
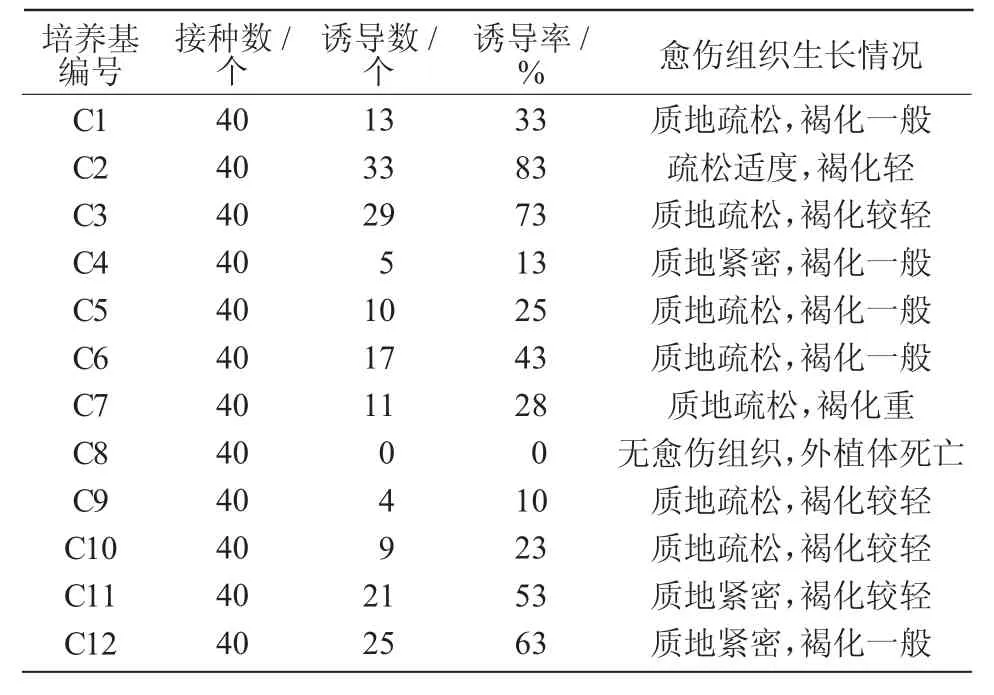
表5 单激素对黄芪下胚轴愈伤组织诱导的影响
由表6 可知,2,4-D 与6-BA 配比(C13~C17)时,C17 的愈伤组织诱导率最高,可达100%,但愈伤组织褐化程度较高;C16(MS+2.0 mg/L 2,4-D+0.5 mg/L 6-BA)愈伤组织诱导率较高,为88%,且其褐化程度较低。NAA 和6-BA 配比(C18~C22)时,愈伤组织诱导速度较慢,但诱导出的愈伤组织不易发生褐化,随着NAA 质量浓度的增加,诱导出的愈伤组织由黄褐色变成黄乳白色,其质地也由硬实变为疏松,其中,C21(MS+2.0 mg/L NAA+1.0 mg/L 6-BA)的诱导率最高,为80%。综上,C16 为下胚轴诱导愈伤组织的适宜培养基,且诱导率比单独附加2,4-D 时高。
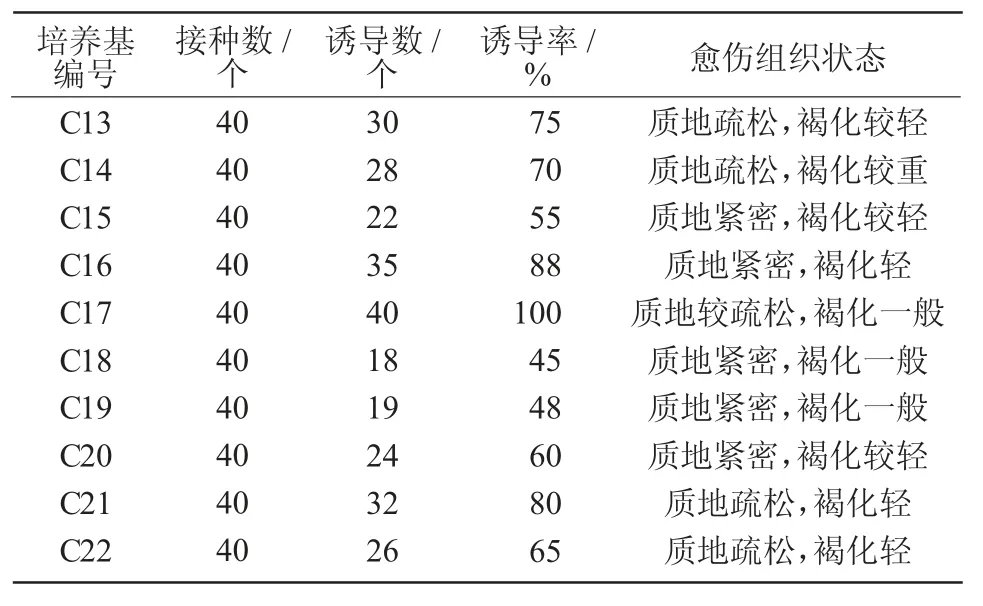
表6 不同激素配比对黄芪下胚轴愈伤组织诱导的影响
2.3 不同激素配比对黄芪无菌苗叶片愈伤组织诱导的影响
从表7 可以看出,2,4-D 单独作用(E1~E3)时,以E3 诱导率最高,为65%,但愈伤组织褐化较为严重,不利于芽的分化。双激素共同作用(E4~E9)时,以E9(MS+2.0 mg/L 6-BA+2.0 mg/L NAA)愈伤组织诱导率最高,为85%,且诱导出的愈伤组织质地紧密、坚硬,呈现浅绿色或绿色。此外,当培养基中6-BA 与2,4-D 和NAA 配比相同时(E4 与E7、E6 与E8),含有NAA 的愈伤诱导率高于含有2,4-D 的培养基,即E7 和E8 的诱导率高于E4 和E6,且愈伤组织质地较紧实。三激素共同作用(E10~E12)时,以E12(MS+2.0 mg/L 6-BA+1.0 mg/L NAA+1.0 mg/L 2,4-D)愈伤组织诱导率最高,为93%,且生长良好,较E9 的褐化程度低,故E12 为叶片诱导愈伤组织的最适培养基。

表7 不同激素配比对黄芪叶片愈伤组织诱导的影响
2.4 愈伤组织继代周期的确定
将下胚轴和叶片诱导的愈伤组织分别转接入筛选出的适宜培养基C16 和E12 中,每5 d 测定愈伤组织的鲜质量一次,并绘制生长曲线如图1 所示。由图1 可知,下胚轴和叶片诱导的愈伤组织生长曲线均呈S 形,二者变化趋势基本相同,均未出现明显的直线生长期。在接种后5 d 进入对数生长期,且下胚轴诱导的愈伤组织增长快于叶片诱导愈伤组织;下胚轴诱导愈伤组织生长15 d 后进入缓慢生长期,而叶片诱导的愈伤组织在生长20 d 左右才进入缓慢生长期;2 种愈伤组织均在25 d 后进入生长停滞期。因此,愈伤组织培养以20~25 d 为一个继代周期,可以保持其旺盛生长。此外,下胚轴诱导的愈伤鲜质量均高于叶片诱导的愈伤鲜质量。

3 结论与讨论
外植体灭菌是初代培养能否成功的关键因素之一。李娜等[10]、周吉林[11]分别用浓硫酸、H2O2、砂撞和灭菌的自来水对黄芪种子进行灭菌,结果发现,浓硫酸、H2O2腐蚀性强,处理后种子的死亡率较高,且浓硫酸操作危险;砂撞处理安全但发芽率低。本试验分别用0.1% HgCl2和2% NaClO 灭菌不同时间以筛选适合黄芪种子灭菌的消毒剂,结果表明,0.1%HgCl2比2%NaClO 灭菌后种子萌发率高,灭菌效果好,以0.1%HgCl2灭菌10 min 为蒙古黄芪种子的适宜灭菌方法。
关于黄芪组培快繁已有不少报道,其研究一方面集中在以腋芽、茎尖或茎段为外植体直接诱导芽萌动丛芽[13-14],另一方面则通过外植体诱导愈伤组织并分化形成再生植株[15-19]。而影响愈伤组织形成的两大关键因素为外植体的选择和培养基中的激素配比[20]。张强等[21]以膜荚黄芪的子叶、下胚轴、幼茎、幼叶为外植体诱导愈伤组织,结果发现,子叶是最佳的外植体,MS+0.5 mg/L 6-BA+0.5 mg/L NAA为其愈伤组织诱导的最佳培养基。本试验分别以蒙古黄芪的下胚轴和叶片为外植体诱导愈伤组织,结果发现,下胚轴诱导愈伤组织的适宜培养基为MS+2.0 mg/L 2,4-D+0.5 mg/L 6-BA,这与郭生虎等[9]的研究结果一致。叶片诱导愈伤组织的适宜培养基为MS+2.0 mg/L 6-BA+1.0 mg/L 2,4-D+1.0 mg/L NAA。通过下胚轴愈伤组织和叶片愈伤组织分别在其最适培养基上的生长鲜质量曲线可知,黄芪下胚轴愈伤组织生长略强于叶片愈伤组织生长,二者均在生长第5 天进入对数生长期,第25 天进入生长停滞期。故蒙古黄芪愈伤组织继代培养以20~25 d为一个周期较为适宜,可保持其旺盛生长。
本研究通过对蒙古黄芪种子萌发前进行不同的消毒处理,确定0.1%HgCl2灭菌10 min 的发芽率最高,获得无菌苗后,以下胚轴和叶片为外植体的愈伤组织诱导发现,MS+2.0 mg/L 2,4-D+0.5 mg/L 6-BA 为以下胚轴为外植体愈伤组织诱导的适宜培养基,MS+2.0 mg/L6-BA+1.0 mg/L2,4-D+1.0 mg/L NAA 为以叶片为外植体愈伤组织诱导的适宜培养基,诱导率分别为88%和93%。由愈伤组织生长曲线可知,20~25 d 为一个继代周期。该结果为蒙古黄芪的组培快繁提供了理论基础。

