酰基辅酶A硫酯酶11基因(ACOT11)及其家族的研究进展
张丽 强俊 徐跑 陶易凡
摘要:酰基辅酶A硫酯酶(ACOTs)是一类催化脂肪酰基辅酶A水解形成游離脂肪酸(FFA)和辅酶A(CoA)的酶。这类酶通过维持细胞内的FFA、脂肪酰基辅酶A以及CoA的适当水平在脂质代谢中发挥了非常重要的作用。ACOT11作为ACOTs家族成员之一,对温度和摄食量的变化较为敏感,所以该基因对生物体的能量保存、炎症的调节和内质网应激等方面具有一定的作用。本文对ACOT11及其家族基因的分布、结构及功能特征进行了梳理,综述了该基因及其家族在人、小鼠、大鼠以及其他哺乳动物中的分布及发挥的作用。
关键词:酰基辅酶A硫酯酶家族;ACOT11基因;脂代谢;研究进展
中图分类号:S188+.3 文献标志码: A文章编号:1002-1302(2021)02-0012-06
收稿日期:2020-05-26
基金项目:江苏省自然科学基金面上项目(编号:BK20181137)。
作者简介:张丽(1995—),女,山东潍坊人,硕士研究生,研究方向为水产动物遗传与育种。E-mail:18795976264@163.com。
通信作者:徐跑,研究员,研究方向为水产动物遗传育种与健康养殖。E-mail:xup@ffrc.cn。
自1950年以来,Hunt等首次鉴定了酰基辅酶A硫酯酶(acyl-CoA thioesterases,ACOTs)[1-2],现该酶在古生菌到真核生物等各种生物中已有广泛报道。2005年,经过修订的命名法将这些酰基辅酶A硫酯酶进行划分,将人类中的该类酶指定为由大写字母表示的ACOTs,而小鼠和大鼠中则用小写字母表示为Acots[3],迄今为止已鉴定出12种人类ACOTs(ACOT1,2,4,7~9,11~15)[4-5]、15种小鼠Acots(Acot1~15)[6]。根据序列和结构上的差异,这些基因可分为2类:Ⅰ型酰基辅酶A硫酯酶(ACOT1、2、4;Acot1~6)和Ⅱ型酰基辅酶A硫酯酶(ACOT7~9、11~15;Acot7~15)[7]。Ⅰ型酰基辅酶A硫酯酶的分子量约为40 ku,是α/ β水解酶蛋白家族的成员,其中还包括其他表现酯酶活性的酶如羧基酯酶和脂肪酶;Ⅱ型酰基辅酶A硫酯酶是“热狗”域家族的成员,其中包括各种功能多样的蛋白质[6]。小鼠基因组中包含的6个Ⅰ型Acots位于小鼠12 D3染色体簇内[3,8];而在人类中的4个Ⅰ型ACOTs则位于染色体14q24.3上的一个基因簇内[3,8]。尽管催化相同的反应,但2种酶在结构上并不相似,且不具有序列同源性,说明这2种类型的酶是趋同进化而来的,所以被称为类似物而非同源物[9]。在Ⅰ型ACOTs中,各个酶之间以及在物种之间表现出高度的序列同源性,表明该类型酶成员是通过共同祖先的基因进化而来的[9]。与Ⅰ型酶不同,Ⅱ型ACOTs具有较低的序列相似度,但具有共同的结构特征。另外,ACOTs也归类于ThYme(硫酯活性酶)数据库的硫酯酶水解酶家族中,该数据库亦涵盖了许多物种[10-11]。
作为Ⅱ型酶成员之一的ACOT11,是一种长链酰基辅酶A硫酯酶,在棕色脂肪组织(brown adipose tissue,BAT)中高度表达,且受环境温度和食物消耗量的影响[12-13]。Acot11在小鼠的体内主要分布于细胞质、内质网和细胞核,而其他哺乳动物中的分布位置还须要进一步的探索[14-15]。目前ACOT11及其家族基因的功能在生化和生物学上已有初步研究,但是它们的生理功能仍须深入探索。
1ACOTs家族研究进展
ACOTs也被称为酰基辅酶A硫水解酶、酰基辅酶A硫酯水解酶、脱酰基酶[4]。脂肪酸在线粒体和过氧化物酶体中降解并为细胞的生理活动供能,这个过程称为β氧化。ACOTs可以清除由β氧化而产生的对生物体不利的短链产物,是β氧化系统的关键酶之一。
游离脂肪酸(free fatty acid,FFA)被细胞吸收后酯化为辅酶A(coenzyme A,CoA),由ACOTs家族基因通过酯化作用激活CoA,形成脂肪酸酰基辅酶A分子,这些分子可被氧化以产生能量或合并成各种复杂的脂质。ACOTs构成的一系列酶可以水解脂肪酰基辅酶A形成FFA和CoA,并且可以通过维持脂肪酰基辅酶A、FFA和CoA在适当的水平使生物体保持正常的生理活动,而脂肪酰基辅酶A作为脂肪酸合成与分解的重要中间物质在代谢能量方面发挥了巨大作用[16-17]。ACOTs的底物包括多种从短链饱和到长链饱和不等的脂肪酰基酯分子,以及多不饱和脂肪酰基辅酶A、支链脂肪酰基辅酶A和甲基支链脂肪酰基辅酶A[7,18]等。
除此以外,Adams等还通过试验发现,ACOTs可能也作为一些转录因子的配体,参与了信号传导、胞内运输、囊泡出芽和内吞作用等有关的细胞系统与功能[19],这类酶在生物体内发挥的重要性不言而喻。
Hunt等在早期已描述了有关ACOTs的活性特点[2],这类酶的活性主要来自于一类更广泛的硫酯水解酶。硫酯水解酶可以裂解硫原子和羰基之间的硫酯键,而大多数酰基辅酶A硫酯酶则专门作用于含有CoA的分子底物上[10]。Tillander等用过氧化物酶体增殖物诱导大鼠肝脏中的酰基辅酶A硫酯酶活性,通过观察最后发现和鉴定了2种类型的酰基辅酶A硫酯酶[20]。
ACOTs最开始被发现于原核动物和真核动物中,目前已从细菌、酵母、植物和动物等多种生物中分离得到。在较高等的生物中,该基因多分布于细胞质、线粒体、过氧化物酶体和内质网中。而在哺乳动物组织中,该基因则广泛分布于脑、肝、肾、心、肺、类固醇和BAT[21-22]中。含有哺乳动物ACOTs的细胞分布较为广泛且数量较大,但是其单个酶很难从组织匀浆中纯化出来,从而阻碍了早期的鉴定工作。此外,在文献中经常报道纯化后酶活性的丧失,直到后来编码这几个酶的cDNA被分离出来,单个的ACOTs酶才能够被鉴定出来。目前,已有资料描述了几个ACOTs家族成员的详细特征,但这些酶作为健康和疾病中的关键代谢产物才刚开始被人们重视起来,其在预防和治疗疾病方面具体发挥的作用和功能还须要进一步去探索。
1.1Ⅰ型酰基辅酶A硫酯酶——ACOT1~ACOT6
ACOT1是一种胞质酶,对长链(C12~C20)饱和和单不饱和酰基辅酶A具有底物选择性[23]。在大鼠中该基因主要分布在肝脏[24],其次在大鼠大脑、心脏、肾脏和睾丸[25]中也有被检测到。Bikesh等发现,该酶的表达可能是由禁食和糖尿病引起的[24]。有资料显示,在具有心脏功能障碍的小鼠中,Acot1的表达可以减少活性氧自由基并改善心脏功能[26-27]。
ACOT2对长链脂肪酰基辅酶A也具有选择性[28],该基因被发现存在于大鼠的肾脏、心脏、肝脏、大脑、BAT、骨骼肌和类固醇生成组织中[2]。Stavinoha等试验证实,Acot2与解耦蛋白3 (uncoupling protein 3,UCP3)具有协同作用,能够增加大鼠心肌和骨骼肌[29]中的脂肪酸氧化,并发现其在哺乳动物固醇生成中起着重要作用[29]。
ACOT3对长链和中链酰基辅酶A表现出底物特异性,是一种仅在小鼠体内被发现的过氧化物酶,该酶在肾脏中高度表达,且在使用过氧化物酶体激活剂和禁食后上调,并催化对棕榈酰辅酶A具有最高活性的长链酰基辅酶A的水解[30]。
ACOT4主要在肾脏中表达,在肝脏和肠道中表达较少。在小鼠体内,Acot4对琥珀酰辅酶A表现出很高的特异性,对戊二酰辅酶A次之,对其他短链、中链、长链饱和及不饱和酰基辅酶A较差[8,31]。Hunt等认为这种特异性的差异是由于Acot4集合了小鼠Acot3、4和5功能的结果[8]。
ACOT5与ACOT4有相同的功能。该酶与小鼠Acot3具有82%的氨基酸序列同源性,在脾脏、脑、睾丸和肠道中表达量最高,但在人类中不存在。
ACOT6尽管已经在小鼠体内被成功克隆并进行了特性鉴定,但迄今为止,在人类中的克隆仍未成功。Hunt等没有在人体组织中检测到相应的mRNA,只能克隆该蛋白的一个较短版本[8]。
1.2Ⅱ型酰基辅酶A硫酯酶——ACOT7~ACOT15
ACOT7是目前研究最广泛的酰基辅酶A硫酯酶,这种酶的主要亚型(ACOT7a)在小鼠的大脑和睾丸中高度表达,其他亚型(ACOT7b~7e)则在小鼠的心脏、肺、脾脏、肾脏和肝脏[32]中表达。ACOT7最初被称为脑酰基辅酶A水解酶,因为它在哺乳动物中枢神经系统中具有较高的表达量和活性[32-33]。有资料表明,在癫痫患者的海马体中几乎不存在ACOT7,说明ACOT7在神经功能中具有一定的作用[34]。
ACOT8是一种过氧化物酶体蛋白,具有广泛的底物特异性,包括中链、长链和甲基支链的酰基辅酶A、β-氧化和胆汁酸辅酶A的中间体[35]。它的活性能够被CoA抑制,其表达通过禁食和过氧化物酶体增殖物激活受体α(peroxisome proliferator-act-ivated receptors α,PPARα)的激活而上调[6,36]。
ACOT9位于线粒体且其表达较为广泛,在小鼠肾脏、脂肪组织和脑中表达较高,而在肝脏中表达较低[30,37]。该基因对长链饱和的酰基辅酶A以及支链短链饱和酰基辅酶A特异性最强,其中许多酰基辅酶A是氨基酸降解途径中的中间产物[30]。这些发现表明,ACOT9在线粒体脂肪酸和氨基酸代谢之间起到了调节联系的作用[37]。该基因的同源基因已在几种物种(包括青蛙、牛、野鸡和水螅)中被发现,而ACOT10只在小鼠中被发现[20]。
关于ACOT11,Adams等在试验中发现,小鼠BAT中该基因的表达在较低温度下会被诱导表达,在高温下则被抑制[19]。在小鼠中观察到的ACOT11的表达可能会导致FFA增加,从而表现出对UCP1的抑制作用。试验中还发现,与易肥胖的小鼠相比,不易肥胖的小鼠Acot11的转录量增加了2倍,所以研究人员推测这种现象可能与脂代谢有关[6]。
关于小鼠、大鼠和人的ACOT12的研究较多,目前主要集中在分子克隆、重组表达和功能表征上[30,38]。这3个物种的胞质同系物对乙酰辅酶A均表现出较高的特异性,均被腺嘌呤核苷三磷酸(ATP)激活,并被二磷酸腺苷(ADP)抑制[30]。Acot12在大鼠中的表达是由包括饥饿和过氧化物酶体增殖物在内的代谢刺激诱导的,并通过再次投喂和胰岛素的施用而降低[39-40]。该基因主要在肝、肾和小肠中表达[39],说明其可能在糖异生中发挥一定的作用,然而其生物学功能仍然未知。
ACOT13是一个较小的硫酯酶,主要在高度氧化的组织中表达,包括肝脏、心脏、肾脏和BAT[41],其表达受PPARα调控。Wei等发现,该基因敲除可使小鼠免受高脂饮食诱导的肝脂肪变性和葡萄糖稳态破坏带来的损害[42]。而该基因的作用是在营养过剩的情况下,可以为长链脂酰辅酶A合成酶1和甘油-3-磷酸酰基转移酶提供底物來促进脂肪生成[43]。
ACOT14刚开始被认为可以对蛋白激酶(Akt)C末端产生调节作用,所以被指定为C末端调节蛋白[44]。与ACOT13相似,该基因形成包含2个同型二聚体的四聚体[45-46],所以它的作用可能是通过抑制Akt来促进细胞凋亡[47]。但是,目前尚不清楚该基因作为酰基辅酶A硫酯酶的生物学作用。
ACOT15主要位于线粒体基质中,对中链和长链饱和和不饱和酰基辅酶A,尤其是亚油酰基辅酶A表现出底物特异性。Zhuravleva等敲除小鼠的ACOT15后,发现小鼠的脂质代谢失调并且有患脂肪肝的倾向,而且线粒体的β氧化速率也有明显降低[46]。由此可知,该基因在脂质代谢和调节线粒体的功能中具有关键作用。
2ACOT11研究进展
2.1ACOT11结构特征
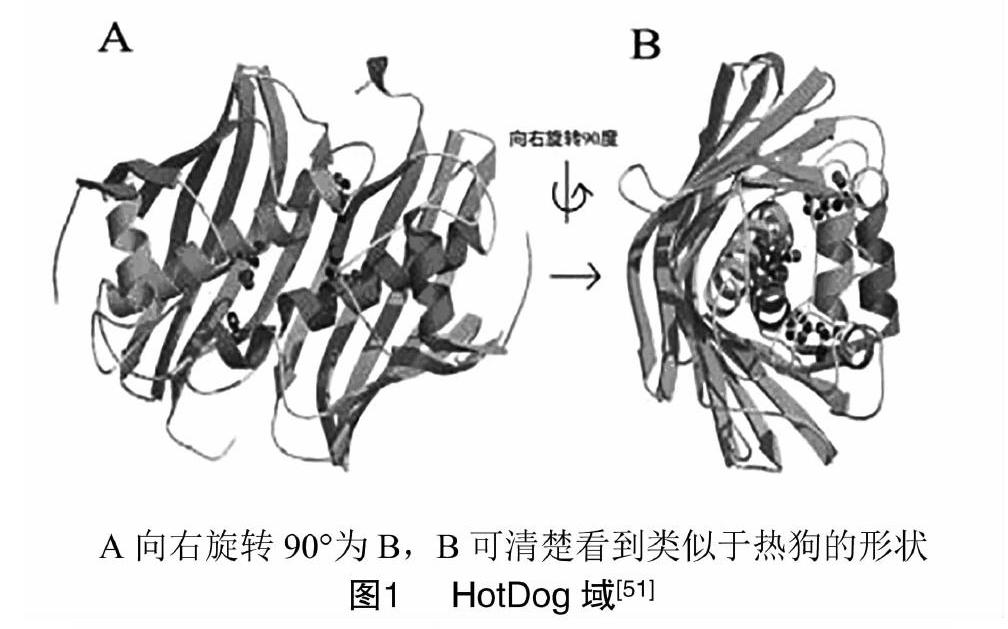
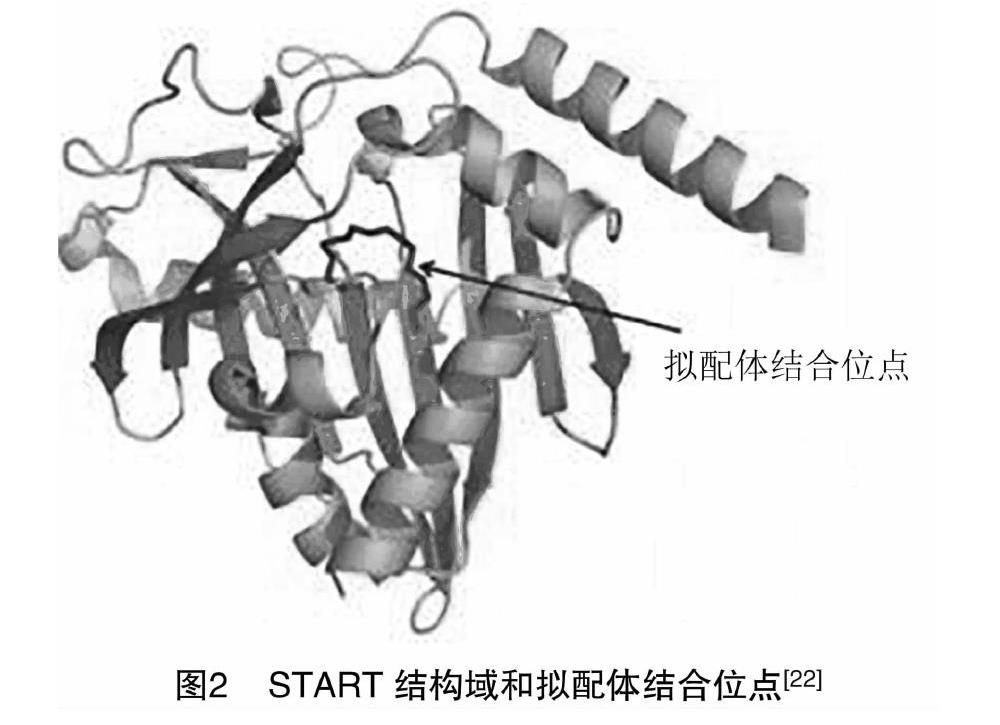
ACOT11包含2个HotDog折叠域以及1个START域[48]。HotDog折叠域(图1),顾名思义是一种类似于热狗结构的折叠域。它包含类似于“小圆面包”的7个β-sheet(紫色和绿色),外包裹5匝类似于“香肠”的α-螺旋(浅蓝色和深蓝色)以及一层包括在螺旋上的环作为“调味品”[49]。HotDog折叠域最初在大肠杆菌β-羟基癸酰硫醇酯脱水酶(FabA)的结构中观察到[50],通常也被称为4HBT (4-hydrox-ybenzoyl-CoA thioesterase)域,这是参考了“HotDog折叠域”一词被创造出来的原型——假单胞菌酶[51]。这种折叠域后来被发现于许多原核生物和真核生物的结构中。START结构域[52]包含1个由9条链(紫色)组成的β-sheet和5个α-螺旋(浅蓝色),长度约为210个氨基酸,可以与各种脂质结合介导细胞内功能,包括细胞内脂质运输、脂质代谢和传递细胞信号[22]。到目前为止,START域的存在仅限于哺乳动物的ACOTs家族中,并且该结构域被认为可以提供更高水平的由脂质介导的硫酯酶活性调节[14,53-54]。人类和小鼠的基因组都是由15个START结构域蛋白组成的[1]。ACOT11起始域的X射线晶体结构已于2009年在PDB(PDB ID号为3FO5)中被发现,但尚未有描述该结构的期刊发表。在此,Kirkby等对其结构进行了初步分析:整个结构包含1个反平行的β-sheet,由9股环绕着5个α-螺旋,由β层和3个α层螺旋组成的隧道包围着单个五甘醇分子[22]。由于这个结构与其他起始域结构相似推断这可能就是脂质结合位点(图2),但ACOT11起始域的特异性配体则尚未确定。
2.2ACOT11功能特征
ACOT11又称为硫酯酶超家族成员(Them1)、棕色脂肪诱导性硫酯酶(BFIT)和类固醇激素急性调节蛋白相关脂质转移(START)域14(StarD14),它是一个受环境温度和食物消耗量控制的长链脂肪酰基辅酶A硫酯酶[55],主要分布于线粒体和内质网,在肝脏中该基因则主要位于细胞质[20]。该基因在BAT中高度表达,但在肝脏和白色脂肪组织等其他组织中表达较低[2]。BAT是一种用于分解过多能量从而减少能量储存的一种脂肪组织,它含线粒体数量较多,其中UCP-1能量代谢[56]和ATP的产生,为非战栗产热提供了基础[35]。Kirkby等研究表明,在小鼠的BAT中,ACOT11在低温下表达上调,在高温下受到抑制,表达则会下调[22]。由此可见,该基因的功能主要是减少能量消耗并保存体内热量[57]。
ACOT11的缺失可以减少生物体内炎症的发生。Zhang等发现,该基因缺失会使小鼠体内的脂肪酰基辅酶A浓度增加,从而导致调节脂肪酸摄取的基因上调,使肝脏中的FFA浓度降低[12];而该基因的表达则会促进脂肪酰基辅酶A分解产生过量的FFA,由于FFA会导致体内产生各种炎症[58],所以降低脂肪酰基辅酶A的浓度对生物体是有利的。
肥胖与炎症有关。ACOT11被敲除后,小鼠可以抵抗饮食诱导的肥胖,其表现为葡萄糖消耗增加,氧气消耗量增加和产热量的增加,并伴随BAT中脂肪酸氧化效率的增加,且可上调促进能量消耗基因的表达,从而使脂质沉积减少[57];同时在ACOT11敲除后,小鼠还可以抵抗高脂饲料引起的白色脂肪组织炎症的发生以及肝脏的脂肪变性[12]。在具有高基础代谢率的动物中,这种在代谢应激后能够减少热量消耗的机制可能会使它们存活率更高;然而,在食物充足或饮食中脂肪含量较高的情况下,热量消耗减少则会导致肥胖。另外,ACOT11的表达使FFA过度产生会引起胰岛素的拮抗作用和内质网应激作用[12]。由于人类ACOT11与肥胖相关[19],所以这些发现可以使ACOT11作为治疗代谢综合征的独特思路。
3结论与展望
ACOTs家族包含多种酶,它们能水解脂肪酰辅酶A形成FFA和CoA。这些酶参与多种细胞过程,但主要被认为在脂质代谢中起重要作用。ACOTs的主要功能大致有以下几点:(1)可以清除由β氧化而产生的对生物体不利的短链产物,促进脂肪酸的降解功能;(2)维持脂肪酰基辅酶A、FFA和CoA在适当的水平以使生物体保持正常的生理活动;(3)作为一些转录因子的配体,参与信号传导、胞内运输、囊泡出芽和内吞作用等有关的细胞系统与功能。尽管催化相同的酶促反应,ACOTs家族成员可以分为两个不同的组:Ⅰ型和Ⅱ型。这2种类型的酶没有共同的结构元素或序列同源性,属于类似酶。而Ⅰ型酶中的各个酶具有高度的序列同源性,可以称之为同源酶;Ⅱ型酶虽序列相似度不高,但具有共同的结构特征。在功能方面,Ⅰ型酶在过氧化物酶体和线粒体中起作用,主要控制脂肪酰基辅酶A氧化的速率。Ⅱ型酶则在脂质酰基辅酶A分子的细胞转运中发挥更直接的作用,即控制它们的氧化方向,而不是复杂的脂质合成。关于ACOT11,其结构主要包含2个形似热狗的HotDog域和1个START域,但是它的拟配体结合位点尚未确定。该基因的作用大致分为以下几点:(1)减少生物体内的能量消耗并保存体内热量;(2)ACOT11的表达使FFA过度产生会引起胰岛素的拮抗作用、炎症和内质网应激作用;(3)在基础代谢率较高的动物中,该基因会使动物保存体内较多热量而存活下去。然而,在基础代谢率一般或者营养充足的情况下,热量消耗得越少,动物自身的脂肪堆积就会越多,与肥胖有关的疾病就会越容易产生,这对动物本身反而大大不利。
尽管在过去的几十年中,ACOTs在生化和生物学方面已得到相对较多的研究,但对其生理功能的探索却是滞后的,许多关键问题仍然存在。另外,近些年来的研究极大地扩展了目前对ACOT11及其家族基因的了解,尤其是在小鼠和人类中该基因的新进展表明其在疾病的发病机理中起着关键作用,但是许多精確的生理功能尚未完全被发掘。因此,ACOT11及其家族基因的生物学作用正待进一步研究,以揭示其在常见疾病(包括肥胖症、糖尿病和非乙醇性脂肪肝疾病)的治疗中的独特功能。
参考文献:
[1]Cohen D E. New players on the metabolic stage:how do you like them acots?[J]. Adipocyte,2013,2(1):3-6.
[2]Hunt M,Alexson-Stefane H. The role Acyl-CoA thioesterases play in mediating intracellular lipid metabolism[J]. Progress in Lipid Research,2002,41(2):99-130.
[3]Hunt M C,Yamada J,Maltais L J,et al. A revised nomenclature for mammalian acyl-CoA thioesterases/hydrolases[J]. Journal of Lipid Research,2005,46(9):2029-2032.
[4]Brocker C,Carpenter C,Nebert D W,et al. Evolutionary divergence and functions of the human acyl-CoA thioesterase gene (ACOT) family[J]. Human genomics,2010,4(6):411-420.
[5]Ishizuka M,Toyama Y,Watanabe H,et al. Overexpression of human acyl-CoA thioesterase upregulates peroxisome biogenesis[J]. Experimental Cell Research,2004,297(1):127-141.
[6]Hunt M C,Karianne S,Kase B F,et al. Characterization of an acyl-CoA thioesterase that functions as a major regulator of peroxisomal lipid metabolism[J]. Journal of Biological Chemistry,2002,277(2):1128-1138.
[7]Hunt M C,Alexson S E H. Novel functions of acyl-CoA thioesterases and acyltransferases as auxiliary enzymes in peroxisomal lipid metabolism[J]. Progress in Lipid Research,2008,47(6):405-421.
[8]Hunt M C,Anna R,Westin M A K,et al. Analysis of the mouse and human acyl-CoA thioesterase (ACOT) gene clusters shows that convergent,functional evolution results in a reduced number of human peroxisomal ACOTs[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,2006,20(11):1855-1864.
[9]Hunt M C,Nousiainen S E B,Huttunen M K,et al. Peroxisome proliferator-induced long chain Acyl-CoA thioesterases comprise a highly conserved novel multi-gene family involved in lipid metabolism[J]. Journal of Biological Chemistry,1999,274(48):34317-34326.
[10]Cantu D C,Chen Y,Reilly P J. Thioesterases:a new perspective based on their primary and tertiary structures[J]. Protein Science,2010,19(7):1281-1295.
[11]Krause K,Weiner J,Hones S,et al. The effects of thyroid hormones on gene expression of Acyl-Coenzyme A thioesterases in adipose tissue and liver of mice[J]. European Thyroid Journal,2015,4(Suppl.1):59-66.
[12]Zhang Y Z,Li Y X,Niepel M W,et al. Targeted deletion of thioesterase superfamily member 1 promotes energy expenditure and protects against obesity and insulin resistance[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(14):5417-5422.
[13]Cannon B,Nedergaard J. Brown adipose tissue:function and physiological significance[J]. Physiological Reviews,2004,84(1):277-359.
[14]Han S X,Cohen D E. Functional characterization of thioesterase superfamily member 1/Acyl-CoA thioesterase 11:implications for metabolic regulation[J]. Journal of Lipid Research,2012,53(12):2620-2631.
[15]Chen D Q,John L,Zhao H,et al. Human brown fat inducible thioesterase variant 2 cellular localization and catalytic function[J]. Biochemistry,2012,51(35):6990-6999.
[16]Cooper D E,Young P A,Klett E L,et al. Physiological consequences of compartmentalized Acyl-CoA metabolism[J]. Journal of Biological Chemistry,2015,290(33):20023-20031.
[17]Anderson C M,Stahl A. SLC27 fatty acid transport proteins[J]. Molecular Aspects of Medicine,2013,34(2-3):516-528.
[18]Yu K,Takagi-Sakuma M,Kitahara M,et al. Characterization of mouse homolog of brain acyl-CoA hydrolase:molecular cloning and neuronal localization[J]. Brain Research Molecular Brain Research,2002,98(1/2):81-92.
[19]Adams S H,Chui C,Schilbach S L,et al. BFIT,a unique acyl-CoA thioesterase induced in thermogenic brown adipose tissue:cloning,organization of the human gene and assessment of a potential link to obesity[J]. Biochemical Journal,2001,360(1):135-142.
[20]Tillander V,Alexson S E,Cohen D E. Deactivating fatty acids:acyl-CoA thioesterase-mediated control of lipid metabolism[J]. Trends in Endocrinology & Metabolism,2017,28(7):473-484.
[21]Yamada J. Long-chain acyl-CoA hydrolase in the brain[J]. Amino Acids,2005,28(3):273-278.
[22]Kirkby B,Roman N,Kobe B,et al. Functional and structural properties of mammalian acyl-coenzyme A thioesterases[J]. Progress in Lipid Research,2010,49(4):366-377.
[23]Yamada J,Kurata A,Hirata M,et al. Purification,molecular cloning,and genomic organization of human brain long-chain acyl-CoA hydrolase[J]. Journal of Biochemistry,1999,126(6):1013-1019.
[24]Bikesh D,Yatrik S,Insook K,et al. The acyl-CoA thioesterase Ⅰ is regulated by PPARalpha and HNF4alpha via a distal response element in the promoter[J]. Journal of Lipid Research,2007,48(8):1781-1791.
[25]Kuramochi Y,Nishimura S I,Takagi-Sakuma M,et al. Immunohistochemical localization of acyl-CoA hydrolase/thioesterase multigene family members to rat epithelia[J]. Histochemistry & Cell Biology,2002,117(3):211-217.
[26]Xia C Y,Dong R L,Chen C,et al. Cardiomyocyte specific expression of Acyl-CoA thioesterase 1 attenuates sepsis induced cardiac dysfunction and mortality[J]. Biochemical & Biophysical Research Communications,2015,468(4):533-540.
[27]Yang S L,Chen C,Wang H,et al. Protective effects of acyl-CoA thioesterase 1 on diabetic heart via PPAR alpha/PGC1 alpha signaling[J]. PLoS One,2012,7(11):e50376.
[28]Cheng Z J,Song F,Shan X Y,et al. Crystal structure of human thioesterase superfamily member 2[J]. Biochemical & Biophysical Research Communications,2006,349(1):172-177.
[29]Stavinoha M A,Rayspellicy J W,Essop M F,et al. Evidence for mitochondrial thioesterase 1 as a peroxisome proliferator-activated receptor-α-regulated gene in cardiac and skeletal muscle[J]. Am J Physiol Endocrinol Metab,2004,287(5):E888-E895.
[30]Leng X J,Wu X F,Tian J,et al. Molecular cloning of fatty acid synthase from grass carp (Ctenopharyngodon idella) and the regulation of its expression by dietary fat level[J]. Aquaculture Nutrition,2012,18(5):551-558.
[31]Westin M A K,Hunt M C,Alexson S E H. The identification of a succinyl-CoA thioesterase suggests a novel pathway for succinate production in peroxisomes[J]. Journal of Biological Chemistry,2005,280(46):38125-38132.
[32]Hunt M C,Greene S,Hultenby K,et al. Alternative exon usage selectively determines both tissue distribution and subcellular localization of the acyl-CoA thioesterase 7 gene products[J]. Cellular & Molecular Life Sciences,2007,64(12):1558-1570.
[33]Ellis J M,Wong G W,Wolfgang M J. Acyl coenzyme A thioesterase 7 regulates neuronal fatty acid metabolism to prevent neurotoxicity[J]. Molecular & Cellular Biology,2013,33(9):1869-1882.
[34]Yang J W,Czech T,Yamada J,et al. Aberrant cytosolic acyl-CoA thioester hydrolase in hippocampus of patients with mesial temporal lobe epilepsy[J]. Amino Acids,2004,27(3/4):269-275.
[35]Hunt M C,Tillander V,Alexson S E H. Regulation of peroxisomal lipid metabolism:the role of acyl-CoA and coenzyme A metabolizing enzymes[J]. Biochimie,2014,98(1):45-55.
[36]Hung Y H,Chan Y,Chang Y,et al. Fatty acid metabolic enzyme acyl-CoA thioesterase 8 promotes the development of hepatocellular carcinoma[J]. Oncology Reports,2014,31(6):2797-2803.
[37]Tillander V,Nordstrom E A,Reilly J,et al. Acyl-CoA thioesterase 9 (ACOT9) in mouse may provide a novel link between fatty acid and amino acid metabolism in mitochondria[J]. Cellular & Molecular Life Sciences,2014,71(5):933-948.
[38]Naoya S,Kazuki O,Fumihide I. Mouse cytosolic acetyl-CoA hydrolase,a novel candidate for a key enzyme involved in fat metabolism:cDNA cloning,sequencing and functional expression[J]. Acta Biochimica Polonica,2002,49(4):937-945.
[39]Yasuhiro H,Htromi A,Masahiko I,et al. Enzymatic and transcriptional regulation of the cytoplasmic acetyl-CoA hydrolase ACOT12[J]. Journal of Lipid Research,2013,54(8):2049-2059.
[40]Matsunaga T,Isohashi F,Nakanishi Y,et al. Physiological changes in the activities of extramitochondrial acetyl-CoA hydrolase in the liver of rats under various metabolic conditions & nbsp[J]. European Journal of Biochemistry,2005,152(2):331-336.
[41]Keishi K,Wu M K,Agate D S,et al. Interacting proteins dictate function of the minimal START domain phosphatidylcholine transfer protein/StarD2[J]. Journal of Biological Chemistry,2007,282(42):30728-30736.
[42]Wei J,Kang H W,Cohen D E. Thioesterase superfamily member 2 (Them2)/acyl-CoA thioesterase 13 (Acot13):a homotetrameric hotdog fold thioesterase with selectivity for long-chain fatty acyl-CoAs[J]. Biochemical Journal,2009,421(2):311-322.
[43]Kawano Y,Ersoy B A,Li Y,et al. Thioesterase superfamily member 2 (Them2) and phosphatidylcholine transfer protein (PC-TP) interact to promote fatty acid oxidation and control glucose utilization[J]. Molecular & Cellular Biology,2014,34(13):2396-2408.
[44]Maira S M,Galetic I,Brazil D P,et al. Carboxyl-terminal modulator protein (CTMP),a negative regulator of PKB/Akt and v-Akt at the plasma membrane[J]. Science,2001,294(5541):374-380.
[45]Zhao H,Martin B M,Bisoffi M,et al. The Akt C-terminal modulator protein is an acyl-CoA thioesterase of the hotdog-fold family[J]. Biochemistry,2009,48(24):5507-5509.
[46]Zhuravleva E,Gut H,Hynx D,et al. Acyl coenzyme A thioesterase them5/acot15 is involved in cardiolipin remodeling and fatty liver development[J]. Molecular & Cellular Biology,2012,32(14):2685-2697.
[47]Parcellier A,Tintignac L A,Zhuravleva E,et al. Carboxy-terminal modulator protein (CTMP) is a mitochondrial protein that sensitizes cells to apoptosis[J]. Cellular Signalling,2009,21(4):639-650.
[48]Alpy F,Tomasetto C. START ships lipids across interorganelle space[J]. Biochimie,2014,96:85-95.
[49]Leesong M,Henderson B S,Gillig J R,et al. Structure of a dehydratase-isomerase from the bacterial pathway for biosynthesis of unsaturated fatty acids:two catalytic activities in one active site[J]. Structure,1996,4(3):253-264.
[50]Pidugu L S,Maity K,Ramaswamy K,et al. Analysis of proteins with the ‘hot dog fold:prediction of function and identification of catalytic residues of hypothetical proteins[J]. BMC Structural Biology,2009,9:37.
[51]Dillon S C,Bateman A. The Hotdog fold:wrapping up a superfamily of thioesterases and dehydratases[J]. BMC Bioinform,2004,5.
[52]Alpy F,Tomasetto C. Give lipids a START:the StAR-related lipid transfer (START) domain in mammals[J]. Journal of Cell Science,2005,118(13):2791-2801.
[53]Forwood J K,Thakur A S,Gregor G,et al. Structural basis for recruitment of tandem hotdog domains in acyl-CoA thioesterase 7 and its role in inflammation[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(25):10382-10387.
[54]Swarbrick C M D,Roman N,Cowieson N,et al. Structural basis for regulation of the human acetyl-CoA thioesterase 12 and interactions with the steroidogenic acute regulatory protein-related
lipid transfer (START) domain[J]. Journal of Biological Chemistry,2014,289(35):24263-24274.
[55]Mandel C R,Benjamin T,Liang T. Crystal structure of human mitochondrial acyl-CoA thioesterase (ACOT2)[J]. Biochemical and Biophysical Research Communications,2009,385(4):630-633.
[56]Shabalina I G,Backlund E C,Bar-Tana J,et al. Within brown-fat cells,UCP1-mediated fatty acid-induced uncoupling is independent of fatty acid metabolism[J]. Biochimica et Biophysica Acta,2008,1777(7/8):642-650.
[57]胡曉维,靳聪飞,刘新峰,等. 牛ACOT11基因克隆及其编码蛋白生物信息学分析[J]. 天津农学院学报,2015,22(3):1-6.
[58]Gregor M F,Hotamisligil G S. Inflammatory mechanisms in obesity[J]. Annual Review of Immunology,2010,29(1):415-445.黄俊,梁士劼. 利用联合生物加工生产纤维素乙醇的研究进展[J]. 江苏农业科学,2021,49(2):18-23.

