灵武长枣果实维管束韧皮部及周围细胞的超微结构特征
黄月 章英才 苏伟东 海源 张媛 景红霞
摘 要: 为了探讨灵武长枣果实光合同化物韧皮部卸载和运输的途径,该研究采用透射电镜技术,对不同发育时期灵武长枣果实维管束韧皮部及其周围薄壁细胞的超微结构特征进行了分析。结果表明:筛管/伴胞复合体及其周围韧皮薄壁细胞间在果实膨大前期富含胞间连丝,而韧皮薄壁细胞与周围库细胞以及相邻库细胞间几乎不存在胞间连丝,形成共质体隔离;筛管/伴胞复合体及其与周围薄壁细胞间在果实快速膨大期也存在胞间连丝,但与果实膨大前期相比明显减少;果实着色期,SE/CC复合体及其与周围薄壁细胞间胞间连丝较少,并且出现阻塞现象;果实完熟期,筛管和伴胞之间几乎没有胞间连丝,有的筛管之间有少量胞间连丝,但却出现了阻塞现象,果肉库薄壁细胞与韧皮薄壁细胞间因胞间连丝阻塞现象而形成共质体隔离。综上结果认为,在果实发育的膨大前期阶段,光合同化物以共质体途径经筛分子卸出,卸出后可能以质外体途径进入液泡贮藏与利用;果实快速膨大期,光合同化物的卸出与运输采用共质体和质外体共存的途径;果实着色期和完熟期,光合同化物从筛分子卸出到贮藏薄壁细胞的运输均以质外体途径为主。
关键词: 灵武长枣, 果实, SE/CC复合体, 薄壁细胞, 超微结构
Abstract: By using transmission electron microscopy, the ultrastructures of different developmental stages Ziziphus jujuba cv. Lingwuchangzao fruit vascular bundles phloem and its surrounding parenchyma cells were analysed to discover the phloem unloading and transport pathway of photoassimilates. The results were as follows: SE/CC complex and its surrounding phloem parenchyma cells between riched plasmodesmata, and phloem parenchyma cells and surrounding cells and adjacent flesh parenchyma cells were almost non-existent plasmodesmata and formed symplastic isolation in the early bulking period; In the rapid enlargement period, plasmodesmata were found between SE/CC complex and the surrounding parenchyma cells, but the number significantly reduced compared with the early bulking period; In the coloring period, SE/CC complex and its surrounding parenchyma cells had less plasmodesmatas and appeared blockade phenomenon; In the maturation period, there were not almost plasmodesmata between sieve tube elements and companion cells, some sieve tube elements had less plasmodesmatas but appeared blockade phenomena, flesh parenchyma cells and phloem parenchyma cells formed symplastic isolation because of plasmodesmatas blockade phenomena. Therefore, the unloading of photoassimilates from sieve tube element was symplast pathway and adopted apoplastic pathway after unloading into vacuole storage and utilization in the early bulking period, the unloading transportant of photoassimilates took the symplast and apoplastic concomitant pathway in the rapid enlargement period, transportation of photoassimilates from sieve tube element to storage parenchyma cells was based on apoplastic pathway in the coloring period and the maturation period fruit.
Key words: Ziziphus jujuba cv. Lingwuchangzao, fruit, SE/CC complex, parenchyma cell, ultrastructure
棗树的果实产量和品质在很大程度上由积累糖的种类和数量所决定,而韧皮部卸载方式又影响着果实糖分的积累,并且决定着光合同化物从筛管到果肉薄壁细胞的运输(Braun et al.,2014)。Liesche et al.(2011)研究发现,不同植物的果实或不同发育时期的果实,其韧皮部卸载方式可能不同,韧皮部卸载可分为共质体卸载途径、质外体卸载途径以及两者之间的交替转换型。
果实韧皮部筛管/伴胞复合体及其与周围薄壁细胞间的胞间连丝不仅提供了共质体物质运输的通道,而且通过胞间连丝频率、数量和胞间连丝通道的大小影响共质体运输的速率,并且通过影响细胞到细胞间的导度调控着同化物共质体运输的能力(Lucas,2006)。因此,植物果实可通过调节胞间连丝数量和大小等来提高共质体运输的能力,以适应果实高浓度糖同化物的积累。胞间连丝在筛分子和伴胞一侧分别为单通道和多分枝通道,其数量和通透性可能会引起光合同化物卸载路径的转变。研究表明,由于苹果韧皮部SE/CC复合体与周围薄壁细胞间缺乏胞间连丝,因此不同发育时期果实均采用质外体途径卸载光合同化产物(Zhang et al.,2004);草莓(Li et al.,2012)、黄瓜(Hu et al.,2011)、桃(Zanon et al.,2015)、梨(Zhang et al.,2014)果实韧皮部卸载在整个发育过程中也主要为质外体卸载途径;葡萄果实在发育早期韧皮部各细胞之间存在丰富的胞间连丝,而始熟期胞间连丝由于被胼胝质阻塞而形成共质体隔离,光合同化物卸载也因此由早期的共质体途径卸载转变为质外体途径(Zhang et al.,2006);枣果实光合同化物从筛分子的卸出在发育早期或前期主要采取质外体途径,中期转变为共质体卸载途径,后期则重新转变为质外体卸载途径(Nie et al.,2010;侯思皓等,2017),类似的还有核桃(Wu et al.,2004)、马铃薯块茎(Viola et al.,2001)、幼嫩的叶(Liesche et al.,2011)等。由此看来,不同植物、不同部位或不同发育时期光合同化物的卸载方式因维管束韧皮部及其周围细胞超微结构的不同而存在着差异,呈现出多样性和复杂性的特点。
灵武长枣(Ziziphus jujuba cv. Lingwuchangzao)是具有宁夏地方特色的优良鲜食枣品种,具有良好的食用价值和药用价值(景红霞,2015)。近年来,针对灵武长枣鲜果保鲜、生理变化、栽培技术、品种选育、果实中多糖的分离提取、理化性质分析(刘晓连等,2013)等领域已有深入的研究,但灵武长枣果实韧皮部糖分卸载和运输的机制并不清楚,果实中光合同化物的积累受卸载路径的影响,研究果实韧皮部光合同化物卸载和运输的途径,对提高同化物向果实中运输、阐明光合同化物积累机制非常重要(Clearwater et al.,2012)。因此,本研究拟对不同发育时期灵武长枣果实维管束韧皮部及其周围库细胞超微结构进行研究,系统揭示灵武长枣果实光合同化物韧皮部卸载和运输的机制,明确果实光合同化物卸载和运输的细胞学途径,为灵武长枣果实品质的提高及其开发利用提供理论依据。
1 材料與方法
1.1 材料
以宁夏红枣工程技术研究中心试验基地的6年生灵武长枣为供试材料,采用随机区组设计,3次重复,每次重复选择树势适中、栽培管理一致的植株5~10株,选择3种不同颜色的毛线标记6月10日开放的花朵,每个重复标记大约3 000朵(章英才等,2016)。9:00—11:00分别从被标记植株树冠的东、南、西、北四个方位以及上、中、下、里、外的各个方向选取大小一致无病虫害的果实(章英才等,2016)。分别选取膨大前期(7月10日,花后30 d)、快速膨大期(8月9日,花后60 d)、着色期(9月8日,花后90 d)、完熟期(9月28日,花后110 d)4个不同发育时期的果实若干,用冰袋带回实验室备用。
1.2 方法
参考Wei et al.(2003)和明萌等(2017)的方法,分别将不同发育时期果实的中果皮切成1 mm × 1 mm × 2 mm小块(长轴与果实长轴一致)数个,首先用50 mmol·L-1的二甲胂酸钠缓冲液(pH7.2)配制成的2.5%戊二醛固定液在4 ℃下固定3 h,并抽气至样品材料沉入底部;其次用50 mmol·L-1的二甲胂酸钠缓冲液4 ℃洗涤3次(每次30 min),1%锇酸4 ℃后固定12 h;再用50 mmol·L-1的二甲胂酸钠缓冲液洗涤3次(每次30 min),依次用20%、40%、60%、80%、90%丙酮、纯丙酮脱水,系列浓度梯度丙酮脱水后用Epon812环氧树脂渗透和包埋;最后用Leica EM UC6超薄切片机切片(厚度约800 ),超薄切片用醋酸双氧铀与柠檬酸铅双染色,H-7650型透射电镜观察和拍照(章英才和景红霞,2014)。
2 结果与分析
2.1 膨大前期果实韧皮部的超微结构特征
韧皮部细胞壁胞间层电子密度高且与相邻细胞的初生壁结合形成两明夹一暗的结构特征,筛管细胞核、液泡消失,线粒体、内质网及高尔基体等细胞器较少且分布于筛管分子侧壁(图版Ⅰ:1,2)。位于筛管旁边体积较小的伴胞通常细胞核大、细胞质浓密,管状粗面内质网、质体、线粒体及高尔基体等细胞器丰富,圆形或椭圆形线粒体内嵴明显、结构清晰(图版Ⅰ:2,3)。SE/CC复合体间因胞间连丝较多而形成共质体联系,且在筛分子SE一侧形成单通道,而在伴胞CC一侧形成多分枝通道(图版Ⅰ:3,4)。在SE/CC复合体周围的韧皮薄壁细胞体积较伴胞大,线粒体、质体、内质网、液泡等细胞器分布于细胞中央或细胞壁附近,数量较多,大小各异的囊泡较丰富,细胞中含少量淀粉粒(图版Ⅰ:5),韧皮薄壁细胞与筛管/伴胞复合体间具有胞间连丝,并且在相邻伴胞的一侧形成质膜内陷并导致较多囊泡的产生(图版Ⅰ:3,4)。果肉库薄壁细胞与韧皮薄壁细胞相似,体积较大且线粒体、质体、内质网等细胞器分布较多,细胞不仅具有液泡,而且囊泡也较丰富,但果肉库薄壁细胞与韧皮部薄壁细胞的主要区别在于,其细胞体积较大、液泡更加明显(图版Ⅰ:6);另外,胞间连丝在果肉库薄壁细胞和韧皮薄壁细胞之间以及果肉库薄壁细胞之间基本没有分布,使果实韧皮部与果肉库薄壁细胞间形成了共质体隔离(图版Ⅰ:7,8)。
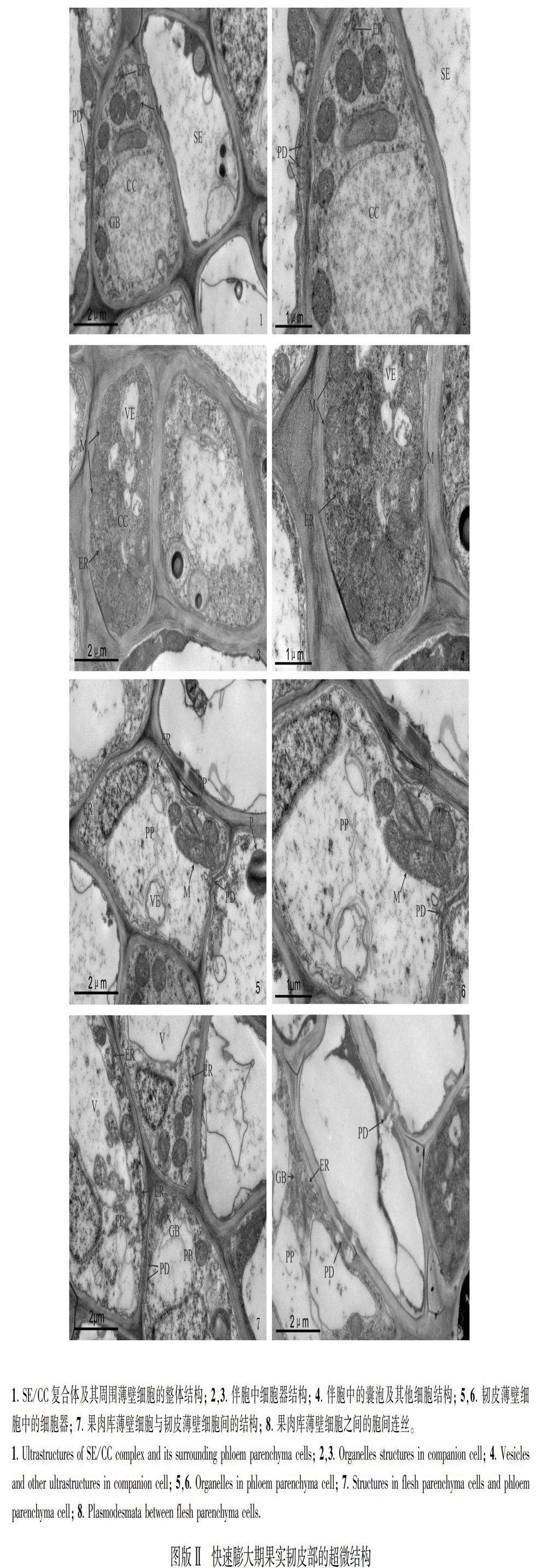
2.2 快速膨大期果实韧皮部的超微结构特征
果实维管束韧皮部细胞排列比较紧密,由筛管、伴胞、韧皮薄壁细胞等不同类型的细胞组成,其中筛管分子细胞演化为无细胞核的细胞,线粒体、内质网等细胞器较少且分布于细胞壁附近(图版Ⅱ:1,2);而伴胞的细胞核较大,线粒体、内质网及高尔基体等细胞器结构清晰、数目增多,并且细胞内囊泡数目逐渐增加(图版Ⅱ:2,3);筛管细胞分子之间、以及筛管分子与其周围的韧皮薄壁细胞之间存在胞间连丝,仍保持着共质体联系,但胞间连丝分布与果实膨大前期相比有一定程度的减少(图版Ⅱ:1-6)。韧皮薄壁细胞细胞核体积较大,结构清晰,液泡化程度较高且囊泡较多,细胞内线粒体、内质网、质体等细胞器数目较多,分布于细胞核的周围 (图版Ⅱ:5,6); 果肉庫薄壁细胞1. SE/CC复合体及其周围薄壁细胞的超微结构; 2. 伴胞中的细胞器; 3. 筛管伴胞SE/CC复合体之间的胞间连丝; 4. 伴胞与韧皮薄壁细胞之间的胞间连丝; 5. 韧皮薄壁细胞中的细胞器; 6. 果肉库薄壁细胞中的细胞器; 7,8. 韧皮部薄壁细胞及果肉库薄壁细胞中的囊泡及细胞器。SE. 筛管分子; CC. 伴胞; PP. 韧皮薄壁细胞; FP. 库果肉薄壁细胞; PD. 胞间连丝; VE. 囊泡; V. 液泡; ER. 内质网; GB. 高尔基体; M. 线粒体; N. 细胞核; P. 质体; S. 淀粉粒。下同。的细胞壁结构清晰,中央液泡的体积明显较其他细胞大,内质网、质体、线粒体等细胞器数目较多,与囊泡、细胞核等沿细胞侧壁分布于液泡周围,果肉库薄壁细胞之间及其与韧皮薄壁细胞间分布着胞间连丝(图版Ⅱ:7,8)。
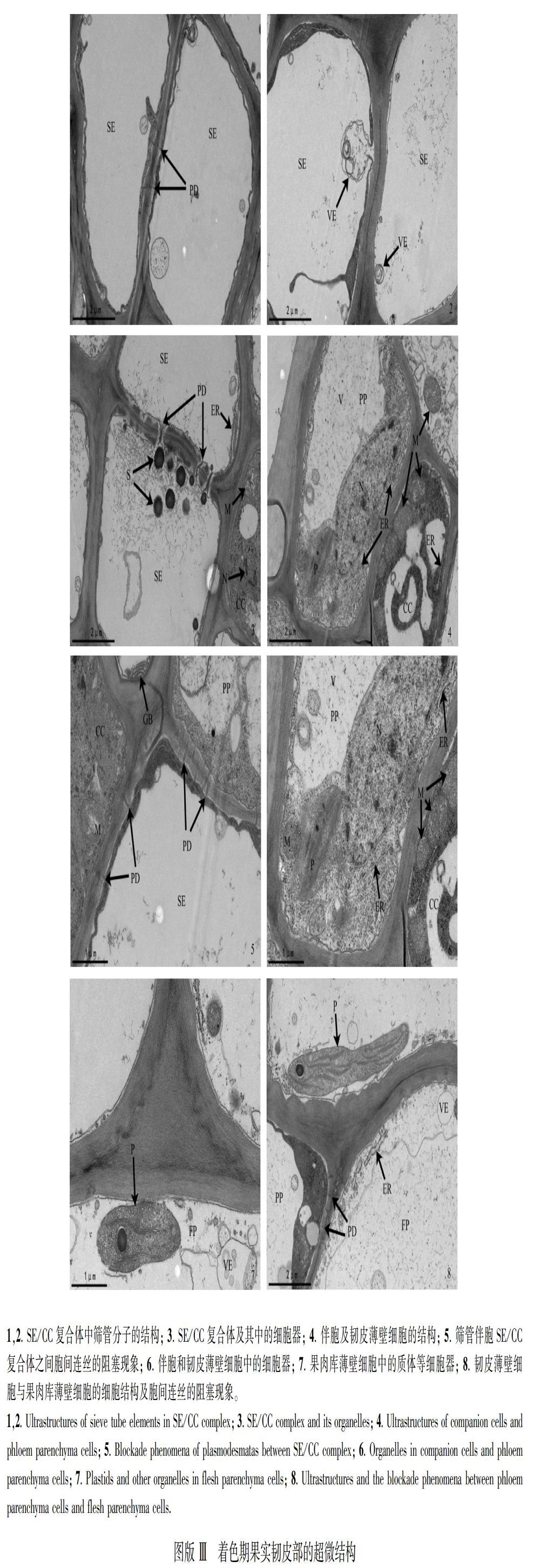
2.3 着色期果实韧皮部的超微结构特征
韧皮部细胞壁胞间层电子密度较果实膨大前期、快速膨大期逐渐降低,且与相邻细胞的初生壁结合形成两明夹一暗的三层结构,较果实膨大前期、快速膨大期逐渐变得模糊。组成韧皮部的筛管细胞分子没有细胞核,由于液泡的解体、线粒体的降解等,线粒体、质体、内质网及高尔基体等细胞器的分布较少,而大小不等、形态各异的囊泡却比较丰富,淀粉粒的数量显著增多(图版Ⅲ:1,2,3);伴胞细胞质浓密,细胞中具有明显的核仁,线粒体、内质网及高尔基体等细胞器以及囊泡的数量明显增多(图版Ⅲ:3,4)。与膨大前期果实相比,筛管/伴胞SE/CC间的胞间连丝数量较少并且产生了阻塞现象(图版Ⅲ:3,5),韧皮薄壁细胞中具有明显的大液泡,或位于细胞的边缘或位于细胞的中央,不同形态的囊泡比较丰富,线粒体、质体和内质网等细胞器的结构清晰、数目明显增多,由于液泡的存在而分布于细胞壁周围(图版Ⅲ:4,6);果肉库薄壁细胞中质体的片层结构清晰、不同形态的囊泡比较丰富,内质网、线粒体等细胞器的数目增多(图版Ⅲ:7,8);果肉库薄壁细胞与韧皮薄壁细胞之间,以及相邻的果肉库薄壁细胞间胞间连丝也存在一定被阻塞的现象而形成共质体隔离(图版Ⅲ:8)。
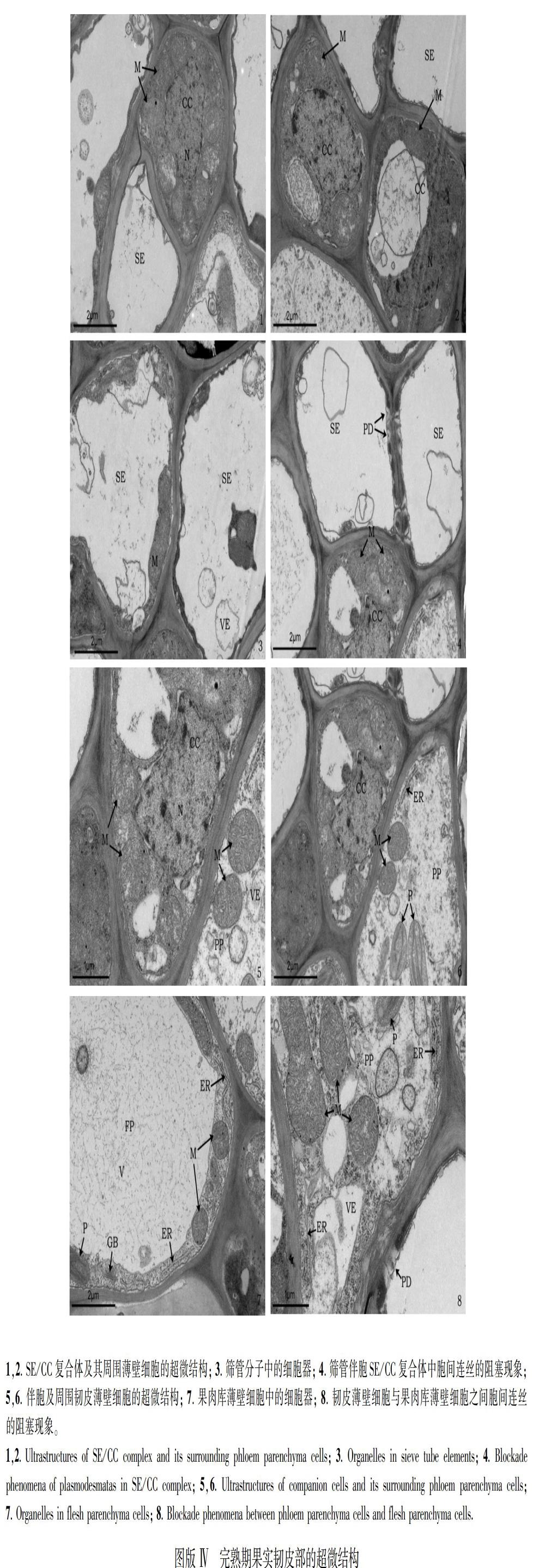
2.4 完熟期果实韧皮部的超微结构特征
韧皮部的筛管分子不具细胞核,随着筛管的分化液泡逐渐解体,线粒体、高尔基体及内质网等细胞器有时表现为沿筛管分子的侧壁分布,但这些细胞器与细胞中其他结构相比数量相对较少,囊泡分布数量也较少(图版Ⅳ:1,2,3);筛管附近的伴胞体积大小不一,但细胞核均较大、细胞质均浓密,在细胞核周围线粒体数量较多、呈圆状或椭圆状、结构清晰、内嵴明显,而内质网等细胞结构及其囊泡的数量相对较少(图版Ⅳ: 1,2)。与膨大前期和快速膨大期果实相比,筛管和伴胞之间及其与韧皮薄壁细胞之间几乎没有胞间连丝,有的筛管之间分布有少量的胞间连丝,却产生了阻塞现象(图版Ⅳ:3,4)。SE/CC复合体的周围韧皮薄壁细胞分布较多,其体积通常较伴胞大,韧皮薄壁细胞中囊泡较少,线粒体、粗面内质网、滑面内质网、质体、高尔基体等细胞器的数量丰富,质体的片层结构非常清晰(图版Ⅳ:5,6);果肉库薄壁细胞中线粒体、质体、高尔基体、内质网数目增多、结构清晰,液泡明显、体积较大,将细胞器及细胞内的其他结构挤至细胞的边缘(图版Ⅳ:7),与韧皮薄壁细胞间因胞间连丝阻塞现象而形成共质体隔离(图版Ⅳ:8)。
3 讨论与结论
3.1 果实维管束韧皮部卸载的细胞学途径
果实库器官光合同化物韧皮部卸载通常具有共质体途径和质外体途径两种方式,同化物卸载在各不同发育时期库器官中以一种途径为主,或者两种方式交替并存(Liesche et al.,2011)。本研究表明,在果实膨大前期,不仅SE/CC复合体间胞间连丝较多,而且与周围韧皮薄壁细胞之间的胞间连丝也相对较多,形成了共质体联系。SE/CC复合体中伴胞主要有中间细胞类型、转移细胞类型及普通细胞类型三种(Van et al.,1988;Turgeon et al.,1993;Kempers et al.,1998;张鹤华等,2017),膨大前期果实韧皮部SE/CC复合体中伴胞的类型表现为中间细胞特征,与周围薄壁细胞之间有较多的胞间连丝分布,特化为共质体同化物卸载的标志性结构,为物质运输采用共质体途径提供了通道,通过胞间连丝的溶液集流和扩散作用,无需消耗能量,其运输光合同化物的能力较高且运输阻力较小,为早期果实的正常生长发育提供了保障。在果实快速膨大期,SE/CC复合体筛管细胞分子之间、筛管分子与其周围的韧皮薄壁细胞之间存在胞间连丝,仍保持着共质体联系,但胞间连丝分布与果实膨大前期相比有一定程度的减少;不仅伴胞中线粒体等细胞器数目增多,囊泡逐渐丰富,而且ATPase的定位(章英才和景红霞, 2014)结果也显示, 在果实快速膨大期SE/CC复合体的质膜、核膜、囊泡膜、胞间隙等结构中分布着ATPase活性反应物,表明果实快速膨大期韧皮部光合同化物的卸载除了共质体卸载方式外,还存在需要消耗能量的质外体途径。与果实膨大前期和快速膨大期相比,在果实着色期和完熟期,筛管、伴胞之间及其与韧皮薄壁细胞之间几乎没有胞间连丝,或伴胞与周围薄壁细胞之间的胞间连丝因胼胝质而阻塞,形成共质体隔离的现象,伴胞的类型为普通细胞类型,是适应质外体光合同化物卸载的标志性结构特征,说明着色期和完熟期果实韧皮部光合同化物采用质外体途径卸出。并且,在果实着色期,筛管分子内淀粉粒的数量显著增多,表明光合同化物可能以淀粉形式贮藏,与冬枣果实韧皮部的研究结果相似(聂佩显等,2009);着色期和完熟期,SE/CC复合体线粒体、内质网、质体、高尔基体以及囊泡等结构的显著增多,表明其正在参与旺盛的物质卸载运输。因此,不同发育阶段灵武长枣果实韧皮部光合同化物的卸载路径有所不同,同化物的卸出方式经历了共质体途径向质外体途径转变的过程。由于桃果实SE/CC复合体与周围韧皮薄壁细胞之间不同发育时期都缺乏胞间连丝的分布,因而各发育时期果实均以质外体途径卸载光合同化物(Zanon et al.,2015),类似的苹果(Zhang et al.,2004)、草莓(Li et al.,2012)、黄瓜(Hu et al.,2011)、梨(Zhang et al.,2014)等果实在整个发育过程中韧皮部卸载也均为质外体途径;而葡萄果实库器官SE/CC复合体与周围薄壁细胞之间由早期韧皮部各种细胞间胞间连丝丰富,转变为始熟期胞间连丝缺乏或阻塞,果实库器官光合同化物由共质体卸载途径,转变为由于形成共质体隔离而导致的质外体卸载途径(Zhang et al.,2006),冬枣和梨枣(Nie et al.,2010)、枣和酸枣(侯思皓等,2017)、无花果(李春丽等,2016)、番茄(Ruan & Patrick,1995)随着果实发育卸载方式发生转变的现象均与之相似。由此可以看出,果实库器官筛管/伴胞(SE/CC)复合体的结构及其与周围韧皮薄壁细胞之间胞间连丝分布或者通透性的变化,有可能引起果实库器官光合同化物由SE/CC复合体卸载到周围薄壁细胞的路径因此而发生相应的变化。
果实韧皮部卸载途径随着植物种类的不同以及果实发育时期的不同有可能发生变化,由此影响果实光合同化物的积累并决定果实的品质(Braun et al.,2014)。灵武长枣由果实快速膨大期发育至果实完熟期,蔗糖等可溶性糖的含量显著增高(章英才等,2014),此时糖分如果仍然采用膨大前期被动运输扩散的共质体途径逆浓度梯度进行卸载,可能导致果肉库积累的光合同化物通过共质体通道回流至SE/CC复合体,光合同化物无法卸载。在果实由膨大前期、快速膨大期发育至果实着色期和完熟期时采取的光合同化物卸载途径,由早期的共质体卸载方式转变为着色期和完熟期的質外体卸载方式,阻止了光合同化物逆向回流现象的发生。因此,果实完熟期可溶性糖大量积累时韧皮部的共质体隔离阻断了光合同化物的回流(李春丽等,2016),其普遍意义在于对很多积累高浓度糖植物的果实库器官在光合同化物卸载途径方面具有重要价值。这种卸载机制明显不同于块茎(Viola et al.,2001)、叶(Liesche et al.,2011)等营养库。在某种程度上,库卸载机制与其发育和功能紧密相关(侯思皓等,2017),不同发育时期果实光合同化物的卸载方式,随着其生理特征的变化而进行转变和调整,这对果实库组织的正常发育和光合同化物的积累具有重要意义。
3.2 果实光合同化物运输的细胞学途径
光合同化物经果实韧皮部SE/CC复合体卸出后,穿过质膜和液泡膜进入果实库薄壁细胞中以蔗糖、果糖和葡萄糖等形式贮藏积累,果实韧皮部后光合同化物运输与果实糖分积累关系密切(章英才等,2016),光合同化物韧皮部后运输与韧皮部卸载相似,也具有共质体途径和质外体途径。在果实膨大前期,SE/CC复合体周围的韧皮薄壁细胞具有一定数量的淀粉粒,这可能是薄壁细胞将积累的光合同化物转变为淀粉,从而降低了卸载区细胞光合同化物的浓度,有利于增加果实糖的贮藏和积累(景红霞,2015;张大鹏等,1997);果肉库薄壁细胞与韧皮薄壁细胞相似,细胞不仅具有较大的体积、明显的液泡、分布较多的线粒体等细胞器、较丰富的囊泡等特征,并且韧皮部与果肉库薄壁细胞间形成了共质体隔离,表明果肉库细胞通过内吞的囊泡运输方式将光合同化物贮藏积累于液泡。在果实快速膨大期,果肉库薄壁细胞内质网、质体、线粒体等细胞器数目较多,表明细胞内的物质代谢和运转功能比较活跃,果肉库薄壁细胞之间及其与韧皮薄壁细胞间分布着胞间连丝,为细胞间物质的交换提供了便利的条件,暗示光合同化物经SE/CC复合体卸出后,同化物在薄壁细胞间的运输可能以共质体途经为主,与冬枣果实韧皮部的研究结果相似(聂佩显等,2009),但与苹果果实研究结果略有不同(吕英民等,2000)。果实着色期和完熟期,果肉库薄壁细胞与韧皮薄壁细胞之间,以及相邻的果肉库薄壁细胞间,由于胞间连丝具有被阻塞的现象而形成了共质体隔离,光合同化物的运输由之前的共质体途径转变为质外体途径。灵武长枣不同发育时期果实韧皮部后糖分运输生理机制结果也显示,果实糖分跨质膜、液泡膜运输存在主动运输和被动运输过程,光合同化物的韧皮部后运输存在共质体途径、质外体途径(章英才等,2016)。有研究表明,无花果果实在始熟期前韧皮部卸载途径为共质体途径,在始熟期后则转变为质外体卸载途径,而薄壁细胞之间在果实整个发育过程中存在大量胞间连丝,果实的韧皮部后运输始终为共质体途径(李春丽等,2016);蓝莓果实整个发育过程中SE/CC复合体同周围薄壁细胞保持共质体隔离,果实光合同化物卸载以质外体途径为主,但韧皮薄壁细胞之间以及韧皮薄壁细胞与果肉细胞之间则保持着共质体联系,存在大量的胞间连丝,有利于细胞间物质的交流,光合同化物的韧皮部后运输存在着活跃的共质体途径(张鹤华等,2017)。综上所述,就同一植物来说,同化物韧皮部卸载途径与其韧皮部后运输途径不一定完全相同,在果实发育过程中也可能发生变化或始终如一,各采取哪种方式与其结构发育密切相关;果实SE/CC复合体的超微结构以及韧皮薄壁细胞与果肉库细胞之间胞间连丝分布或者通透性决定着韧皮部后运输的途径,不同的植物种类以及不同的生长发育时期,果实光合同化物的韧皮部后运输途径可能存在着差异。
因此,灵武长枣在果实发育的膨大前期阶段,光合同化物以共质体途径经筛分子卸出;果实快速膨大期,光合同化物的卸出与运输采用共质体、质外体共存的途径;果实着色期和完熟期,光合同化物从筛分子卸出到贮藏薄壁细胞的运输均以质外体途径为主。
参考文献:
BRAUN DM, WANG L, RUAN YL, 2014. Understanding and manipulating sucrose phloem loading, unloading, metabolism, and signalling to enhance crop yield and food security [J]. J Exp Bot, 65 (7): 1713-1735.
CLEARWATER MJ, LUO Z, ONG SE, et al., 2012. Vascular functioning and the water balance of ripening kiwifruit (Actinidia chinensis) berries [J]. J Exp Bot, 63(5): 1835-1847.
HOU SH, BIAN Y, NIU HL, et al., 2017. Phloem unloading and sugar accumulation in jujube fruits [J]. J Fruit Sci, 34(12): 1580-1589. [侯思皓, 边媛, 牛辉陵, 等, 2017. 枣和酸枣果实韧皮部糖分卸载途径及其积累研究 [J].果树学报, 34(12):1580-1589.]
HU LP, SUN HH, LI RF, et al., 2011. Phloem unloading follows an extensive apoplasmic pathway in cucumber (Cucumis sativus L.) fruit from anthesis to marketable maturing stage [J]. Plant Cell Environ, 34: 1835-1848.
JING HX, 2015. Studies on sugar unloading and transport mechanism in Ziziphus jujuba Mill cv. Lingwuchangzao fruit [D]. Yinchuan: Ningxia University. [景红霞, 2015. 灵武长枣果实糖分卸载与运输机制研究 [D].银川:宁夏大学.]
KEMPERS R, AMMERLAAN A, VAN BEL AJE, 1998. Symplasmic constriction and ultrastructural features of the sieve element/companion cell complex in the transport phloem of apoplasmically and symplasmically phloem-loading species [J]. Plant Physiol, 116(1): 271-278.
LI CL, FANG KF, LEI H, et al., 2012. Phloem unloading follows an extensive apoplastic pathway in developing strawberry fruit [J]. J Hortic Sci Biotechnol, 87: 470-477.
LI CL, HOU BZ, ZHANG XY, et al., 2016. A shift of phloem unloading from symplasmic to apoplasmic pathway during fig fruit development [J]. Chin Sci Bull, 61(8): 835-843. [李春麗, 侯柄竹, 张晓燕, 等, 2016. 无花果果实韧皮部卸载路径由共质体向质外体途径转变 [J]. 科学通报, 61(8):835-843.]
LIESCHE J, MARTENS HJ, SCHULZ A, 2011.Symplasmic transport and phloem loading in gymnosperm leaves [J]. Protoplasma, 248: 181-190.
LIU XL, LI YL, LUO RM, et al., 2013. Structural characterization and physio-chemical properties of Lingwu long jujube polysaccharide [J]. Food Sci, 34(15):120-125. [刘晓连, 李亚蕾, 罗瑞明, 等, 2013. 灵武长枣水提多糖结构特征及理化性质 [J].食品科学, 34(15):120-125.]
LUCAS WJ, 2006. Plant viral movement proteins: Agents for cell-to-cell trafficking of viral genomes [J]. Virology, 344: 169-184.
L YM, ZHANG DP, YAN HY, 2000. Ultrastructure of phloem and its surrounding parenchyma cells in the developing apple fruit [J]. Acta Bot Sin, 42(1):32-42. [吕英民, 张大鹏, 严海燕, 2000. 苹果果实韧皮部及其周围薄壁细胞的超微结构观察和功能分析 [J]. 植物学报, 42(1):32-42.]
MING M, HE JW, LU D, et al., 2017. Effects of low temperature stress on physiological characteristics and ultrastructure of “Fanjing” Rhododendron leaves [J]. Guihaia, 37(8):969-978. [明萌, 何静雯, 卢丹, 等, 2017. 低温胁迫对“繁景”杜鹃生理特性及叶片超微结构的影响 [J].广西植物, 37(8):969-978.]
NIE PX, GUAN QZ, ZHANG ZX, et al., 2009. Ultrastructures of phloem and its surrounding parenchyma cells in the developing Zizyphus jujuba Mill. cv. Dongzao fruit [J]. J Chin Electron Microsc Soc, 28(4): 389-395. [聂佩显, 关秋竹, 张振贤, 等, 2009. 冬枣果实韧皮部及其周围薄壁细胞的超微结构观察和功能分析 [J]. 电子显微学报, 28(4): 389-395.]
NIE PX, WANG XY, HU LP, et al., 2010. The predominance of the apoplasmic phloem-unloading pathway is interrupted by a symplasmic pathway during Chinese jujube fruit development [J].Plant Cell Physiol, 51(6): 1007-1018.
RUAN YL, PATRICK JW, 1995. The cellular pathway of postphloem sugar transport in developing tomato fruit [J]. Planta, 196: 434-444.
TURGEON R, BEEBE DU, GOWAN E, 1993. The intermediary cell: Minor-vein anatomy and raffinose oligosaccharide synthesis in the Scrophulariaceae [J]. Planta, 191(4): 446-456.
VAN BEL AJ, VAN KESTEREN WJ, PAPENHUIJZEN C, et al., 1988. Ultrastructural indications for coexistence of symplastic and apoplastic phloem loading in Commelina benghalensis leaves: Differences in ontogenic development, spatial arrangement and symplastic connections of the two sieve tubes in the minor vein [J]. Planta, 176(2): 159-172.
VIOLA R, ROBERTS AG, HAUPT S, et al., 2001. Tuberization in potato involves a switch from apoplastic to symplastic phloem unloading [J]. Plant Cell, 13(2): 385-398.
WEI CX, LAN SY, XU ZX, 2003. Ultracytochemical localization and functional analysis of ATPase during the endosperm development in Oryza sativa L. [J]. Agric Sci Chin, 2(2): 144-148.
WU GL, ZHANG XY, ZHANG LY, et al., 2004. Phloem unloading in developing walnut fruit is symplasmic in the seed pericarp and apoplasmic in the fleshy pericarp [J]. Plant Cell Physiol, 45 (10): 1461-1470.
ZANON L, FALCHI R, SANTI S, et al., 2015. Sucrose transport and phloem unloading in peach fruit: Potential role of two transporters localized in different cell types [J]. Physiol Plant, 154 (2): 179-193.
ZHANG DP, LI M, WANG Y,1997. Ultrastructural changes in the mesocarp cells of grape berry during its development [J]. Acta Bot Sin, 39(5): 389-396. [張大鹏, 李珉, 王毅, 1997. 葡萄果实发育过程中果肉细胞超微结构的观察 [J].植物学报, 39(5): 389-396.]
ZHANG HH, LI YF, NIE PX, et al., 2017. Phloem unloading pathway of photosynthates and sucrose-metabolizing enzymes activities in Vaccinium corymbosum fruit [J]. Sci Silv Sin, 53(3): 40-48. [张鹤华, 李艳芳, 聂佩显, 等, 2017. 蓝莓果实同化物韧皮部卸载路径与糖代谢酶活性 [J].林业科学, 53(3):40-48.]
ZHANG HP, WU JY, TAO ST, et al., 2014. Evidence for apoplasmic phloem unloading in pear fruit [J]. Plant Mol Biol Rep, 32(4): 931-939.
ZHANG LY, PENG YB, PELLESCHI-TRAVIER S,et al., 2004. Evidence for apoplasmic phloem unloading in developing apple fruit [J]. Plant Physiol, 135: 574-586.
ZHANG XY, WANG XL, WANG XF, et al., 2006. A shift of phloem unloading from symplasmic to apoplasmic pathway is involved in developmental onset of ripening in grape berry [J]. Plant Physiol, 142(1): 220-232.
ZHANG YC, CHEN YP, JING HX, et al., 2014. Relation between sugar accumulation and sucrose-metabolizing enzymes in fruit of ‘Lingwuchangzao(Ziziphus jujuba Mill.) [J]. J Fruit Sci, 31(2): 250-257. [章英才, 陈亚萍, 景红霞, 等, 2014. 灵武长枣果实糖积累与蔗糖代谢相关酶的关系 [J].果树学报, 31(2): 250-257.]
ZHANG YC, JING HX, 2014. Cytochemical localization and functional analysis of ATPase during fruit development of Ziziphus jujuba Mill cv. Lingwuchangzao [J]. Acta Bot Boreal-Occident Sin, 34(12): 2446-2452. [章英才, 景红霞, 2014. 灵武长枣果实ATPase超微细胞化学定位和功能研究 [J].西北植物学报, 34(12):2446-2452.]
ZHANG YC, SU WD, JING HX, et al., 2016. Physiological characteristic of postphloem sugar transport in fruit of Ziziphus jujuba Mill cv. Lingwuchangzao [J]. J Nucl Agric Sci, 30(1): 171-177. [章英才, 苏伟东, 景红霞, 等, 2016. 灵武长枣果实韧皮部后糖分运输生理特征研究 [J]. 核农学报, 30(1):171-177.]
(责任编辑 何永艳)

