自身免疫性甲状腺炎小鼠的巨噬细胞极化失衡及代谢方式改变
王诗淇,赵 蕾,史晓光
(中国医科大学附属第一医院 内分泌科 内分泌研究所 辽宁省内分泌疾病重点实验室,辽宁 沈阳 110001)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是一种器官特异性的自身免疫性疾病,因其发病机制由多种因素介导。研究指出,AIT的发生由体液免疫和细胞免疫共同介导,其中关键因素可能是免疫耐受破坏或缺失[1-3]。炎性细胞浸润发挥细胞毒性作用,损伤的甲状腺细胞呈现出新的或隐含抗原表位,导致包括不同亚群的巨噬细胞等主要细胞相容性复合体-Ⅱ(major histocompatibility complex-Ⅱ,MHC-Ⅱ)类抗原递呈细胞的浸润,并激活机体自身免疫性炎性反应,持续加重甲状腺内的淋巴细胞浸润及甲状腺细胞的损伤。巨噬细胞因其高度的异质性可在不同微环境下极化为M1型或M2型巨噬细胞,其中M1型(促炎型)可分泌炎性因子[4]。免疫代谢学研究发现,静息态的巨噬细胞极化为M1型的过程中发生代谢重编程,主要表现为有氧糖酵解代谢增强[5]。在多种自身免疫性疾病中已发现巨噬细胞浸润尤以M1型为主,但在AIT疾病中相关研究却较少。本研究利用碘诱导NOD.H-2h4小鼠建立AIT动物模型,初步探讨AIT发生发展中巨噬细胞极化及其代谢途径的变化情况,为进一步研究改变代谢途径来影响AIT的巨噬细胞极化提供基础及依据。
1 材料与方法
1.1 材料
1.1.1 NOD.H-2h4小鼠:4周龄雌鼠30只,体质量20 g左右(Jackson公司,在中国医科大学实验动物中心SPF 级实验室内饲养和繁殖)。动物饲养以及实验均根据动物实验指南并经过动物伦理委员会的批准(批准文号:2018121)。
1.1.2 试剂:ELISA试剂盒(中国酶免公司);巨噬细胞培养基、Seahorse培养基等(Seahorse Bioscience公司);红细胞裂解液、免疫荧光标记抗体包括抗CD11c、抗CD206(Abcam公司)。
1.2 方法
1.2.1 实验动物的分组及处理:将小鼠随机分为对照组(给予无菌双蒸水)和AIT组(给予0.05%碘化钠水),喂养8周,于实验开始8周后麻醉处死。
1.2.2 标本的采集:用10%水合氯醛麻醉后取心尖血,剥离甲状腺组织,于4%多聚甲醛溶液固定。无菌条件下打开腹腔切取脾脏,剪半待制备单个核细胞。
1.2.3 甲状腺组织的HE染色:经常规制石蜡切片后小鼠甲状腺组织HE(hematoxylin-eosin)染色,在光学显微镜下观察。参考国际通用NOD.H-2h4小鼠甲状腺炎性评分标准[6]。根据淋巴细胞浸润面积,对HE染色的甲状腺组织切片按如下标准进行评分:0分=正常;1分=1%~10%;2分=10%~30%;3分=30%~50%;4分>50%。甲状腺炎评分采用至少3个非连续的甲状腺组织切片的平均值表示。
1.2.4 ELISA测定血清甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)水平:参照ELISA试剂盒说明书步骤方法,经过孵育、清洗、封闭、终止反应,酶标仪450 nm测定吸光度值。
1.2.5 免疫荧光化学染色检测CD11c及CD206:各组NOD.H-2h4小鼠甲状腺石蜡切片免疫荧光染色检测M1型的分子标志物CD11c及M2型的分子标志物CD206的表达。小鼠甲状腺石蜡切片经过脱蜡、水化、抗原修复后封闭1 h,按说明书要求用抗体稀释液稀释的一抗至合适浓度(CD11c 1∶500,CD206 1∶200),每个组织滴加10 μL稀释后的一抗,湿盒中4 ℃孵育过夜,洗涤3次,加入稀释的荧光二抗,室温避光孵育2 h,洗片3次。每个组织滴加10 μL含脒基苯基吲哚(diamidino-phenyl-indole,DAPI)的封片剂。通过共聚焦显微镜观察并留取图片。
1.2.6 细胞能量代谢分析仪(Seahorse)分析脾脏巨噬细胞代谢
1.2.6.1 小鼠脾脏单个核细胞制备并诱导为巨噬细胞:取小鼠脾脏,在200目钢网上研磨,用1640培养液制成细胞悬液,离心,加入红细胞裂解液,静置5~10 min,离心清洗并计数。转移至培养基中,加入适量的巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)诱导,1 d后收集巨噬细胞。
1.2.6.2 Seahorse分析脾脏巨噬细胞代谢:水化探针板于无CO237 ℃温箱静置过夜。从培养液中收集细胞,用基础培养基制成细胞悬液,每孔80 μL约含1.2×104个细胞,接种于Seahorse专用96孔板,室温静置1 h,放入培养箱中继续培养23 h。按照说明书配置好相关的药物,在检测糖酵解功能的试验中,探针板A、B和C孔应依次加入葡萄糖、寡霉素和2-脱氧核糖各25 μL。检测线粒体呼吸功能的试验中,A、B和C孔则分别加入寡霉素、FCCP(解偶联剂)、鱼藤酮和抗霉素A各25 μL。校正探针板后,加入细胞培养板检测。
1.3 统计学分析

2 结果
2.1 NOD.H-2h4小鼠甲状腺炎HE染色及炎性评分
对照组小鼠的甲状腺滤泡细胞成椭圆或叶状排列,未见淋巴细胞的浸润(图1A)。AIT组小鼠甲状腺滤泡结构被破坏,间质伴淋巴细胞浸润及纤维组织增生(图1B~D)。对照组甲状腺炎评分均为0分,AIT组中3只为2分,4只为3分,3只为4分,发病率100%,两组间不同炎性评分构成比例存在差异(表1)(P<0.001)。
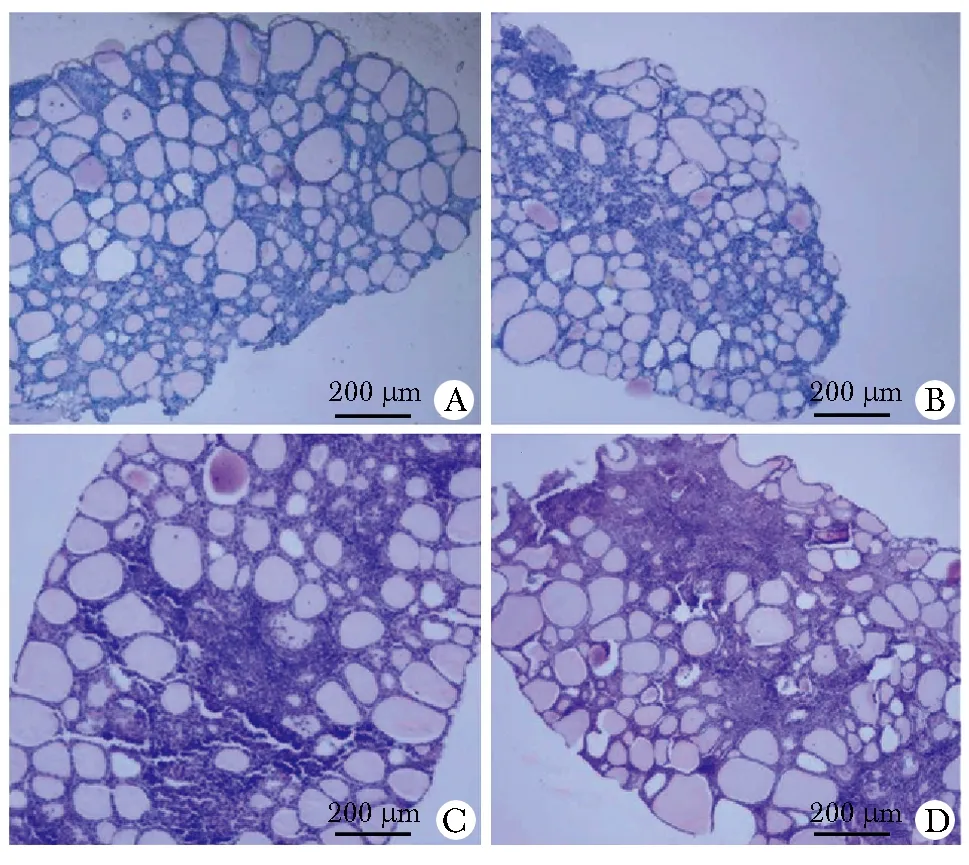
the score of thyroiditis:A.0;B.2;C.3;D.4图1 各组小鼠甲状腺HE染色Fig 1 HE staining of mice thyroid in each group (n=10)(×100)
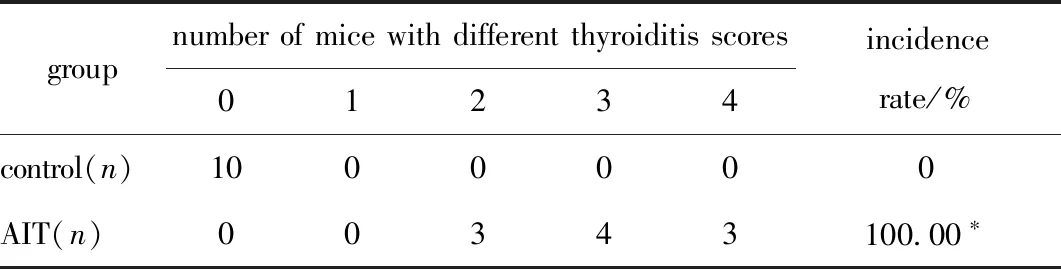
表1 各组小鼠甲状腺炎性评分及AIT发病率Table 1 Score of thyroiditis and incidence of AIT in each group(n=10)
2.2 ELISA检测各组小鼠血清TgAb水平
AIT组血清TgAb水平为(1.56±0.11)μg/dL高于对照组的(0.72±0.12)μg/dL(P<0.05)。
2.3 免疫荧光检测M1/M2型巨噬细胞比例
CD11c标记(红色荧光)的M1型巨噬细胞在对照组无阳性表达,而在AIT组的CD11c细胞荧光强度和细胞数量显著强于对照组(图2A);CD206标记(红色荧光)的M2型巨噬细胞在两组甲状腺组织中均有表达,但对照组CD206荧光强度和细胞数量均弱于AIT组(图2B);与对照组(0.23±0.02)相比,AIT组(2.94±0.48)的M1/M2比例显著增高(P<0.05)。
2.4 Seahorse分析能量代谢
AIT组细胞外酸化率(extracellular acidification rate,ECAR)值明显增高(图3A),糖酵解水平(glycolysis)和糖酵解能力(glycolytic capacity)均显著高于对照组(图3B)(P<0.05)。与对照组相比,AIT组耗氧率(O2consumption rate,OCR)值增高(图3C),基础呼吸(basal)、呼吸潜力(spare respiratory capacity)及ATP产率(ATP production)也显著增高(图3D)(P<0.05)。
3 讨论
NOD.H-2h4小鼠是具有自身免疫遗传倾向的易感动物,也是研究AIT机制的最理想动物模型。因其不会出现其他临床疾病,可用于观察特定细胞和分子对AIT疾病的影响[7]。给予4周龄NOD.H-2h4小鼠0.05%碘化钠水8周后,均发生AIT并有不同程度的淋巴细胞浸润和腺泡细胞破坏。实验结果表明AIT动物模型建模成功。

A.detection of M1 type macrophages in the thyroid of NOD.H-2h4 mice labeled with CD11c(×200);B.detection of M2 type macrophages in the thyroid of NOD.H-2h4 mice labeled with CD206(×200)图2 NOD.H-2h4小鼠甲状腺组织免疫荧光染色Fig 2 Immunofluorescence staining of thyroid in NOD.H-2h4 mice(n=10)
巨噬细胞是重要的炎性反应效应细胞,与自身免疫性疾病的发生发展密切相关。在正常情况下巨噬细胞为静息状态,在不同微环境下向M1型或M2型巨噬细胞分化的过程称为极化[8]。从宿主防御的角度来看,M1巨噬细胞具有促炎性,可以在抵抗微生物病原体和肿瘤的免疫中发挥积极作用。相反,M2巨噬细胞主要促进组织修复和代谢稳态[9]。在多种自身免疫性疾病中已经发现巨噬细胞浸润和M1型的激活,包括类风湿性关节炎、动脉粥样硬化、系统性红斑狼疮、多发性硬化和炎性肠病等[10],但未在AIT疾病中报道。本研究通过免疫荧光染色发现AIT小鼠甲状腺组织中M1型的比例明显高于对照组,说明AIT中存在M1/M2比例失衡,巨噬细胞向M1型极化。现有研究表明,巨噬细胞分化成特定表型,仍然保留了根据新的微环境而继续分化的能力,这种极化的可逆性具有至关重要的治疗价值,尤其是在M1/M2比例失衡起致病作用的疾病中[11]。
在其他自身免疫性疾病中发现M1型巨噬细胞发生了代谢重编程,有氧糖酵解增强而氧化磷酸化被抑制[12]。代谢重编程可以理解为细胞的主要代谢途径发生重建,其概念最早起源于Warburg效应[13],即在有氧条件下,肿瘤细胞的糖酵解增加,而有氧呼吸却被抑制。有研究发现,诱导增强巨噬细胞糖酵解会加重动脉粥样硬化的进展[14]。本研究将细胞外酸化率ECAR作为检测糖酵解的指标,耗氧率OCR则代表氧化磷酸化水平,结果表明AIT小鼠巨噬细胞的糖酵解与氧化磷酸化代谢水平均增强,尤其以糖酵解代谢增强为主。M1型巨噬细胞为支持促炎功能需增强糖酵解以快速供能,并且代谢产物可维持炎性微环境。这一结果提示,AIT小鼠巨噬细胞极化异常可能由免疫代谢调控。巨噬细胞不同的极化表型在代谢方式和功能上呈现出对抗的差异性,提供了调节免疫反应的可能,使影响其极化表型成为治疗相关自身免疫性疾病的新靶点。
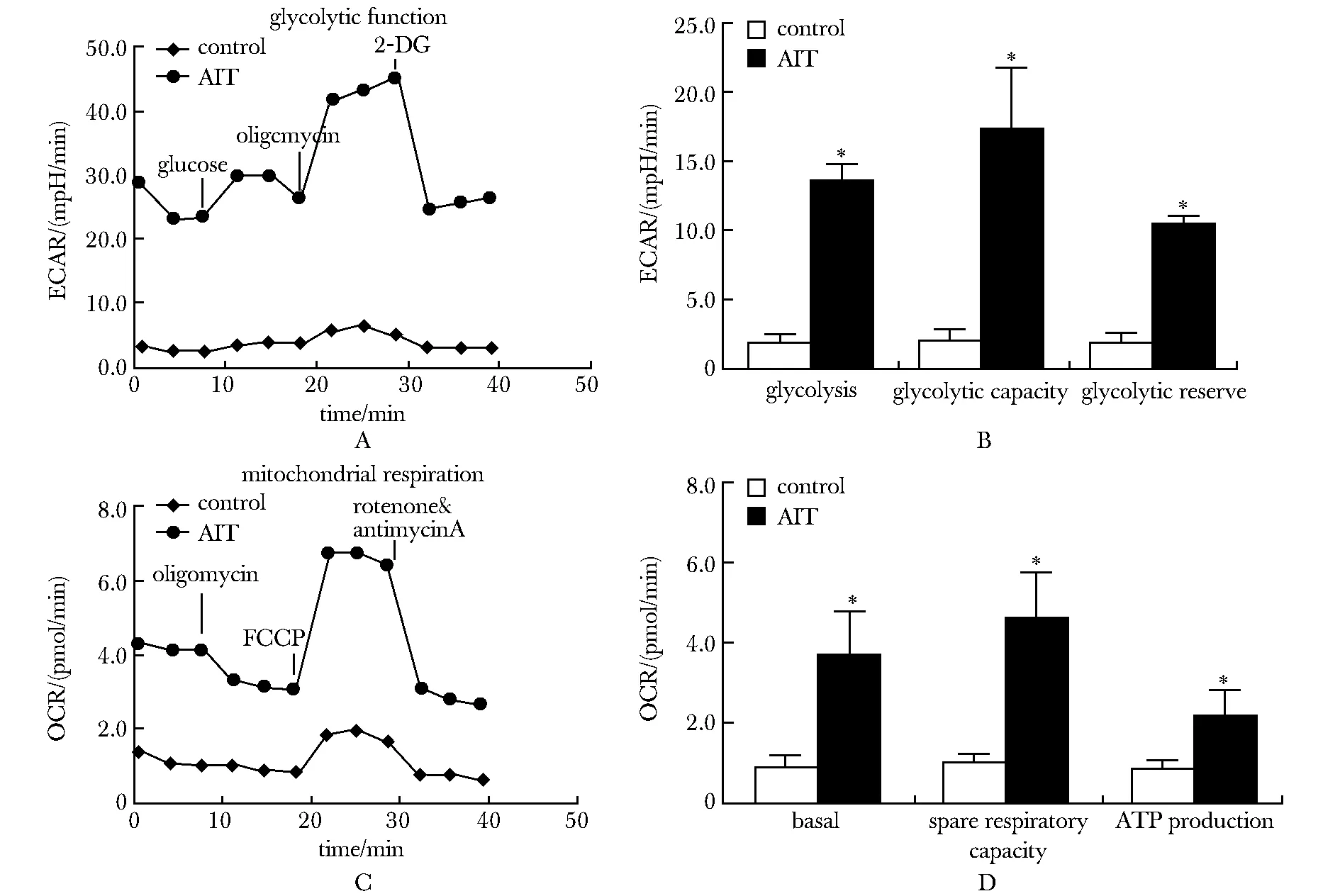
A.changes of ECAR in macrophages;B.statistics of glycolysis,glycolysis capacity and glycolysis reserve of macrophages;C.changes of OCR in macrophages;D.statistics of basal,spare respiratory and ATP production of macrophages;*P<0.05 compared with control group;mpH.pH×10-3图3 巨噬细胞糖酵解及呼吸能力Fig 3 Glycolysis and respiratory capacity of

