地衣芽孢杆菌对仿刺参生长、消化和免疫功能的影响
王旭达,关晓燕,王 鉴,董 颖,蒋经伟,姜 北,李石磊,赵泽龙,陈 仲,高 杉,周遵春
(辽宁省海洋水产科学研究院,辽宁省海洋水产分子生物学重点实验室,辽宁 大连 116023)
仿刺参(Apostichopusjaponicus)属棘皮动物门,是我国重要的近海水产养殖品种[1]。使用抗生素及化学药物来预防仿刺参病害不仅防治效果差,还会造成机体肠道菌群失衡、致病微生物剧增等不良后果[2-3]。将益生菌制剂作为饲料添加剂应用于仿刺参养殖,不仅可以提高其非特异性免疫机能,还能提升仿刺参抗应激及抵抗病害的能力[4-5]。
益生菌制剂是天然的免疫激活剂,可以提高干扰素及巨噬细胞活性,增强机体免疫力及抗病力[6]。同时,益生菌制剂本身含有大量的营养物质,随其在消化道内代谢、繁衍,可产生多种维生素、氨基酸、有机酸等物质,为机体提供营养物质[7]。作为饲料添加剂使用是机体摄入益生菌最为实用、高效的方式[8]。目前,以芽孢杆菌(Bacillus)为主的益生菌制剂受到广泛关注。芽孢杆菌通过发挥生物拮抗作用及产生抗菌物质来抑制其他病原菌的生长,还可以刺激淋巴组织进入免疫准备状态,提高宿主的防御功能,起到增强机体抵抗力、提高饲料转化率的作用[9-10]。其中,地衣芽孢杆菌(B.licheniformis)是近年来益生菌菌株研发的热点。地衣芽孢杆菌易于在机体肠道内萌发生长,对大肠杆菌(Escherichiacoli)、致病性弧菌(Vibrio)具有很强的抑制作用,而对双歧杆菌(Bifidobacterium)、乳酸菌有促进和共生作用[11-12]。由于地衣芽孢杆菌本身易形成孢子,比较适合于添加到饲料中保存[13]。地衣芽孢杆菌进入机体肠道后,其表面抗原或代谢物担当免疫原,不断刺激机体的免疫防御系统,增强机体的非特异性免疫力[14-15]。同时,地衣芽孢杆菌还可以通过营养竞争、空间竞争等方式抑制有害微生物的生长,维持机体肠道的微生态平衡[16]。
笔者以自健康仿刺参肠道中分离筛选得到的地衣芽孢杆菌为研究对象,将其制备成有活性的益生菌制剂并添加到饲料中开展仿刺参饲养试验,以此验证其在仿刺参养殖中的益生作用。综合评定地衣芽孢杆菌对仿刺参的生长指标、消化酶活性及免疫防御因子的影响,通过攻毒试验探究地衣芽孢杆菌对仿刺参抗病力的影响,旨在为地衣芽孢杆菌在仿刺参养殖中的应用提供技术支持及理论依据。
1 材料与方法
1.1 试验材料
试验用仿刺参及饲料由辽宁省海水养殖引育种中心提供。仿刺参单体质量(7.17±0.86) g,于人工育苗池暂养7 d。暂养期间保持充气,水温16~18 ℃,pH 7.9~8.2,盐度29.3~31.1。每日换水后投喂饲料,饲料日投喂量为仿刺参体质量的3%~5%。试验用益生菌株筛选自健康仿刺参肠道内壁,并经16S rDNA同源分析法鉴定为地衣芽孢杆菌。攻毒试验所用病原菌为灿烂弧菌(V.splendidus),分离自患腐皮综合征的仿刺参病灶部位。以上2株菌种均由本实验室分离并保存。
1.2 试验方法
1.2.1 菌株活化及生长曲线测定
将-80 ℃冰箱冻存的地衣芽孢杆菌活化并重悬,将活化后的菌悬液以5%的接种量加入到MSB培养基中,30 ℃,160 r/min振荡培养。每隔3 h取3组平行样,测其波长在660 nm下的光密度值D660 nm,绘制菌株生长曲线。
1.2.2 试验设计
将暂养7 d后的仿刺参随机分配至5个相同规格720 mm×490 mm×380 mm水族箱中,每箱放入200头仿刺参。将菌株培养至对数生长期,4 ℃,12 000 r/min离心10 min,弃上清液,加无菌海水重悬。采用比浊法将菌液与饲料的配比调整为105、107、109、1011cfu/g,将菌液与饲料充分混匀后进行仿刺参投喂试验。试验期间保持充气,饲养条件与暂养期一致。试验共设5个处理组,每组3个平行。分别于试验第0、10、20、30、40 d取样测定仿刺参生长、消化和免疫指标。
1.2.3 仿刺参生长指标的测定
在每个取样时间点测定仿刺参体质量,并计算其质量增加率和特定生长率。质量增加率(wWGR)及特定生长率(RSG)按下式计算:
wWGR/%=(mt-m0)/mt×100%
RSG/%·d-1=(lnmt-lnm0)/t×100%
式中,mt为取样时的仿刺参体质量(g),m0为仿刺参初始体质量(g),t为时间(d)。
1.2.4 仿刺参肠道消化酶活性的测定
在每个取样时间点从每个试验组随机取5头仿刺参,解剖仿刺参取肠组织,于冰盘上剔除肠道内容物及肠系膜,用磷酸缓冲液(pH 7.5)冲洗后用滤纸吸干,以10倍磷酸缓冲液匀浆。匀浆液于4 ℃,3000 r/min离心20 min,上清液即为粗酶液。
采用南京建成科技有限公司测试盒测定仿刺参消化酶活性。胰蛋白活性单位定义:在37 ℃条件下,每毫克蛋白中含有的胰蛋白酶在单位时间1 min内使吸光度变化0.003为1个酶活性单位(U)。脂肪酶活性单位定义:在37 ℃条件下,每毫克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmoL底物为1个酶活性单位(U)。淀粉酶活性单位定义:在37 ℃条件下,每毫克蛋白与底物作用30 min,水解10 mg淀粉为1个酶活性单位(U)。
1.2.5 仿刺参体腔液中免疫指标的测定
在每个取样时间点从每个试验组随机取5头仿刺参,沥水10 min后用无菌注射器从仿刺参腹部抽取体腔液0.5 mL,置于预冷离心管中,合并体腔液。4 ℃,3000 r/min离心20 min,取上清液用于测定免疫酶活性。
采用南京建成科技有限公司测试盒测定仿刺参免疫酶活性。酸性磷酸酶活性单位定义:100 mL上清液在37 ℃与基质反应30 min产生1 mg酚为1个酶活性单位(U)。碱性磷酸酶的活性单位定义:在相同条件下,上清液与基质作用15 min产生1 mg酚为1个酶活性单位(U)。超氧化物歧化酶活性单位定义:每次反应中酶抑制率达50%时所对应的酶量为1个酶活性单位。溶菌酶的活性采用比浊法测定,根据37 ℃下,样品、标准品、蒸馏水与应用酶液反应时的透光度来计算样品中溶菌酶的活性。
1.2.6 地衣芽孢杆菌对仿刺参抵抗灿烂弧菌感染的影响
为验证地衣芽孢杆菌对仿刺参的免疫保护效果,在投喂试验结束后,每组随机选取20头仿刺参用于灿烂弧菌攻毒试验。将活化的灿烂弧菌接种在2216E培养基上,28 ℃培养24 h后用无菌水稀释到一系列密度,通过预试验确定灿烂弧菌对仿刺参的半致死密度为2×107cfu/mL。每头仿刺参经腹腔注射100 μL半致死密度的灿烂弧菌,记录攻毒后各组仿刺参的吐肠率、累积死亡率及相对免疫保护率。攻毒14 d后,从每个试验组随机取5头仿刺参,解剖切取肠组织(长约1 cm),将同组仿刺参肠组织合并后放入组织匀浆机,加入30 mL磷酸缓冲盐液,处理10 min。匀浆液于4 ℃,3000 r/min离心10 min,用无菌生理盐水将上清液稀释10倍,取200 μL涂布至硫代硫酸盐柠檬酸盐胆盐蔗糖弧菌选择性培养基,28 ℃倒置培养,2 d后统计各组仿刺参肠道弧菌数目。吐肠率(RE)、累积死亡率(RCM)及相对免疫保护率(RRPS)按下式计算:
RE/%=ne/n0×100%
RCM/%=(n0-nt)/n0×100%
RRPS/%=1-(dt/d0)×100%
式中,n0为仿刺参试验初始个体数,ne为仿刺参吐肠个体数,nt为仿刺参试验终末存活个体数,dt为攻毒组死亡率,d0为对照组死亡率。
1.3 数据处理
数据用SPSS 19.0软件进行单因素方差分析以及Duncan多重比较,结果以平均值±标准差表示,当P<0.05时差异显著。
2 结果与分析
2.1 地衣芽孢杆菌生长曲线
地衣芽孢杆菌在培养的前6 h为生长延滞期,培养6~18 h时细菌快速繁殖,活菌数增长最快。在培养第18 h时菌液密度达到最大值。培养18 h后地衣芽孢杆菌活菌数增长趋势变缓,进入生长稳定期,细菌生长趋于动态平衡。稳定生长期维持约6 h后,地衣芽孢杆菌自身代谢产生的有害物质阻碍了细菌的繁殖,细菌数开始下降,进入衰亡期(图1)。
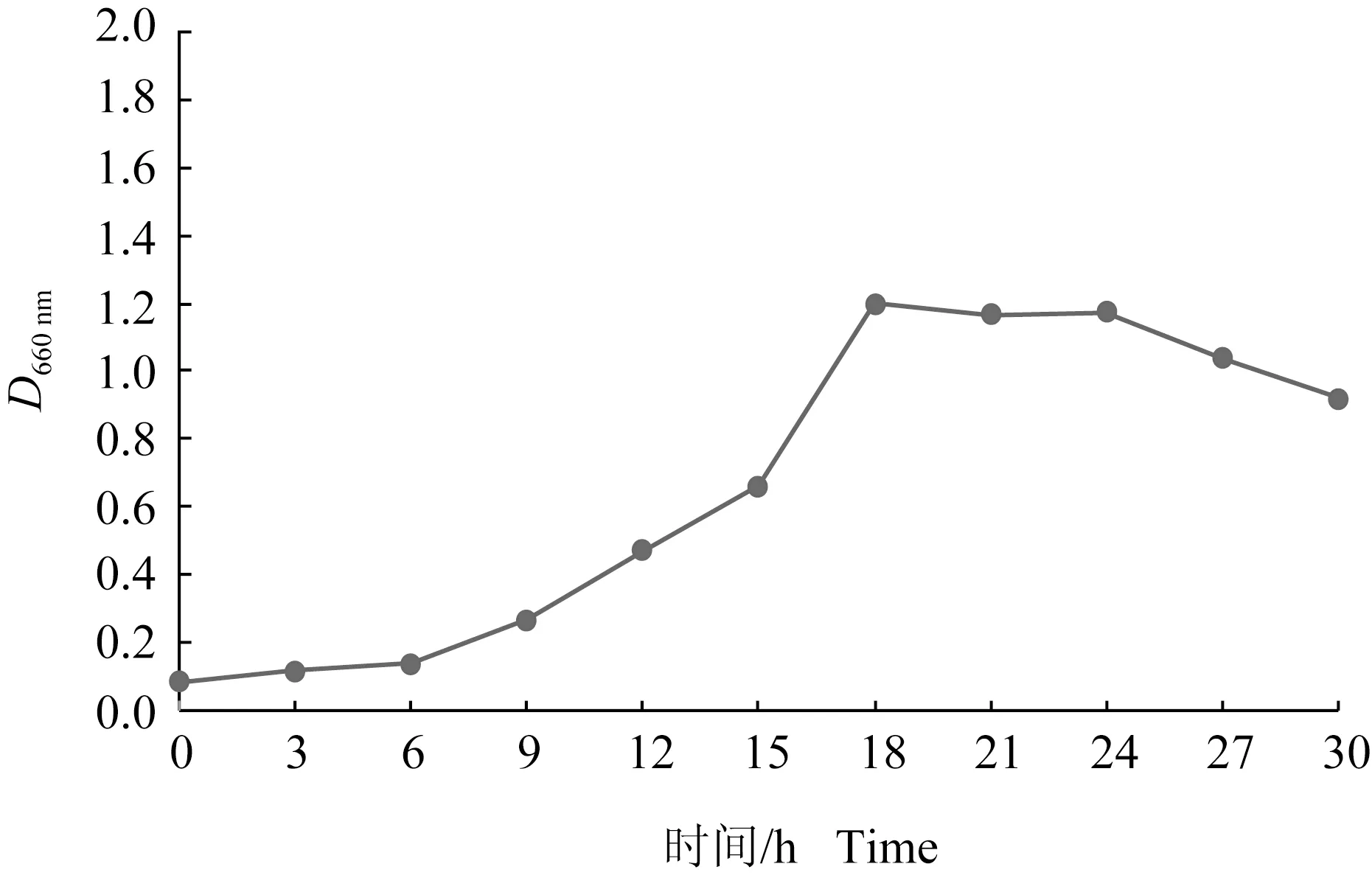
图1 地衣芽孢杆菌生长曲线Fig.1 Growth curves of B.licheniformis
2.2 地衣芽孢杆菌对仿刺参生长的影响
投喂地衣芽孢杆菌前,各试验组群中仿刺参个体平均湿质量差别不大。至试验终止时,各试验组群仿刺参体质量均呈现增长趋势。其中地衣芽孢杆菌密度为109cfu/g的试验组仿刺参的质量增加率及特定生长率相对最高。而地衣芽孢杆菌密度为105、1011cfu/g的试验组仿刺参的质量增加率及特定生长率均低于对照组(表1)。
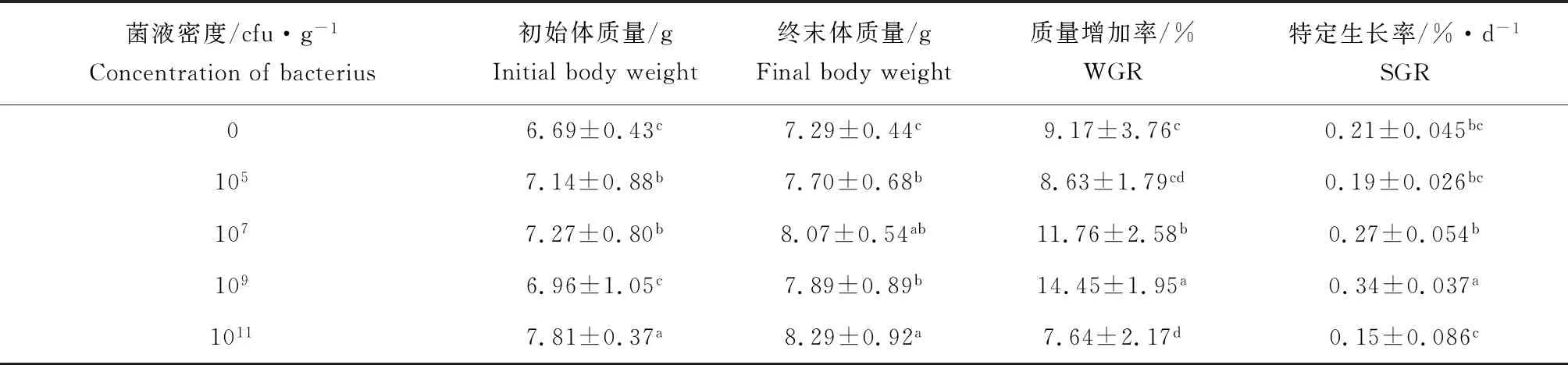
表1 地衣芽孢杆菌对仿刺参质量增加率和特定生长率的影响Tab.1 Effects of B.licheniformis on WGR and SGR of sea cucumber A.japonicus
2.3 地衣芽孢杆菌对仿刺参消化酶活性的影响
不同密度地衣芽孢杆菌对仿刺参肠道消化酶活性的影响见图2。随着投喂时间的延长,各处理组仿刺参的胰蛋白酶活性均逐步增加,而107cfu/g组增加最快(图2a)。在投喂10 d时,105cfu/g组与107cfu/g组的胰蛋白酶活性显著高于对照组(P<0.05)。在投喂20 d后,105cfu/g组的胰蛋白酶活性增长缓慢,而107cfu/g组与109cfu/g组的胰蛋白酶活性显著高于对照组(P<0.05)。随着投喂时间的延长,各处理组仿刺参的脂肪酶活性均逐步增加(图2b)。而107cfu/g组的脂肪酶活性上升更快,显著高于同时期的对照组及试验组(P<0.05)。105、1011cfu/g组及对照组在投喂20 d后,脂肪酶活性增长趋势变缓。与投喂初期的酶活性相比,109cfu/g组的脂肪酶活性在投喂30 d后明显增长(P<0.05)。随着投喂时间的延长,各处理组仿刺参的淀粉酶活性呈现先升后降的趋势(图2c)。在投喂30 d时,各组仿刺参的淀粉酶活性达到最高,而后107cfu/g组和109cfu/g组淀粉酶活性缓慢下降,而105cfu/g组和1011cfu/g组淀粉酶活性下降较快,其中1011cfu/g组的淀粉酶活性低于同一时期的对照组,而107cfu/g组和109cfu/g组的淀粉酶活性与对照组相比均表现出显著差异(P<0.05)。研究结果表明,地衣芽孢杆菌对仿刺参肠道消化酶活性的作用效果与给予剂量、给予时间存在相关性。
2.4 地衣芽孢杆菌对仿刺参免疫酶活性的影响
不同密度地衣芽孢杆菌对仿刺参体腔液免疫酶活性的影响见图3。随着投喂时间的延长,试验组酸性磷酸酶活性均高于对照组(图3a)。在投喂30 d后,107cfu/g组与109cfu/g组的酸性磷酸酶活性显著高于对照组(P<0.05),而105cfu/g组与1011cfu/g组中酸性磷酸酶的活性与对照组相比差异不显著。随着投喂时间的延长,各试验组的碱性磷酸酶活性均逐步增加且高于同时期的对照组(图3b)。其中,109cfu/g组碱性磷酸酶活性升高最多,107cfu/g组次之。二者碱性磷酸酶活性均显著高于同时期的对照组(P<0.05)。试验组与对照组的超氧化物歧化酶活性均呈现先升后降的趋势(图3c)。在投喂30 d时,对照组及各试验组的超氧化物歧化酶活性达到最高。而在投喂30 d后,107cfu/g组与109cfu/g组的超氧化物歧化酶活性显著高于对照组(P<0.05),而105cfu/g组与1011cfu/g组中超氧化物歧化酶的活性与对照组相比差异不显著。随着投喂时间的延长,试验组与对照组的溶菌酶活性均逐步增加(图3d)。在投喂20 d时,107cfu/g组与1011cfu/g组的溶菌酶活性显著高于对照组(P<0.05),而在投喂30 d后,1011cfu/g组的溶菌酶活性增长缓慢,107cfu/g组与109cfu/g组的溶菌酶活性显著高于对照组(P<0.05)。
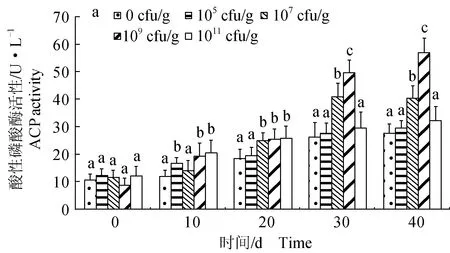
图3 地衣芽孢杆菌对仿刺参酸性磷酸酶(a)、碱性磷酸酶(b)、超氧化物歧化酶(c)和溶菌酶(d)活性的影响Fig.3 Effects of B.licheniformis on activities of ACP(a),AKP(b),SOD(c) and LZM(d) of sea cucumber A.japonicus
2.5 地衣芽孢杆菌对仿刺参抵抗灿烂弧菌感染的影响
注射灿烂弧菌后,试验组与对照组仿刺参均出现不同程度的肿嘴、摇头、吐肠等不良生理反应。1011cfu/g组仿刺参的累积死亡率、吐肠率较高,相对免疫保护率较低。而107cfu/g组仿刺参的累积死亡率和吐肠率相对较低,相对免疫保护率较高(表2)。攻毒试验结果同样表明,107cfu/g组仿刺参肠道的灿烂弧菌数目最少,为0.04 cfu/μL。109cfu/g组次之,灿烂弧菌数为0.07 cfu/μL。二者的灿烂弧菌数目均明显少于对照组和其他处理组(图4)。这表明107cfu/g组的抑菌效果最明显,可以有效提高仿刺参抵抗灿烂弧菌感染的能力。

表2 地衣芽孢杆菌对仿刺参抵抗灿烂弧菌感染的影响Tab.2 Effects of B.licheniformis on disease resistance of sea cucumber A.japonicus against V.splendidus
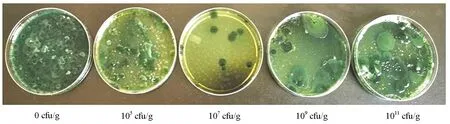
图4 地衣芽孢杆菌对攻毒仿刺参灿烂弧菌的抑制作用Fig.4 Inhibition of B.licheniformis on V.splendidus in infected sea cucumber A.japonicus
3 讨 论
3.1 地衣芽孢杆菌对仿刺参生长状况的影响
质量增加率反映的是一段时间内动物的体质量增加量与初始体质量的关系。质量增加率只考虑终末质量和初始质量,不考虑养殖的时间,能够直观地反映动物质量增加情况和生长情况[17]。特定生长率是指生长率与生长天数的比值,体现单位时间内质量的变化,弱化了初始质量对动物生长的影响,是衡量水生动物生长状况的常用指标[18]。
本试验中,地衣芽孢杆菌过高或过低的添加密度均不利于提高仿刺参的质量增加率及特定生长率,这与韩莎等[19]的研究结果相似。出现这种情况的原因可能是,过低密度的地衣芽孢杆菌影响仿刺参对营养物质的吸收利用,不能有效促进仿刺参生长,而过高密度的地衣芽孢杆菌会引起仿刺参肠道菌群失衡,导致仿刺参出现消化功能紊乱、代谢异常等现象,对仿刺参的健康养成产生不利影响。
3.2 地衣芽孢杆菌对仿刺参消化酶活性的影响
消化酶活性的高低可以反映水生动物消化能力的强弱[20]。通过向饲料中添加益生菌制剂可以提高机体的消化酶活性,进而改善机体对营养物质的消化和吸收。本试验中,在添加地衣芽孢杆菌期间,仿刺参胰蛋白酶和脂肪酶的活力均呈上升趋势,表明仿刺参对地衣芽孢杆菌具有逐渐适应性,这与丁贤等[21]的研究结果相似。说明不同密度地衣芽孢杆菌分泌的消化酶对仿刺参肠道的脂肪酶活性的影响具有选择适应性。随着投喂时间的延长,仿刺参淀粉酶活性出现先升后降的变化规律,这与于明超等[22]的研究结果相似。而当地衣芽孢杆菌的添加密度为1011cfu/g时,其处理组的仿刺参淀粉酶活性低于对照组。出现这种变化趋势的原因可能是过高密度的地衣芽孢杆菌影响到仿刺参肠道原来定殖的土著菌群生长,而地衣芽孢杆菌分泌过量的消化酶对仿刺参自身的淀粉酶产生反向抑制作用,导致淀粉酶活性出现过饱和的现象[19]。
3.3 地衣芽孢杆菌对仿刺参免疫酶活性的影响
仿刺参是无脊椎动物,体内没有特异性的免疫组织,其体腔细胞担负着非特异性免疫的职能[23]。酸性磷酸酶和碱性磷酸酶是仿刺参体腔细胞内参与免疫防御活动的重要水解酶[24]。超氧化物歧化酶可以清除机体内多余的自由基,阻断脂质过氧化作用,修复受损细胞。溶菌酶能够切断细菌细胞壁肽聚糖中的糖苷键,引起细胞裂解,破坏和消除侵入机体内的致病菌[25]。
本试验结果表明,合适密度的地衣芽孢杆菌可以提高仿刺参的酸性磷酸酶、碱性磷酸酶及溶菌酶活性,这与包鹏云等[26-27]的研究结果相似。而在投喂地衣芽孢杆菌期间,仿刺参超氧化物歧化酶活性总体呈现先升后降的趋势,这可能是因为一定时期内过量积累的超氧化物歧化酶造成机体的氧化压力不足,氧化因子缺乏,难以维持正常所需[28]。这表明合适密度的地衣芽孢杆菌在仿刺参体内能够分泌相关非特异性免疫酶或者通过诱导激发的形式提高机体分泌相关酶的能力从而达到清除自由基、提高仿刺参抗氧化能力和免疫能力的目的。而过高剂量的地衣芽孢杆菌可能会引起机体非特异性免疫系统的持续反应而形成免疫抑制,导致相关免疫酶活力下降[29]。
3.4 地衣芽孢杆菌对仿刺参抵抗灿烂弧菌感染的影响
灿烂弧菌是造成仿刺参腐皮综合征病害发生的主要病原菌,对仿刺参养殖危害严重[30]。采用人工攻毒的方法使供试动物感染病原体,以此来反映生态制剂对供试动物的保护效果,能够直接、真实地反映供试动物所获得的免疫抗病能力[31]。周慧慧等[32]通过灿烂弧菌攻毒试验证明,投喂益生菌制剂可以显著提高仿刺参的抗病能力,同时有效降低仿刺参的累积死亡率。王金燕等[33]同样利用攻毒试验证明,芽孢杆菌制剂可以显著提高仿刺参抵抗灿烂弧菌感染的能力。
本试验结果表明,地衣芽孢杆菌的添加密度为107cfu/g时,仿刺参发病的个体数量相对较少,吐肠率和累积死亡率较低,相对免疫保护率较高。同时,仿刺参肠道的灿烂弧菌数目也明显少于其他处理组。这说明合适剂量的地衣芽孢杆菌可以提高仿刺参抵抗灿烂弧菌感染的能力,而过高剂量的地衣芽孢杆菌可能会影响仿刺参肠道原来定殖的土著菌群生长,破坏菌群平衡,使机体产生应激反应,影响仿刺参摄食和消化吸收的效果。
4 结 论
综上所述,该株地衣芽孢杆菌对促进仿刺参生长、提高消化酶活性、增强免疫防御功能具有显著的益生作用。综合各项指标可见,当饲料中地衣芽孢杆菌的密度为107、109cfu/g时,仿刺参的生长性能、消化酶活性、免疫酶活性和抵抗灿烂弧菌的能力得到显著提高。该株地衣芽孢杆菌可以作为一种安全有效的益生菌添加剂应用于仿刺参养殖。

