马氏珠母贝PfAQP4 免疫功能初探
潘肖兰 , 刘惠茹 , 许濛 , 许瀚之 , 张华 何毛贤
1. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广东省应用海洋生物学重点实验室, 中国科学院南海生态环境工程创新研究院, 广东 广州 510301;
2. 中国科学院大学, 北京 100049
水通道蛋白4 (Aquaporin 4, AQP4)是一类参与水运输的膜转运蛋白, 通常以四聚体形式存在, 在渗透压调节中起重要作用(Ho et al, 2009; Pannicke et al, 2010)。AQP4 与多种人类疾病的发生发展有关, 如脑水肿(Papadopoulos et al, 2007)。血脑屏障(Blood-brain Barrier, BBB)破坏后AQP4 大量表达可致脑水肿形成和发展, 该过程伴随着氧化应激水平的增加(Yang et al, 2014)。研究发现基质金属蛋白分解酶(Matrix Metalloproteinase, MMP)可通过降解细胞外基质来增加毛细血管通透性从而促进BBB 的破坏(武柠子 等, 2016), MMP 与AQP4 的表达关系密切, 某些药物可以通过抑制MMP 的表达从而抑制AQP4 的表达来减轻BBB 的破坏, 在小鼠中MMP敲除可直接引起AQP4 表达量下调, AQP4 敲除会导致MMP 表达异常(Zhou et al, 2010; Cao et al, 2016; Pérez-Hernández et al, 2017)。提高超氧化物歧化酶(Superoxide Dismutase, SOD)活力和下调AQP4 的表达可减轻脑水肿症状(Belayev et al, 2012; 王晶 等, 2018)。此外, 在人自身免疫性视神经脊髓炎(NMO)患者的血清中 AQP4 抗体(AQP4-IgG)显著升高, AQP4 肽的刺激可使NMO 患者的T 细胞分泌白细胞介素17 (Interleukin, IL-17)等细胞因子(Nelson et al, 2010; Ulusoy et al, 2012; Wang et al, 2012)。AQP4 基因缺失可抑制或激活重要免疫转录调控因子核因子κB (Nuclear factor kappa B, NF-κB)信号通路, 从而抑制或促进细胞因子的释放(Sun et al, 2016; Dai et al, 2018; Wang et al, 2019; Hua et al, 2020); 若抑制NF-κB 信号通路, 则会导致AQP4 基因的表达受到抑制(Sun et al, 2019)。这些研究表明AQP4 影响多种免疫相关因子的合成和分泌。目前已证实AQP4参与水产动物渗透压调节(高沿, 2016), 但关于其免疫功能还没有报道。
马氏珠母贝(Pinctada fucata martensii)是人工培育海水珍珠的主要母贝, 除了在自然状态下可能会受到病原菌的入侵之外, 用其进行人工育珠的过程中, 经常会观察到插核手术贝因病原菌入侵伤口而死亡的现象, 机体免疫显著影响插核手术贝的成活率(Adzigbli et al, 2019, 2020)。我们前期克隆了马氏珠母贝AQP4 (PfAQP4)并研究了其 在渗透压调节中的功能(潘肖兰 等, 2020), 本文拟探究 PfAQP4 是否具有免疫调节功能, 以期为马氏珠母贝的抗性育种及病害防治等提供参考。
1 材料与方法
1.1 试验材料
试验用约1 龄的马氏珠母贝, 养殖于深圳大鹏澳海区。将试验贝暂养于室内水池中, 水温和盐度等条件与海区一样, 24h 充气, 每天8:00 投喂饵料(亚心形扁藻) 1 次, 14:00 换水1 次。
1.2 免疫刺激试验
根据注射物不同分为脂多糖(Lipopolysaccharide, LPS)组、聚肌胞[Polyinosinic-polycytidylic acid, Poly (I:C)]组和磷酸缓冲盐溶液(phosphate buffer saline, PBS)组(阴性对照) 3 个组, 每组60 只贝。将3 种注射物按试剂说明书分别配置成质量浓度为1μg·μL–1溶液后进行注射, 每只贝注射剂量为100μL。分别于注射后12h、24h、36h、48h 和72h, 从每个组别中随机取9 只贝, 取消化腺和外套膜组织立即置于液氮中保存。每3 只贝的同一组织混合作为1 个生物学重复, 共3 个生物学重复。
1.3 RNA 干扰试验
用美国Promega 公司的T7 RiboMAX™ Express Large Scale RNA Production System 试剂盒进行PfAQP4 dsRNA 的合成, 合成引物见表1。将15 只马氏珠母贝随机分成3 组, 分别是AQP 组、绿色荧光蛋白(GFP)组和PBS-r 组。其中AQP 组为试验组, 注射浓度为4μg·μL–1的PfAQP4 dsRNA 溶液40μL; GFP 是水母特有的一类发光蛋白, 在其他生物体内不存在, 因此不会出现假阳性结果, 故将GFP 组作为阳性对照组, 注射质量浓度为4μg·μL–1的GFP dsRNA 溶液40μL; PBS-r 组作为阴性对照组, 注射40μL 1×PBS。7d 后分别对每只贝的外套膜组织进行固定, 用于RNA 提取。
1.4 总RNA 提取、cDNA 模板合成和实时荧光定量PCR
用Magen 公司通用RNA 提取试剂盒提取组织的总RNA, 用UV-Vis Spectrophotometer Q5000 (QUAWELL)测定RNA 浓度, 1.5%琼脂糖凝胶电泳 检验RNA 质量。用带有去除基因组功能的逆转录试剂盒 ReverTra Ace®qPCR RT Master Mix With gDNA Remover (Toyobo)进行cDNA 第一链合成, 用SYBR®Green Realtime PCR Master Mix (Toyobo)和Light Cycler 480 (Roche, Switzerland), 18S rRNA 为内参基因进行实时荧光定量分析, 每个样品3 个技术重复, 所检测基因的实时荧光定量引物见表1。反应体系为: SYBR®Green Realtime PCR Master Mix 5µL, 双蒸馏水3.4µL, cDNA 模板1µL, 上下游引物各0.3µL, 共10µL。反应程序为: 95℃预变性10min; 95℃ 10s, 56℃ 15s, 72℃ 15s, 45 个循环。2–Ct△法计算相对mRNA 表达量。用SPSS19.0 软件的单因素方差分析法(ANOVA)进行显著性分析, Tukey 法进行进行多组样本间差异显著性分析, 置信区间为95%。数据以均值±标准差(SD)表示, 在p<0.05 时具有统计学意义。用SPSSAU-在线SPSS 分析软件(https://spssau.com/front/spssau/index.html)进行 Pearson相关性分析。

表1 本研究所用的引物序列 Tab. 1 Primers used in this study
2 结果
2.1 免疫刺激后PfAQP4 在外套膜和消化腺组织的表达情况
免疫刺激后PfAQP4 在外套膜中的相对表达情况如图1a。在注射LPS 后12h, PfAQP4 mRNA 相对表达量与对照组(PBS 组)间无显著性差异; 注射LPS 后24h, PfAQP4 mRNA 相对表达量为0.0103, 与PBS 组相比显著升高(p<0.05), 是PBS 组的2.2倍; 注射后36h, PfAQP4 转录表达量降至PBS 组水平。注射Poly(I:C)后12h 和24h, PfAQP4 mRNA 相对表达量与相应时刻PBS 组相比均无显著性差异; 注射后36h 和48h, PfAQP4 mRNA 相对表达量分别为0.0063 和0.0093, 与相应时刻PBS 组相比均显著升高(p<0.05), 分别是PBS 组的2.2 和1.5 倍; 注射后72h, PfAQP4 转录表达量已降至PBS 组水平。
免疫刺激后PfAQP4 在消化腺中的相对表达情况如图1b。注射LPS 后12h, PfAQP4 mRNA 的相对 表达量为0.0009, 与PBS 组相比显著降低(p<0.05), 为PBS 组的0.5 倍; 注射后24h、36h 和48h, PfAQP4的转录表达量与相应时刻PBS 组相比均显著升高(p<0.05), 基因转录表达量分别为0.0041、0.0021 和0.0028, 分别是PBS 组的2.9、2.3 和2.2 倍; 注射后72h, PfAQP4 转录表达量与PBS 组相比已无显著性差异。注射Poly(I:C)后12h、24h 和36h, PfAQP4 mRNA 相对表达量与相应时刻PBS 组相比均无显著性差异; 注射后48h, PfAQP4 mRNA 的相对表达量为0.0027, 与PBS 组相比显著上升(p<0.05), 是PBS组的2.1 倍; 注射后72h 时PfAQP4 转录表达量恢复至PBS 组水平。

图1 3 种免疫刺激引起PfAQP4 mRNA 相对表达量在外套膜(a)和消化腺(b)中的随时间变化情况 *表示同一时刻试验组与对照组有显著差异(p<0.05) Fig. 1 Relative mRNA expression of PfAQP4 in the mantle (a) and digestive gland (b) after immune stimulation. * indicates that the experimental group and control group are significantly different at the same time (p < 0.05)
2.2 RNA 干扰后免疫相关基因在外套膜的表达情况
PfAQP4 RNA 干扰效果及干扰后免疫相关基因的表达情况如图2。AQP 组、PBS-r 组和GFP 组中PfAQP4 mRNA 相对表达量分别为0.003、0.011 和0.015, PfAQP4 转录表达量在试验组与两个对照组间均具有显著性(p<0.05、p<0.01), 基因干扰效率为77%。溶酶体膜相关糖蛋白LAMP 基因在AQP 组、PBS-r 组和GFP 组的mRNA 相对表达量分别为0.01、0.04 和0.18, 其中AQP 组LAMP 转录表达量与GFP组相比显著下降(p<0.05), 与PBS-r 组相比无显著性差异; 核因子κBNF-κB 基因在AQP 组、PBS-r 组和GFP 组的mRNA 相对表达量分别为0.01、0.02 和0.04, AQP 组NF-κB 转录表达量与GFP 组相比显著下降(p<0.01), 与PBS-r 组相比无显著性差异; 铜锌超氧化物歧化酶CuZn-SOD 基因在AQP 组、PBS-r组和GFP 组的mRNA 相对表达量分别为0.02、0.07和0.10, 与两个对照组相比, CuZn-SOD 表达显著下降(p<0.05、p<0.001); 基质金属蛋白分解酶MMP和白细胞介素IL-17 基因的mRNA 相对表达量各组间均无显著性差异。
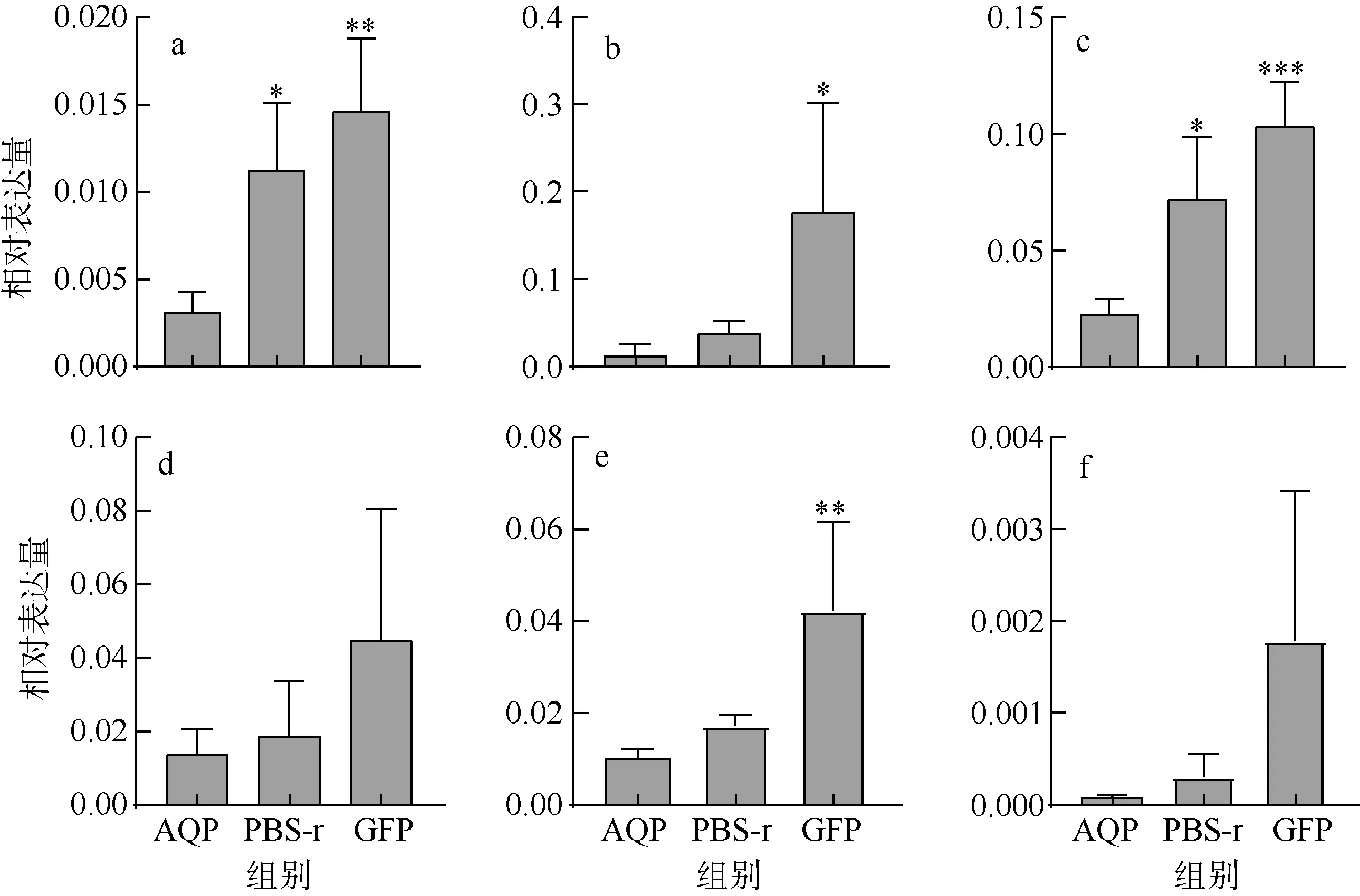
图2 PfAQP4 表达抑制后5 个免疫相关基因在外套膜中的随时间变化情况 a. PfAQP4 mRNA; b. LAMP mRNA; c. CuZn-SOD mRNA; d. MMP mRNA; e. NF-κB mRNA; f. IL-17 mRNA。*表示对照组与AQP 组差异显著(p<0.05), **表示p<0.01, ***表示p<0.001 Fig. 2 Relative mRNA expression of 5 immune-related genes in the mantle after inhibition of PfAQP4 expression. * Indicates significant difference between the control group and AQP group (p < 0.05), ** indicates p < 0.01, and *** indicates p < 0.001
将AQP 组、PBS-r 组和GFP 组的PfAQP4 基因转录表达量与LAMP、NF-κB、CuZn-SOD、MMP 和IL-17 基因的转录表达量进行Pearson 相关性分析(表2)。结果发现: 在5 个免疫相关基因中, CuZn-SOD、LAMP 和NF-κB 基因与PfAQP4 基因的相关系数分别为 0.818 (p<0.001)、0.674 (p<0.01)和 0.655 (p<0.05), 这3 个基因与PfAQP4 基因表现出显著正相关性; IL-17 基因与PfAQP4 基因的相关系数为0.515, 无显著相关性; MMP 基因与PfAQP4 基因的相关系数仅为0.356, 两者也无显著相关性。
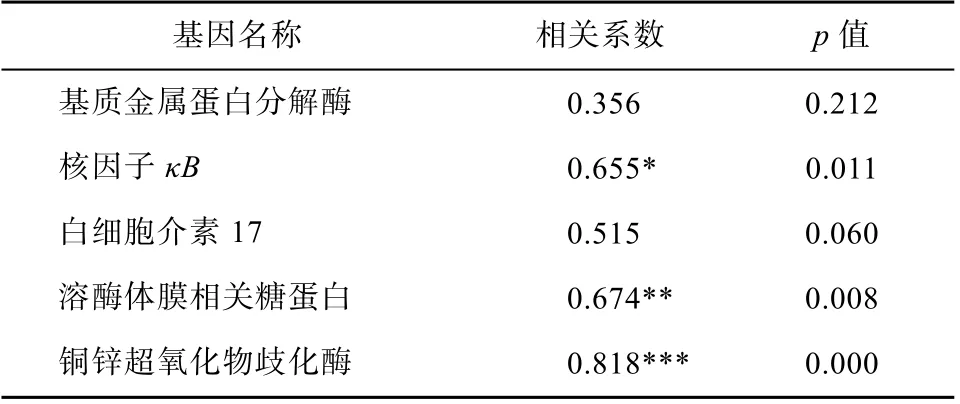
表2 RNA 干扰后PfAQP4 与免疫相关基因mRNA 表达量的相关性分析 Tab. 2 Correlation analysis of mRNA expression between PfAQP4 and immune-related genes in the mantle after RNA interference
3 讨论
自1994 年AQP4 在人脑中被发现以来, 其在高等脊椎动物中的免疫调节功能已被广泛认知, 该基因的表达变化涉及免疫相关通路的激活和抑制, 与多种免疫相关因子的表达变化有关。本研究分析了免疫刺激后PfAQP4 mRNA 相对表达量的改变以及PfAQP4 RNA 干扰后免疫相关基因的表达变化, 研究结果表明PfAQP4 参与马氏珠母贝免疫应答。LPS是革兰氏阴性细菌细胞壁外壁的组成成分, 通常被用来模拟细菌感染, Poly(I:C)是一种人工合成的双链RNA 类似物, 通常被用来模拟病毒感染(孙乐 等, 2016; Liu et al, 2018)。在马氏珠母贝中, 消化腺和外套膜都是重要的免疫器官(Zhang et al, 2018)。本试验结果显示注射LPS 和Poly(I:C)后, PfAQP4 基因的表达在外套膜和消化腺中均出现显著变化, 说明该基因参与马氏珠母贝因LPS 和Poly(I:C)刺激引起的免疫应答。在消化腺中, LPS 注射后24h 开始出现PfAQP4 mRNA 表达量的显著上调, 而Poly(I:C)注射后出现PfAQP4 mRNA 表达量显著上调的时间为48h, 说明在消化腺中PfAQP4 响应LPS 刺激比响应Poly(I:C)刺激早。同样, 在外套膜中, LPS 注射后24h 开始出现PfAQP4 mRNA 表达量的显著上调, 而Poly(I:C)注射后PfAQP4 mRNA 表达量的显著上调在36h 才观察到, 也说明了PfAQP4 对LPS 诱导的免疫反应更为敏感。在本试验中, PfAQP4 在消化腺中的表达在LPS 刺激后12h 显著下降, 该现象在外套膜中没有观察到, 这可能是由于不同组织的功能特异性, 对免疫刺激信号做出的响应存在差异。消化腺是海洋软体动物的主要免疫组织已得到了广泛的认知。最近研究报道, 外套膜也作为重要的免疫器官参与马氏珠母贝的免疫防御(Zhang et al, 2018)。马氏珠母贝作为海水珍珠培育的主要母贝, 在进行插核手术后外套膜小片增生形成珍珠囊, 此过程历经免疫识别、珍珠囊细胞分泌珍珠质包裹珠核形成珍珠。因此, 对于马氏珠母贝来说, 外套膜免疫显得尤为重要(Zhao et al, 2012)。本试验分析了PfAQP4 RNA 干扰后外套膜免疫相关基因的表达变化, 以此来说明PfAQP4 与免疫相关基因之间的关系。PfAQP4 RNA 抑制后外套膜免疫相关基因(LAMP、CuZn-SOD、NF-κB、MMP 和IL-17)中除CuZn-SOD 基因在PfAQP4 注射组出现显著下降外, 其他4 个基因(MMP、NF-κB、IL-17、LAMP)与对照组相比无显著变化, 说明在马氏珠母贝中, PfAQP4对这4 个免疫相关基因的调节作用较小。Pearson 相关性分析发现PfAQP4 和CuZn-SOD 相关系数为0.818 (p<0.001), 抑制PfAQP4 的表达可显著抑制CuZn-SOD 的表达, 说明PfAQP4 和CuZn-SOD 位于同一条信号通路中。鉴于CuZn-SOD 最主要的功能是参与机体氧化应激, 是重要的免疫相关基因(袁牧 等, 2016), 说明PfAQP4 可能与CuZn-SOD 共同在免疫调节网络中发挥重要作用。在水产动物中, CuZn-SOD 在文蛤(Meretrix meretrix)(朱丹 等, 2010)、菲律宾蛤仔(Venerupis philippinarum)(Li et al, 2010)、锯缘青蟹(Scylla serrata)(Lin et al, 2008)、皱纹盘鲍(Haliotis discus discus)(Kim et al, 2007)、栉孔扇贝(Chlamys farreri)(Ni et al, 2007)、海湾扇贝(Argopecten irradians)(Bao et al, 2009)等中均被发现与所研究物种的免疫应答有关, 该基因可在短时间内诱导免疫系统, 是一种急性期蛋白。本研究结果表明, 在马氏珠母贝中PfAQP4 可调节CuZn-SOD 参与免疫应答。
本研究首次发现 PfAQP4 基因响应 LPS 和Poly(I:C)的免疫刺激。干扰PfAQP4 基因表达可导致CuZn-SOD 基因表达量出现显著下降, 两者具有较高的正相关性, 说明PfAQP4 可调节CuZn-SOD 基因的表达。鉴于CuZn-SOD 是一个公认的免疫调节因子, 故推测PfAQP4 可能通过调节CuZn-SOD 从而参与马氏珠母贝的免疫应答。但 PfAQP4 如何调节CuZn-SOD 还需更深入的试验研究。

