康替唑胺体外抗菌作用研究
朱德妹,叶信予,胡付品,吴 湜,郭 燕,吴培澄
近年来快速发展的细菌耐药性已为医学界广泛关注[1-3]。细菌耐药性日趋严峻,尤其是甲氧西林耐药的金黄色葡萄球菌(金葡菌)(MRSA)和凝固酶阴性葡萄球菌(MRCNS)、青霉素耐药的肺炎链球菌(PRSP)、万古霉素耐药的肠球菌(VRE)以及MRSA中对万古霉素敏感性下降的万古霉素中介金葡菌(VISA)和万古霉素耐药金葡菌(VRSA)等,使感染性疾病的治疗和控制面临着严峻的挑战[4]。唑烷酮类抗菌药物是新型化学全合成抗菌药物[5-7]。该类药物具有独特的抗菌作用机制,与现有的抗菌药物无交叉耐药。其抗菌谱包括了上述耐药革兰阳性菌的主要病原菌。其中已获美国FDA批准上市的利奈唑胺,为唑烷酮类的第一个新药[8]。该药自2000年上市至今在治疗MRSA、VRE等上述多重耐药革兰阳性菌所致的医院和社区获得性感染以及复杂性皮肤或皮肤软组织感染中发挥了重要的作用。康替唑胺是盟科医药技术(上海)有限公司新研发的唑烷酮类抗菌新药[5]。初期研究发现康替唑胺具有显著的体外和体内抗革兰阳性球菌的作用[5,9]。临床前研究显示康替唑胺虽与利奈唑胺属同类抗菌药物,其毒性靶器官与利奈唑胺相似,但对骨髓抑制毒性等显著低于利奈唑胺[5,10]。目前该抗菌药物已完成临床药理学等Ⅰ期临床研究以及Ⅱ期和Ⅲ期的多中心临床试验,结果显示康替唑胺对临床常见革兰阳性菌所致感染具有良好的临床疗效。现将前期已经完成的该药体外药效学研究结果报道如下。
1 材料与方法
1.1 材料
1.1.1 受试菌 收集2007—2008年浙江、新疆、上海、北京等省市19所医院临床分离菌共1 382株,均经本研究所相应的API菌种鉴定系统重新鉴定确认。质控菌为金葡菌ATCC 29213(MSSA)、ATCC 43300(MRSA),粪 肠 球 菌ATCC 29212(VSE)、ATCC 51299(VRE),屎 肠 球 菌ATCC 35667(VRE),肺炎链球菌ATCC 49619(青霉素中介肺炎链球菌,PISP),大肠埃希菌ATCC 25922,铜绿假单胞菌ATCC 27853,流感嗜血杆菌ATCC 49247、ATCC 49766,脆弱拟杆菌ATCC 25282。
1.1.2 抗菌药物标准品和对照品 康替唑胺由盟科医药技术(上海)有限公司提供,利奈唑胺注射液为辉瑞制药有限公司产品,亚胺培南-西司他丁为美国默沙东制药公司产品,甲硝唑为Sigma公司参比药品,万古霉素等其他受试对照抗菌药物均为中国食品药品检定研究院参比品。
1.1.3 药敏试验培养基 药敏试验采用的Meuller-Hinton (MH)琼脂、Haemophilus test medium base(HTMB)及SR158添加剂、淋球菌GC培养基及L53生长补充专用培养基、GAM培养基均为英国OXOID公司产品。阳离子调节MH肉汤(CAMHB)为BBL公司产品。
1.2 方法
1.2.1 康替唑胺药敏试验 按美国临床和实验室标准化协会(CLSI)[11]推荐,采用琼脂对倍稀释法测定抗菌药物对临床分离菌的最低抑菌浓度(MIC)。
1.2.2 康替唑胺最低杀菌浓度(MBC)和杀菌曲线 MBC定义为杀灭99.9%接种菌量的最低药物浓度。按Amsterdam等[12]2005年描述的方法测定康替唑胺对180株临床分离革兰阳性菌的MBC;并对临床分离MSSA、MRSA、粪肠球菌、肺炎链球菌以及质控菌株共11株细菌以1/2、1、2、4和8倍MIC浓度的康替唑胺进行杀菌曲线研究;以利奈唑胺和万古霉素作为对照药,设置不加药的105CFU/mL菌液同步培养作为对照。
1.2.3 康替唑胺抗菌药物后效应(PAE) 按Craig等[13]1996年描述的抗生素离心去除法测定康替唑胺对临床分离MSSA、MRSA、PRSP、青霉素敏感肺炎链球菌(PSSP)各1株和金葡菌ATCC 29213、肺炎链球菌ATCC 49619标准菌株共6株革兰阳性球菌的PAE。以不加药的105CFU/mL菌液同步培养作为空白对照。观察对照(C)和药物处理(T)后细菌恢复生长1 lgCFU/mL所需的时间,并按PAE = T-C公式,计算PAE值。
1.2.4 培养条件对康替唑胺体外抗菌活性的影响 按Amsterdam等[12]2005年推荐的肉汤微量稀释法测定不同培养条件下康替唑胺对80株临床分离菌体外抗菌活性影响,包括不同pH(pH 5、pH 7、pH 9)的培养基、不同接种菌量(103CFU/mL、105CFU/mL、107CFU/mL)、不同血清蛋白浓度(25%、50%、75%)、含不同离子浓度的培养基和不同品牌药敏试验培养基的影响,以105CFU/mL的接种菌量、pH 7和不含血清蛋白的CAMHB肉汤为质控对照。
1.2.5 药敏结果的判断标准和资料统计 采用SPSS 20.0统计软件进行药敏资料的统计,并按CLSI 2009年M100-S19的标准[14]判断需氧菌对抗菌药物的药敏结果。
2 结果
2.1 康替唑胺的体外抗菌作用
康替唑胺对所有受试革兰阳性菌均显示了高度的抗菌活性,该药的MIC90均≤1 mg/L,包括甲氧西林耐药葡萄球菌(MRS)、青霉素不敏感肺炎链球菌(PISP和PRSP)和VRE,见表1。

表1 康替唑胺与相关抗菌药物对临床重要分离菌的药敏结果Table 1 In vitro activities of contezolid and comparative antimicrobial agents against clinical isolates
康替唑胺对甲氧西林耐药和敏感的葡萄球菌(MRSA、MSSA、MRSE、MSSE)、溶血葡萄球菌、其他凝固酶阴性葡萄球菌以及不产青霉素酶葡萄球菌的MIC90值均为0.5 mg/L(腐生葡萄球菌为1 mg/L除外),其抗菌活性略高于利奈唑胺(MIC90值=1 mg/L)、亦略高于替考拉宁和万古霉素(表1、图1)。康 替 唑 胺 对PSSP、PISP和PRSP的MIC90均为0.5 mg/L,对β溶血链球菌和分离自血液等无菌体液的草绿色链球菌MIC90均为1 mg/L,与利奈唑胺的MIC90值基本一致,抗菌活性亦相仿,但略低于万古霉素和替考拉宁。康替唑胺对万古霉素敏感粪肠球菌、屎肠球菌和其他肠球菌的MIC90均为1 mg/L,其抗菌作用与利奈唑胺和万古霉素相仿、但略低于替考拉宁,并明显优于其他各类受试药;对于万古霉素耐药屎肠球菌的抗菌活性(MIC901 mg/L)则明显高于万古霉素和替考拉宁(MIC90≥128 mg/L),与利奈唑胺相仿。康替唑胺对棒状杆菌属细菌的抗菌作用与利奈唑胺、万古霉素和替考拉宁相仿。见表1。

表1 (续)Table 1(continued)

表1 (续)Table 1(continued)
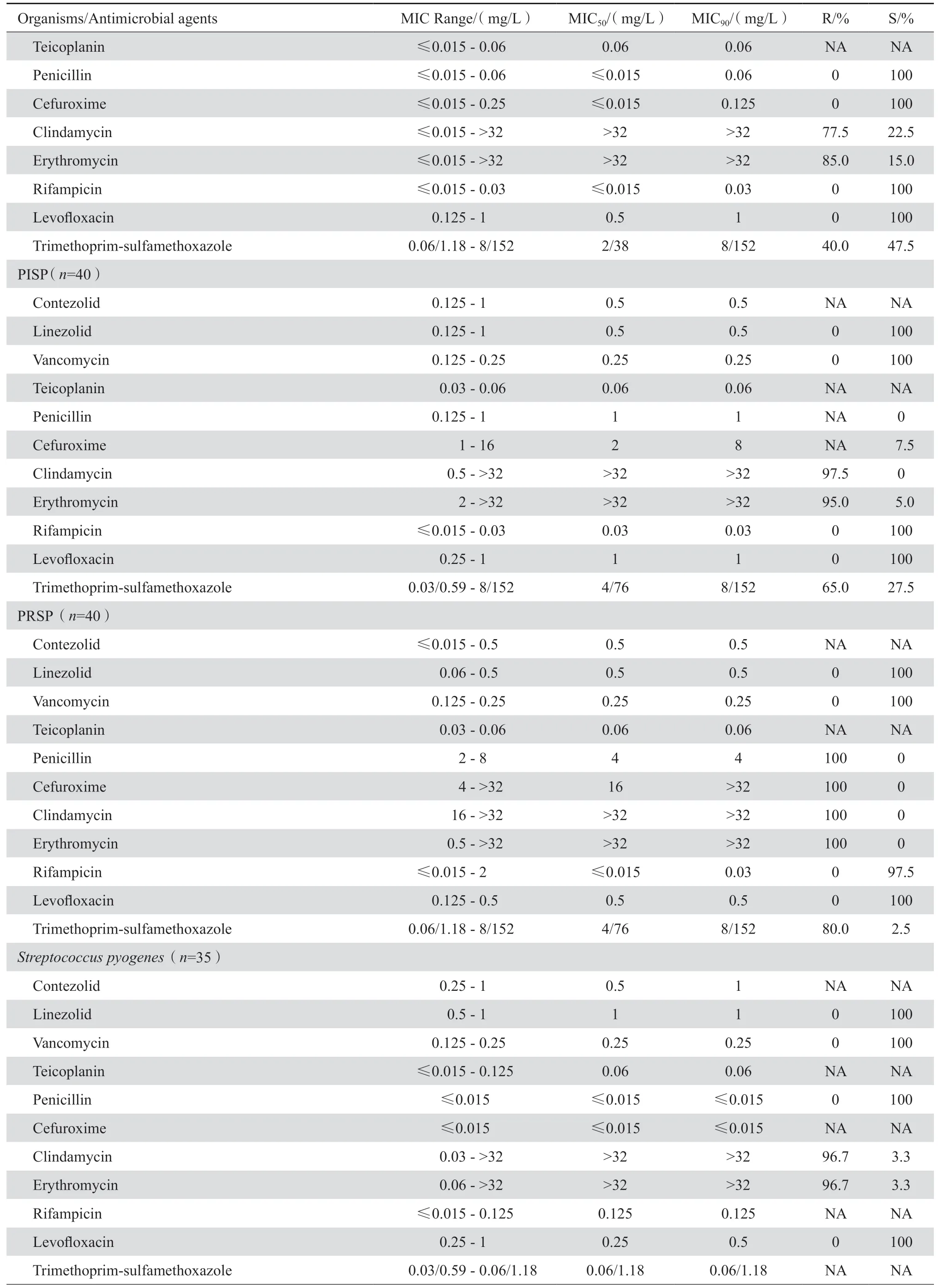
表1 (续)Table 1(continued)

表1 (续)Table 1(continued)
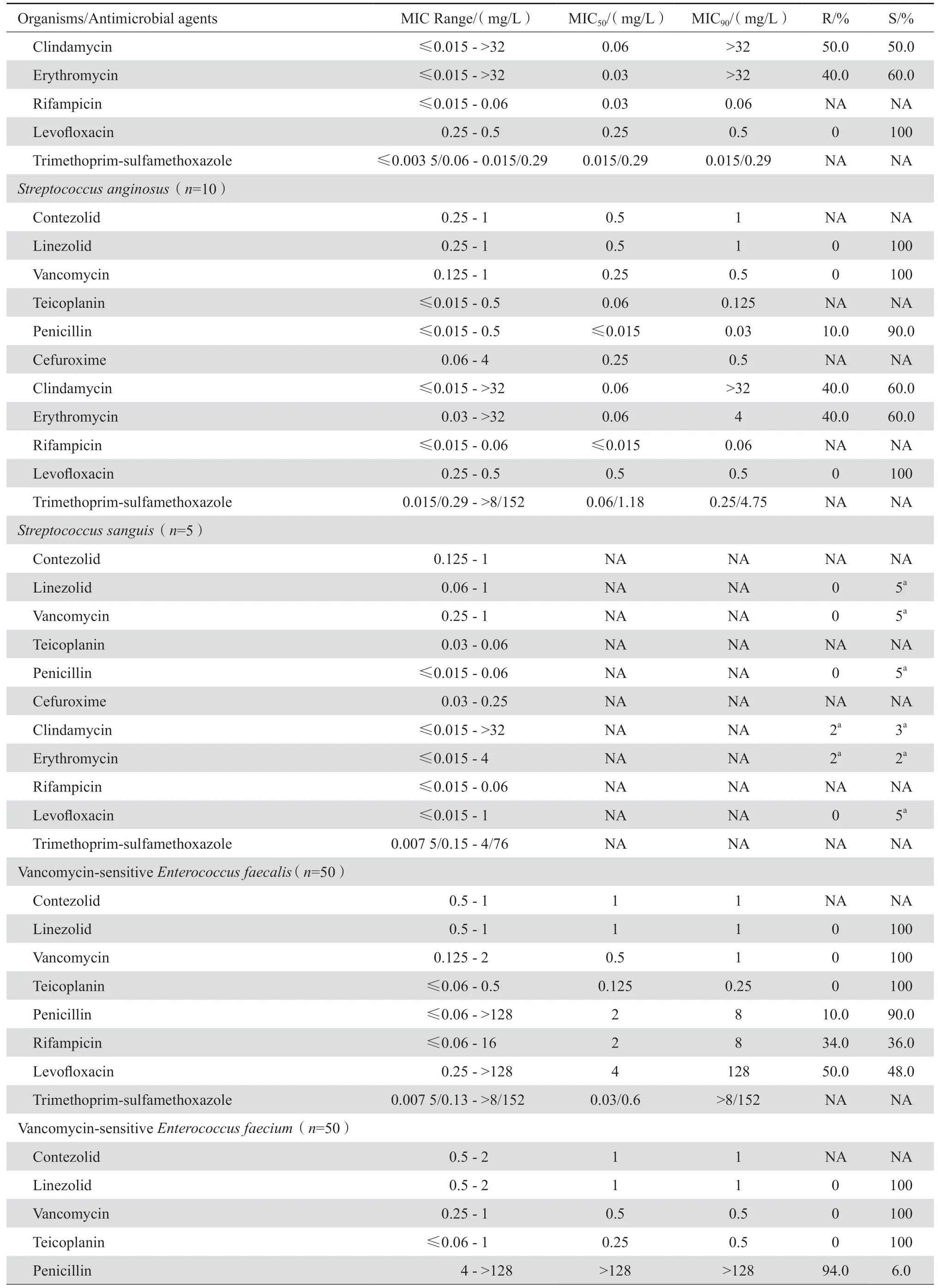
表1 (续)Table 1(continued)

表1 (续)Table 1(continued)
康替唑胺对所有受试的革兰阴性菌的抗菌作用均差,包括受试的肠杆菌科细菌300株和不发酵糖革兰阴性菌120株,其MIC50和MIC90均大于128 mg/L。其对淋病奈瑟菌20株和流感嗜血杆菌80株的抗菌活性亦低,MIC90均分别为16 mg/L和>32 mg/L;但对卡他莫拉菌有一定的抗菌活性(MIC904 mg/L)。见表1。

表1 (续)Table 1(continued)
康替唑胺对受试的拟杆菌属细菌、艰难梭菌和消化链球菌等厌氧菌有一定的抗菌作用。见表1。
康替唑胺对肺炎支原体和解脲脲原体等非典型病原体60株的抗微生物作用亦差,MIC90均>32 mg/L。
2.2 康替唑胺的MBC和杀菌曲线
2.2.1 康替唑胺MBC 康替唑胺对180 株临床分离革兰阳性菌MBC 测定结果显示对55% (33 /60)肺 炎 链 球 菌 的MBC为2~4倍MIC,对PSSP、PISP和PRSP肺炎链球菌的MBC90/MIC90均为8;但对其他受试革兰阳性菌的MBC90/MIC90>8。见表2。对照药物利奈唑胺对上述受试菌株在相同实验条件下,对肺炎链球菌PSSP、PISP和PRSP各20株的MBC90/MIC90均为4~8;对其他革兰阳性菌的MBC90/MIC90亦均>8;显示康替唑胺的杀菌活性与利奈唑胺相仿。

图1 康替唑胺和利奈唑胺对葡萄球菌的抗菌活性Figure 1 Activities of contezolid and linezolid against clinical isolates of Staphylococcus
2.2.2 康替唑胺杀菌曲线 康替唑胺对受试革兰阳性菌的杀菌率及杀菌曲线见图2,其4倍和8倍MIC浓度时均可对临床分离的PSSP(07-W3-64)在(t+8)h达到99.9%杀菌率;对临床分离PRSP(08-W19-36)则分别在(t+24)h和(t+10)h 达到99.9%的杀菌率;而对PISP(ATCC 49619)均在(t+24)h达到99.9%的杀菌率。对临床分离的MSSA(08-W8-36)和MRSA(08-W10-50)(图3)各1株,康替唑胺于4倍MIC时均可在24 h达99.9%的杀菌率,8倍MIC时分别在10 h和24 h达99.9%的杀菌率;但对受试的另1株MRSA(08-W9-88)和金葡菌标准菌株ATCC 29213在所试验的浓度内均未达到99.9%的杀菌率。对临床分离的粪肠球菌、屎肠球菌、万古霉素耐药屎肠球菌各1株和粪肠球菌ATCC 29212的杀菌曲线显示均未达99.9%的杀菌率。

表2 康替唑胺对180株临床分离菌的MIC和MBC值Table 2 Minimum inhibitory concentration and minimum bactericidal concentration of contezolid against 180 clinical isolates
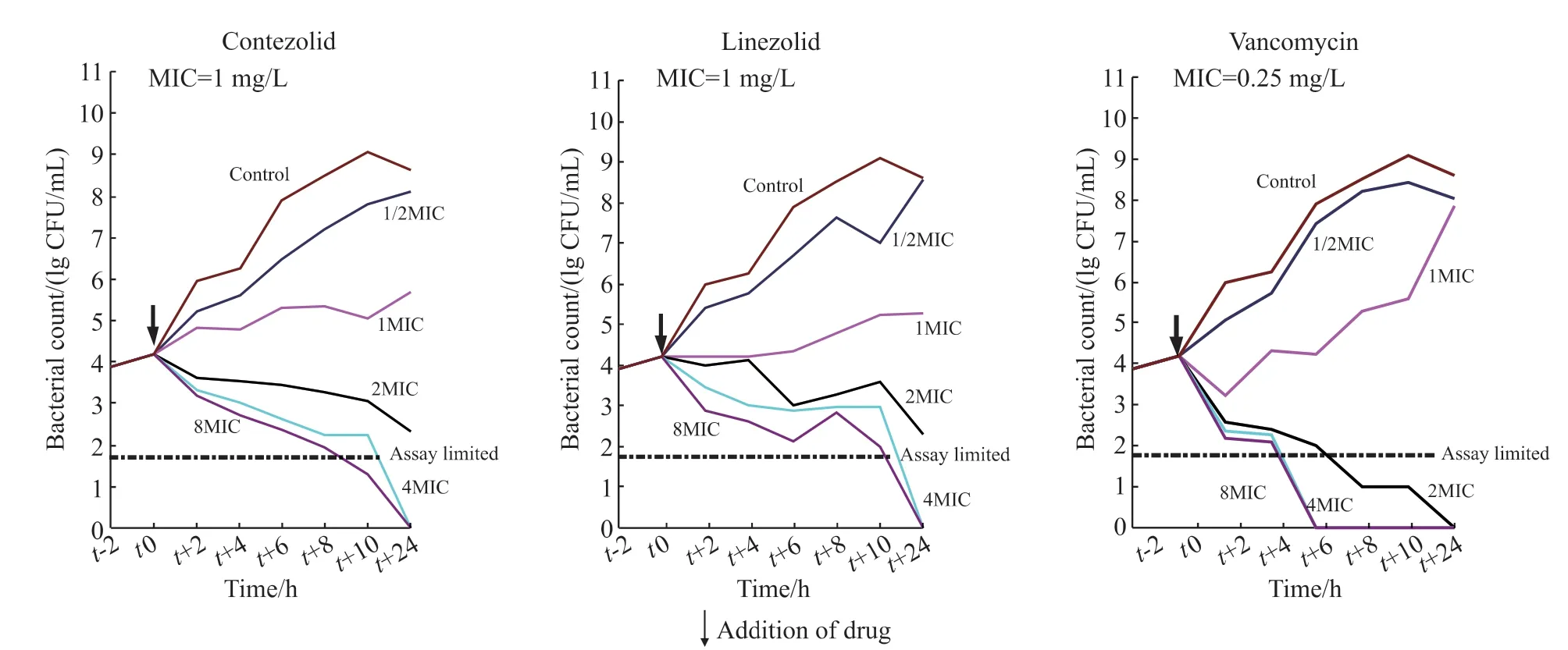
图2 康替唑胺、利奈唑胺和万古霉素对青霉素敏感肺炎链球菌07-W3-64的时间杀菌曲线Figures 2 Time-kill curves of contezolid, linezolid, and vancomycin against PSSP 07-W3-64

图3 康替唑胺、利奈唑胺和万古霉素对MRSA 08-W10-50的时间杀菌曲线Figures 3 Time-kill curves of contezolid, linezolid, and vancomycin against MRSA 08-W10-50
2.3 康替唑胺PAE
康替唑胺对临床分离金葡菌和肺炎链球菌各3株的PAE测定结果显示均有较明显的PAE。当康替唑胺药物浓度为2倍MIC时,对肺炎链球菌PAE的均值为(0.87±0.24)h,当浓度升至4倍和8倍MIC时,康替唑胺对肺炎链球菌的PAE均值分别 延长至(1.60±0.49) h和(2.84±0.82) h。同样,当康替唑胺浓度为2倍MIC时,对金葡菌的PAE为(1.23±0.25) h,当浓度升至4倍和8倍MIC时PAE的均值分别延长至(1.68±0.28) h和(1.78±0.52)h。总体而言,随着康替唑胺浓度的升高,PAE时间亦随之延长;浓度越高,PAE则越长。康替唑胺对金葡菌的PAE范围为0.9~2.4 h,均值为(1.56±0.42)h;对肺炎链球菌的PAE范围为0.5~3.95 h,均值为(1.77±0.99)h。
2.4 培养条件对康替唑胺抗菌活性的影响
细菌接种菌量(包括MSSA、MRSA、PSSP、PISP、PRSP、化脓链球菌、粪肠球菌和屎肠球菌在内的80株临床分离革兰阳性菌)对康替唑胺MIC影响试验测定结果见表3,103CFU/mL接种量时康替唑胺的MIC90值分别是接种量105CFU/mL值的0.5~1倍;接种量增加至107CFU/mL时康替唑胺的MIC50和MIC90值有显著增高,均为105CFU/mL时MIC50和MIC90值的8~16倍。
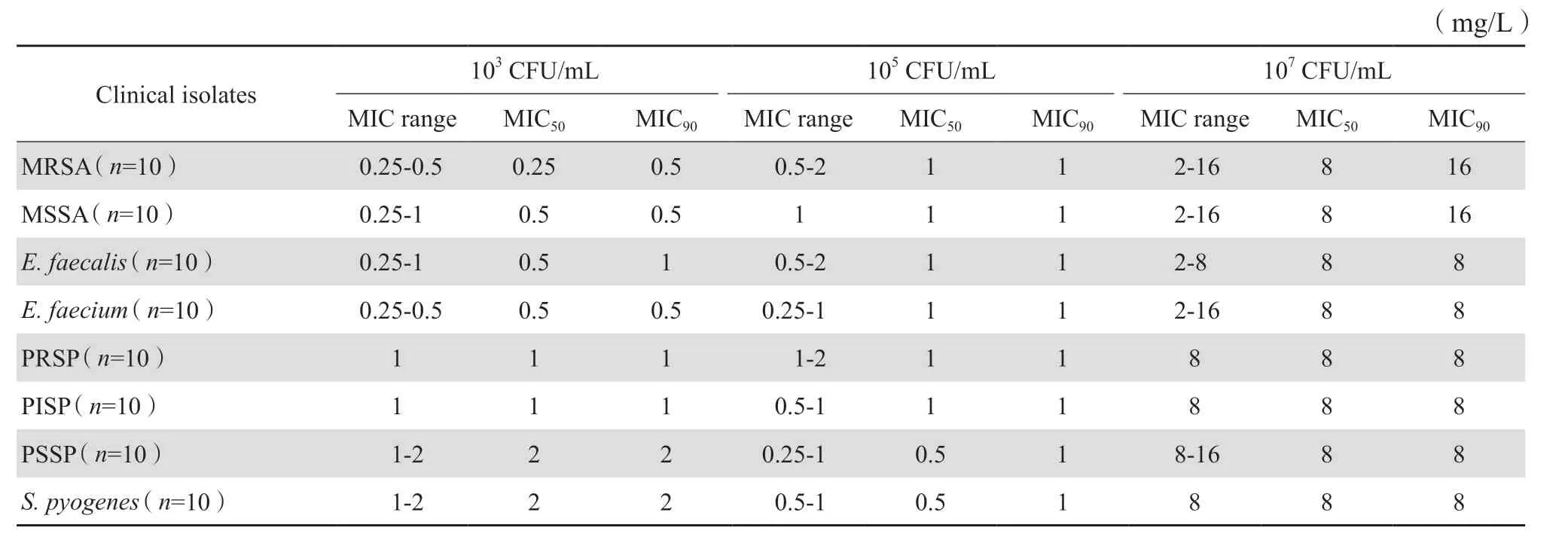
表3 不同接种菌量对康替唑胺抗菌活性的影响Table 3 Effect of inoculum size on antimicrobial activity of contezolid and linezolid
采用pH 5、pH 7和pH 9三种CAMHB培养基对上述80株临床分离革兰阳性菌测定康替唑胺的MIC,结果三种培养基获得的MIC50和MIC90值基本一致。见表4。

表4 不同pH对康替唑胺抗菌活性的影响Table 4 Effect of pH values of culture media on antimicrobial activity of contezolid and linezolid
采用含25%、50%和75%不同人血清蛋白浓度的CAMHB培养基对上述80株临床分离革兰阳性菌测定康替唑胺MIC,结果显示与不含血清蛋白的CAMHB培养基时获得的MIC90值相比,25%和50%血清蛋白浓度时,康替唑胺的MIC90值变化不明显;当血清蛋白浓度增加至75%时,康替唑胺对部分细菌的MIC90值有升高,为不含血清蛋白CAMHB培养基时的2~4倍。见表5。

表5 不同血清蛋白浓度对康替唑胺抗菌活性的影响Table 5 Effect of serum concentration on antimicrobial activity of contezolid
含不同钙、镁离子浓度的培养基以及不同品牌的药敏培养基测定康替唑胺对细菌MIC的结果显示MIC50和MIC90值大致相仿。
3 讨论
本组资料显示康替唑胺对甲氧西林耐药葡萄球菌(MRSA、MRSE和MRCNS)、青霉素不敏感肺炎链球菌(PISP和PRSP)和VRE等具有多种耐药机制的临床重要革兰阳性球菌及其敏感菌株均显示高度的抗菌活性。值得注意的是康替唑胺对受试金葡菌中MSSA和MRSA的MIC90值均为0.5 mg/L,均较利奈唑胺(1 mg/L)低,提示其对金葡菌的抗菌活性略高于利奈唑胺,亦包括凝固酶阴性葡萄球菌。康替唑胺对其他受试革兰阳性菌MIC90值均与利奈唑胺MIC90值相仿,提示与利奈唑胺一样具有相同的抗革兰阳性球菌的活性。1 mg/L的康替唑胺可100%抑制上述所有受试的各类敏感和耐药的革兰阳性球菌的生长。与其他受试抗菌药物体外抗菌作用相比,康替唑胺与利奈唑胺一样,与目前临床沿用的抗革兰阳性菌的抗菌药物无交叉耐药,与文献报道一致[5-6,15]。本组资料显示康替唑胺对半数以上肺炎链球菌(55%,33/60)的MBC为2~4倍MIC,杀菌曲线显示4倍MIC浓度的康替唑胺均可在8~24 h内对3株受试肺炎链球菌(PSSP、PISP和PRSP)达99.9%的杀菌率,显示其具有良好的杀菌作用。康替唑胺虽对40株金葡萄中个别菌株的MBC/MIC≤4MIC;但是95%菌株(38/40)的MBC90/MIC90≥8MIC,抑或甚达256 mg/L;对4株受试菌株的杀菌曲线结果显示对其中2株金葡菌在4MIC(24 h)和8MIC(分别在10 h和24 h)浓度时可达99.9%的杀菌率(图3);但对其他2株受试金葡菌直至24 h均未能达到99.9%的杀菌率,此提示康替唑胺对某些金葡菌具杀菌作用,但对某些金葡菌的杀菌作用较为微弱。值得注意的是康替唑胺对肠球菌的MBC和杀菌曲线均显示无一株细菌的康替唑胺MBC90/MIC90≤4MIC以下,亦无一株细菌的康替唑胺的杀菌曲线显示杀菌率达99.9%,提示康替唑胺对肠球菌系抑菌剂作用。本组资料显示康替唑胺对上述肺炎链球菌、金葡菌和肠球菌等的杀菌曲线和MBC的测定结果均与对照药物利奈唑胺相仿。此研究结果与国内学者Li 等[9]2014年报道的结论一致。康替唑胺对肺炎链球菌和金葡菌均与利奈唑胺一样具有良好的PAE,且随着药物浓度的升高,PAE延长。上述结果与文献报道利奈唑胺的PAE结果一致[16]。
反映康替唑胺体内抗菌活性研究的小鼠全身感染模型和小鼠中性粒细胞减少性大腿感染模型的研究资料显示,其对各种革兰阳性菌包括耐多药菌株所致的小鼠全身感染模型中康替唑胺的半数有效量(ED50)均低于或相似于利奈唑胺的ED50,显示其具有和利奈唑胺相同或更好的疗效[9],如康替唑胺对金葡菌MRSA(ATCC 33591)、MRSA/VISA(Mu50)的ED50分别为2.36、2.50 mg/kg,显著低于利奈唑胺的ED507.55、5.35 mg/kg ,差异具统计学意义(P< 0.01);对MSSA(ATCC 29213)、MSSA(15)和MRSA(0850)的ED50分别为7.98、5.74、3.71 mg/kg与利奈唑胺的9.03、5.86、3.63 mg/kg相似(P> 0.05)。在对肺炎链球菌,包括PSSP、PISP(ATCC 49619)和PRSP菌株,以及粪肠球菌VSE(ATCC 29212)、VRE(EFL4041)和HLGR-VSE HH22(HH22)的小鼠全身感染模型的体内抗菌活性测定资料亦均显示康替唑胺与利奈唑胺有较高的相似疗效。同时在小鼠大腿感染模型中,康替唑胺在大多数实验剂量下,小鼠大腿的菌落计数显著低于相应对照组(P< 0.01)。康替唑胺和利奈唑胺对金葡菌ATCC 29213(MSSA)和金葡菌0605(临床株MSSA)引起的小鼠大腿中性粒细胞感染具有相似的疗效。国内有关小鼠全身感染模型和大腿感染模型的研究结果[9]进一步验证和反映了本研究的结果。
本研究结果显示康替唑胺对临床重要的需氧革兰阳性菌具有良好的抗菌作用,尤其是对一些需氧革兰阳性球菌中的耐药菌株(MRSA、PRSP、VRE等)均具有高度抗菌活性。其对肺炎链球菌包括PISP和PRSP具有杀菌活性;并对肺炎链球菌和金葡菌具有较长的PAE;其对葡萄球菌的抗菌活性略优于利奈唑胺;其对大多革兰阳性菌的抗菌作用与糖肽类抗生素万古霉素、替考拉宁的作用相仿;对VRE的抗菌作用与利奈唑胺一样,远优于万古霉素和替考拉宁。本研究结果均提示康替唑胺是需氧革兰阳性菌感染的适宜选用药物,包括由上述多重耐药株所致的感染,有望用于临床敏感革兰阳性菌感染的治疗。

