组蛋白乙酰化修饰调控NF-κB驱动的PNPLA3基因表达的机制初探
许晓?陈芸芝?徐芬?梁华


【摘要】目的 探討禁食/再喂食后小鼠肝脏Patatin样磷脂酶域蛋白3(PNPLA3)基因启动子核因子-κB(NF-κB)结合区域组蛋白H3K9乙酰化(H3K9ac)水平以及相关去乙酰化酶(HDAC)和乙酰化转移酶(HAT)的变化特点。方法 根据体质量将18只C57BL/6小鼠随机分为3组各6只,分别为自由饮食组、禁食组(夜间饥饿24 h)和再喂食组(饥饿24 h后再自由摄食高蔗糖含量饲料12 h),分别予自由饮食、禁食和禁食后再喂食干预,检测并比较各组肝脏PNPLA3、NF-κB、HDAC(SIRT1、SIRT6)和HAT(GCN5、Elp3)基因表达情况,用染色质免疫共沉淀-定量PCR检测H3K9ac富集水平,并分析H3K9ac与PNPLA3表达的相关性。结果 3组比较,C57BL/6小鼠肝脏PNPLA3、NF-κB基因表达在禁食时下调,再喂食后又上调(P均< 0.001)。H3K9ac水平变化与PNPLA3变化趋势一致(P均< 0.05),相关分析提示两者具有相关性(rs = 0.958, P < 0.001);禁食组SIRT1和SIRT6表达水平较自由饮食组高,再喂食组两者水平均下降(P均< 0.05),与H3K9ac变化趋势相反;GCN5、Elp3表达变化与SIRT1及SIRT6类似(P均< 0.05)。结论 SIRT1和SIRT6相关H3K9去乙酰化涉及饮食调节NF-κB驱动的PNPLA3的表达。
【关键词】Patatin样磷脂酶域蛋白3;组蛋白 H3K9 乙酰化;禁食/再喂食;核因子-κB
Preliminary study of the mechanism of histone acetylation modification in regulating NF-κB-driven PNPLA3 gene expression in liver Xu Xiao, Chen Yunzhi, Xu Fen, Liang Hua. Department of Endocrinology and Metabolism, the Third Affiliated Hospital of Sun Yat-sen University, Guangdong Provincial Key Laboratory of Diabetology, Guangzhou 510630, China
Corresponding author, Liang Hua, E-mail: lianghua@ mail. sysu. edu. cn
【Abstract】Objective To characterize the changes in the levels of H3K9 acetylation (H3K9ac) around the Nuclear factor-κB (NF-κB) binding site of PNPLA3 gene promoter and the expression levels of related deacetylase (HDAC) and acetyltransferase (HAT) enzymes in the liver of C57BL/6 mice during the fasting/re-feeding transition. Methods According to the weight, 18 C57BL/6 mice were randomly assigned into the ad libitum feeding group (n = 6), fasting group (n = 6, fasting for 24 h during night) and re-feeding group (n = 6, 24-h fasting followed by ad libitum re-feeding with high sucrose diet for 12 h). Mice were subjected to fasting/re-feeding interventions. The expression levels of PNPLA3, NF-κB, HDAC (SIRT1, SIRT6) and HAT (GCN5, Elp3) genes were detected and compared among three groups. The H3K9ac enrichment level was assayed by using ChIP-qPCR. Correlation analysis was performed to analyze the relationship between H3K9ac and PNPLA3 expression levels. Results The expression levels of PNPLA3 and NF-κB genes in C57BL/6 mouse liver were significantly down-regulated during fasting and then significantly up-regulated after re-feeding (all P < 0.001). The changes in the H3K9ac expression level were consistent with those in PNPLA3 (all P < 0.05). Correlation analysis suggested a significant association between H3K9ac and PNPLA3 expression levels (rs = 0.958, P < 0.001). The expression levels of SIRT1 and SIRT6 in the fasting group were significantly higher compared with those in the ad libitum feeding group, which were significantly down-regulated in re-feeding groups (all P < 0.05), contrary to the changing trend of H3K9ac. The changes in the expression levels of GCN5 and Elp3 were similar with those of SIRT1 and SIRT6 (all P < 0.05). Conclusions SIRT1 and SIRT6-associated H3K9 deacetylation may be involved in the dietary regulation of NF-κB-driven PNPLA3 expression.
【Key words】Patatin-like phospholipase-domain-containing 3;H3K9 acetylation;
Fasting/re-feeding;Nuclear factor-κB
非酒精性脂肪肝(NAFLD)与饮食关系密切。近年来有研究显示,频繁重复的长时间禁食(间歇禁食)具有改善NAFLD的作用,但具体分子机制尚未明确[1-2]。NAFLD是复杂性状疾病,其发病是遗传与环境因素共同作用的结果,表观遗传学修饰是在不改变DNA序列的情况下环境调控基因表达的关键环节[3]。既往研究表明,饮食和营养可通过表观遗传改变染色体结构和功能从而改变基因表达,形成多样性生物表型[4]。因此我们推测,表观遗传学修饰是间歇性禁食启动肝脏基因表达调控的关键。Patatin样磷脂酶域3 (PNPLA3)主要表达于肝脏组织,是NAFLD的主要易感基因[5]。我们的前期研究显示核因子-κB(NF-κB)调控PNPLA3表达参与PNPLA3基因 I148M多态性相关NAFLD炎症进展[6]。在人类和动物实验中,禁食可改善NAFLD炎症状态,其机制是否涉及表观遗传学修饰调控NF-κB驱动的PNPLA3表达尚不清楚[7-8]。因此本课题组拟在禁食/再喂食干预小鼠中初步探讨肝脏PNPLA3、NF-κB基因表达,PNPLA3基因启动子NF-kB结合区域组蛋白H3赖氨酸9乙酰化(H3K9ac)水平以及H3K9相关去乙酰化酶和乙酰化转移酶的变化特点, 为揭示间歇性禁食改善NAFLD的机制奠定基础。
材料与方法
一、动 物
7 ~ 8周龄雄性C57BL/6鼠18只,体质量20 ~ 25 g,购自南京大学南京生物医药研究院。
二、试 剂
对照饲料(AIN93纯化型标准饲料)以及高蔗糖饲料(65%蔗糖含量)购自南通特洛菲饲料科技有限公司(中国);染色质免疫共沉淀(ChIP)试剂盒(货号:17-10086) 购自Millipore公司(美国);动物组织RNA提取试剂盒(货号:74134)购自QIAGEN(德国),定量PCR (qPCR) 试剂盒(货号:04707516001)购自Roche公司(美国);逆转录PCR(RT-PCR)试剂盒5x All-In-One RT Master Mix (货号:G490) 购自Abm公司(加拿大)。免疫共沉淀使用CST公司(美国)的anti-H3k9Ac抗体(9649s),阴性对照组rabbit lgG抗体(B900610)购自Proteintech(中国)。
三、方 法
1.小鼠自由饮食、禁食和再喂食干预
18只C57BL/6J小鼠分为3只/笼,共6笼,自由取水和饮食,环境温度为22℃,湿度为60%。适应性喂养1周后,根据体质量将其随机分为3组各6只,分别为自由饮食组、禁食组(夜间饥饿24 h)和再喂食组(饥饿24 h后再自由摄食高蔗糖含量饲料12 h)。干预结束后留取小鼠肝脏组织进行后续检测。本动物实验伦理经中山大学实验动物管理与使用委员会审批通过(SYSU-IACUC-2020-000175)。
2. 染色质免疫共沉淀-定量PCR(ChIP-qPCR)
从每组中取4只小鼠进行ChIP-qPCR,将
20 mg小鼠肝臟组织(大约含5×106个肝脏细胞)剪碎成1 mm3组织小块后用1%甲醛交联,再使用匀浆仪将其研磨至单细胞状态,依次加入ChIP试剂盒提供的细胞裂解液及细胞核裂解液,解析出染色质,随后使用Diagenode公司(比利时)的Bioruptor UCD-200非接触式全自动超声波破碎仪剪切染色质至200 ~ 1000 bp,后续步骤严格按照ChIP试剂盒说明进行。免疫共沉淀用anti-H3k9Ac抗体,使用兔lgG抗体作为阴性对照。提纯的DNA使用qPCR试剂盒进行扩增定量,所用正向引物:5-GGAAAGACAGCATGTGGATGGT-3,反向引物:5-GATGCTTGCTGGGCAGAATG-3,产物覆盖PNPLA3启动子的NF-κB结合区域。用占input的百分比(% input)来表示免疫沉淀样品中H3K9ac在PNPLA3启动子NF-κB结合区域的富集度。
3. RT-PCR和qPCR
为检测肝脏PNPLA3、NF-κB、H3K9相关去乙酰化酶(SIRT1、SIRT6)、乙酰化酶(GCN5、Elp3)mRNA水平,使用组织RNA提取试剂盒,提取每组所有小鼠肝脏RNA,使用Nanadrop2000分光光度计测定总RNA浓度和纯度,OD260/280、OD260/230在1.9 ~ 2.1提示纯度较高。使用ABM公司试剂盒进行RT-PCR,反应条件为:25℃ 10 min,42℃ 15 min,85℃ 5 min,反应产物为互补DNA(cDNA)。以cDNA为模板,使用试剂盒进行qPCR实验, 反应条件:90℃ 30 s,95℃ 5 s,60℃ 20 s,40个循环; 95℃ 5 s,65℃ 15 s,95℃ continuous;40℃ 30 s。本研究所用qPCR引物序列如表1。
四、统计学处理
采用SPSS 20.0分析数据,用GraphPad Prism 8.0作图,各组数据均符合正态分布,计量资料用表示,多组定量资料比较用方差分析,两两比较用Dunnet-t法(比较自由饮食组和禁食组、禁食组和再喂食组)。相关分析中变量不符合正态分布,使用Spearman秩相关分析。P < 0.05 (双侧)为差异有统计学意义。
结果
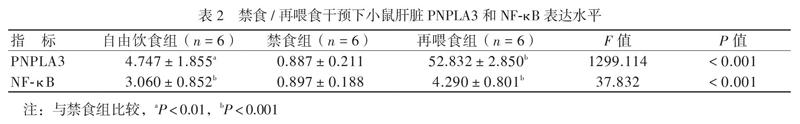
一、禁食/再喂食对小鼠肝脏PNPLA3和NF-κB表达的影响
禁食组小鼠肝脏PNPLA3表达水平较自由饮食组低,再喂食组PNPLA3表达水平最高。NF-κB在各组的表达趋势与PNPLA3一致,即在禁食时表达下调,禁食后再喂食表达上调,见表2。
二、禁食/再喂食对小鼠肝脏PNPLA3启动子NF-kB结合位点附近区域H3K9ac富集水平的影响
小鼠肝脏PNPLA3转录调控区域H3K9ac的水平在禁食/再喂食转换过程中的变化与PNPLA3的表达趋势一致,表现为禁食组H3K9ac水平较自由饮食组低(0.135±0.007 vs. 0.379±0.171,P < 0.05),再喂食组较禁食组高(0.780±0.064 vs. 0.135±0.007,P < 0.001),见图1。相关分析显示PNPLA3的基因表达和H3K9ac水平呈正相关
(rs = 0.958, P < 0.001)。
三、禁食/再喂食对小鼠肝脏H3K9ac 相关修饰酶表达的影响
禁食/再喂食时去乙酰化酶SIRT1以及SIRT6变化和H3K9ac的变化模式相反,均表现为禁食组表达水平较自由饮食组高(P < 0.05),再喂食组较禁食组低(P < 0.05),见图2A、B。GCN5和Elp3是增加组蛋白乙酰化水平的乙酰化酶,在禁食/再喂食中GCN5和Elp3的表达特征与SIRT1和SIRT6类似,在禁食組中表达水平高(P < 0.05),在再喂食组中表达水平低(P < 0.05),与 PNPLA3启动子H3K9ac水平的变化不相符,见图2C、D。
讨论
NAFLD与2型糖尿病、心血管疾病关系密切,是全球重要的公共健康问题之一,其治疗方法主要是生活方式干预[9-10]。不断增加的研究证据显示,间歇禁食具有改善NAFLD的作用,但其作用机制尚未明确[1-2]。PNPLA3基因是NAFLD主要易感基因,其表达受禁食再喂食状态调节,提示PNPLA3可能参与间歇禁食改善NAFLD的机制[5, 11-12]。PNPLA3基因表达调控机制尚未被完全阐明。NF-κB等对PNPLA3表达的调控已被本课题组及其他研究者证实[6, 12]。环境因素对基因表达的调控是通过诱导基因表观遗传学修饰实现的。UCSC数据库显示人或小鼠肝脏和肝细胞PNPLA3基因启动子存在超染色质活性区域和H3K9ac等丰富的组蛋白乙酰化修饰。但组蛋白乙酰化修饰调控PNPLA3基因表达的机制尚未见报道。在本研究中,我们初步探讨了禁食/再喂食时小鼠PNPLA3基因启动子NF-κB结合区域附近H3K9ac水平随能量状态变化的特点,以及可能调控H3K9乙酰化和去乙酰化酶表达水平的变化,为了解环境与基因相互作用促进NAFLD发生发展提供实验依据,也为揭示间歇禁食改善NAFLD的机制提供了新思路。
我们的前期研究证实NF-κB是PNPLA3的直接转录因子[6]。在本研究中,NF-κB表达受营养状态影响,禁食时表达降低,再喂食后表达增加,该结果与既往研究报道一致[8]。组蛋白乙酰化/去乙酰化可通过改变染色质结构影响转录因子和基因启动子结合而调控基因转录。因此,我们检测到的PNPLA3启动子NF-κB结合区域H3K9ac的富集水平在禁食时下降可能导致染色质结构致密而减弱NF-κB与PNPLA3启动子结合,降低PNPLA3表达,提示了低H3K9乙酰化抑制NF-κB驱动的PNPLA3表达可能涉及间歇禁食改善NAFLD的机制。
组蛋白乙酰化修饰过程处于动态平衡,并由组蛋白乙酰化转移酶和组蛋白去乙酰化酶共同调控。表观遗传学数据库Histome数据库(www.iiserpune.ac.in)及WERAM数据库(http://weram.biocuckoo.org/)显示,调控H3K9ac的去乙酰化酶为SIRT1、SIRT6,乙酰化酶为GCN5及Elp3。SIRT1和SIRT6表达下调是NAFLD发生发展的重要机制之一[13-15]。肝脏SIRT1和SIRT6表达也受营养状态调控,我们发现SIRT1和SIRT6表达水平在禁食时升高,再喂食后表达水平降低,这与既往研究结果一致[15-16]。此外,禁食/再喂食中SIRT1和SIRT6表达变化趋势与PNPLA3基因表达和PNPLA3启动子 H3K9ac水平相反,提示SIRT1和SIRT6可能涉及PNPLA3启动子H3K9ac水平调控。
GCN5和Elp3是H3K9ac相关乙酰化酶,涉及基因表达的增加。但在我们的研究中,禁食/再喂食时GCN5和Elp3表达表现出与预期(即禁食时降低再喂食后增加)相反的趋势,提示GCN5和Elp3可能不是调控PNPLA3基因H3K9ac水平的乙酰化酶。既往报道GCN5主要参与糖异生基因表达的转录抑制,由于PNPLA3基因功能不涉及糖代谢,GCN5可能不涉及PNPLA3基因表达的表观遗传学调控机制[17]。Elp3的相关研究主要集中在肿瘤研究,在代谢领域较少,其在禁食/再喂食中表达的变化效应和机制尚需要更进一步的实验来揭示。
综上所述,禁食/再喂食可能影响H3K9ac水平,调控NF-κB驱动的PNPLA3表达,SIRT1和SIRT6可能是负责此调控作用的去乙酰化酶。在本研究中我们对PNPLA3基因表观调控机制的探讨尚浅,需进一步行体内外研究,更深入探讨SIRT1、SIRT6与H3K9ac之间的关系以及SIRT1和SIRT6对NF-κB与PNPLA3启动子结合力及转录活性的影响。
参 考 文 献
[1] Cai H, Qin YL, Shi ZY, Chen JH, Zeng MJ, Zhou W, Chen RQ, Chen ZY. Effects of alternate-day fasting on body weight and dyslipidaemia in patients with non-alcoholic fatty liver disease: a randomised controlled trial. BMC Gastroenterol,2019,19(1):219.
[2] Aliasghari F, Izadi A, Gargari BP, Ebrahimi S. The effects of ramadan fasting on body composition, blood pressure, glucose metabolism, and markers of inflammation in NAFLD patients: an observational trial. J Am Coll Nutr,2017,36(8):640-645.
[3] Gallego-Durán R, Romero-Gómez M. Epigenetic mechanisms in non-alcoholic fatty liver disease: an emerging field. World J Hepatol,2015,7(24):2497-2502.
[4] Tiffon C. The impact of nutrition and environmental epigenetics on human health and disease. Int J Mol Sci, 2018,19(11):3425.
[5] Romeo S, Kozlitina J, Xing C, Pertsemlidis A, Cox D, Pennacchio LA, Boerwinkle E, Cohen JC, Hobbs HH. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet,2008,40(12):1461-1465.
[6] Yuan S, Liu H, Yuan D, Xu J, Chen Y, Xu X, Xu F, Liang H. PNPLA3 I148M mediates the regulatory effect of NF-κB on inflammation in PA-treated HepG2 cells. J Cell Mol Med,2020,24(2):1541-1552.
[7] Aliasghari F, Izadi A, Gargari BP, Ebrahimi S. The effects of ramadan fasting on body composition, blood pressure, glucose metabolism, and markers of inflammation in NAFLD patients: an observational trial. J Am Coll Nutr, 2017, 36(8):640-645.
[8] Sokolovi? A, van Roomen CP, Ottenhoff R, Scheij S, Hiralall JK, Claessen N, Aten J, Oude Elferink RP, Groen AK, Sokolovi? M. Fasting reduces liver fibrosis in a mouse model for chronic cholangiopathies. Biochim Biophys Acta,2013,1832(10):1482-1491.
[9] Younossi ZM, Stepanova M, Afendy M, Fang Y, Younossi Y, Mir H, Srishord M. Changes in the prevalence of the most common causes of chronic liver diseases in the United States from 1988 to 2008. Clin Gastroenterol Hepatol,2011,9(6):524-530.
[10] Targher G, Bertolini L, Padovani R, Rodella S, Tessari R, Zenari L, Day C, Arcaro G. Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients. Diabetes Care,2007,30(5):1212-1218.
[11] Sookoian S, Pirola CJ. Meta-analysis of the influence of I148M variant of patatin-like phospholipase domain containing 3 gene (PNPLA3) on the susceptibility and histological severity of nonalcoholic fatty liver disease. Hepatology,2011,53(6):1883-1894.
[12] Liang H, Xu J, Xu F, Liu H, Yuan D, Yuan S, Cai M, Yan J, Weng J. The SRE motif in the human PNPLA3 promoter (-97 to -88 bp) mediates transactivational effects of SREBP-1c. J Cell Physiol,2015,230(9):2224-2232.
[13] Xu F, Li Z, Zheng X, Liu H, Liang H, Xu H, Chen Z, Zeng K, Weng J. SIRT1 mediates the effect of GLP-1 receptor agonist exenatide on ameliorating hepatic steatosis. Diabetes,2014,63(11):3637-3646.
[14] Zheng X, Xu F, Liang H, Cao H, Cai M, Xu W, Weng J. SIRT1/HSF1/HSP pathway is essential for exenatide-alleviated, lipid-induced hepatic endoplasmic reticulum stress. Hepatology,2017,66(3):809-824.
[15] Kim HS, Xiao C, Wang RH, Lahusen T, Xu X, Vassilopoulos A, Vazquez-Ortiz G, Jeong WI, Park O, Ki SH, Gao B, Deng CX. Hepatic-specific disruption of SIRT6 in mice results in fatty liver formation due to enhanced glycolysis and triglyceride synthesis. Cell Metab,2010,12(3):224-236.
[16] Li Y, Wong K, Giles A, Jiang J, Lee JW, Adams AC, Kharitonenkov A, Yang Q, Gao B, Guarente L, Zang M. Hepatic SIRT1 attenuates hepatic steatosis and controls energy balance in mice by inducing fibroblast growth factor 21. Gastroenterology, 2014,146(2):539-549.
[17] Lerin C, Rodgers JT, Kalume DE, Kim SH, Pandey A, Puigserver P. GCN5 acetyltransferase complex controls glucose metabolism through transcriptional repression of PGC-1alpha. Cell Metab,2006,3(6):429-438.
(收稿日期:2020-11-25)
(本文編辑:洪悦民)

