伴微浸润的乳腺导管原位癌中肿瘤浸润淋巴细胞分布状态分析
阮莹?林琼林?关结霞?赵畅

【摘要】目的 回顧性分析乳腺导管原位癌(DCIS)患者的临床病理资料,探讨伴微浸润的DCIS中肿瘤浸润淋巴细胞(TILs)的分布情况。方法 74例乳腺DCIS患者作为研究对象,不伴微浸润的DCIS(pure-DCIS)共42例作为对照组,伴微浸润的DCIS(mi-DCIS)32例作为实验组,分析其临床病理资料及TILs分布的差异,并进一步对mi-DCIS组原位癌及微浸润区域的TILs密度进行对比。结果 400倍高倍镜下,mi-DCIS组热点区域及平均值区域TILs百分比分别为57.50(18.75,80.00)%,8.00(5.00,15.00)%,pure-DCIS组分别为5.00(1.00,16.25)%,1.00(1.00,5.00)%,无论是热点区域还是平均值,mi-DCIS组TILs百分比均高于pure-DCIS组(P均< 0.001)。mi-DCIS组中微浸润灶处平均TILs比例为15.00 (5.00, 50.00)%,高于原位癌区域8.00(5.00,15.00)%,差异有统计学意义(P = 0.004)。结论 相较于pure-DCIS,mi-DCIS中TILs的分布密度明显增高;mi-DCIS中,微浸润灶处TILs的分布情况较整体有上升的趋势。
【关键词】乳腺导管原位癌;肿瘤浸润淋巴细胞;微浸润;分布状态
Analysis of distribution pattern of tumor-infitrating lymphoctyes in breast ductal carcinoma in situ complicated with microinfiltration Ruan Ying, Lin Qionglin, Guan Jiexia, Zhao Chang. Department of Thyroid and Breast Surgery, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Zhao Chang, E-mail: zhaoch43@ mail. sysu. edu. cn
【Abstract】Objective To retrospectively review the clinocopathological data of patients with breast ductal carcinoma in situ (DCIS), and explore the distribution pattern of tumor-infiltrating lymphocytes (TILs) in DCIS patients complicated with microinfiltration. Methods Seventy-four DCIS patients were recruited in this study. Among them, 42 patients with pure DCIS (pure-DCIS) were assigned into the control group, and 32 cases of DCIS complicated with microinfiltration (mi-DCIS) were allocated into the experimental group. The clinicopathological data and TILs distribution were analyzed. Moreover, the TILs density between the DCIS area and microinfiltration area were statistically compared in the mi-DCIS group. Results Under 400× microscope, the hot spot and average TILs percentages were 57.50(18.75, 80.00)% and 8.00(5.00, 15.00)% in the mi-DCIS group,and 1.00(1.00, 5.00)% and 5.00(1.00, 16.25)% in the pure-DCIS group, respectively. Regardless of the hot spot or average value, the TILs percentages in the mi-DCIS group were significantly higher than those in the pure-DCIS group (both P < 0.001). In the mi-DCIS group, the average proportion of TILs in the micro-infiltrating lesions was 15.00(5.00, 50.00)%, significantly higher compared with 8.00(5.00, 15.00)% in the carcinoma in situ area (P = 0.004). Conclusions Compared with pure-DCIS alone, the density of TILs distribution in mi-DCIS is significantly enhanced. In the mi-DCIS group, the distribution of TILs in the micro-infiltrating lesions tends to elevate compared with the overall distribution pattern.
【Key words】Breast ductal carcinoma in situ;Tumor-infiltrating lymphocyte;Microinfiltration;
Distribution pattern
肿瘤浸润淋巴细胞(TILs)是近年来肿瘤研究领域的热点。TILs是指聚集在肿瘤病灶区域内的免疫淋巴细胞,包括B淋巴细胞、T淋巴细胞、自然杀伤细胞、树突状细胞等,是肿瘤微环境中的重要组成部分,参与肿瘤免疫与免疫抑制的复杂过程[1-3]。已有多项研究证实,TILs的分布与乳腺癌的预后相关,尤其在三阴性乳腺癌及人表皮生长因子受体2(HER-2)过表达型乳腺癌中,TILs的百分比与浸润性乳腺癌患者的预后呈正相关[4]。但是在乳腺导管原位癌(DCIS)中,TILs的相关研究不多,其浸润情况及与预后关系的报道结果不一,针对伴有微浸润的DCIS(mi-DCIS)中TILs分布情况的报道更是少见[4-5]。根据2010年美国癌症联合委员会(AJCC)指南,微浸润被定义为肿瘤细胞突破基底膜但浸润深度小于1 mm,mi-DCIS是乳腺原位癌中的一种特殊类型,其与不伴微浸润的单纯DCIS(pure-DCIS)、浸润性癌在生物学特性及预后上均不尽相同,针对其中TILs分布状态仅有零星小样本报道,相关研究较缺乏[6]。因此,本文回顾性分析了74例DCIS患者(其中伴微浸润32例),分析其临床病理资料,探讨mi-DCIS中TILs的分布情况。
对象与方法
一、研究对象
本研究以中山大学附属第三医院甲状腺乳腺外科于2014年1月至2020年12月诊断为乳腺DCIS的所有住院患者为研究对象。排除标准:初诊即为复发病例、新辅助化疗病例、未行根治性手术、伴有其他器官转移以及因各种原因无法获取手术标本的病例。回顾性采集患者年龄、性别、术前检查[含彩色多普勒超声(彩超)、钼靶等]等临床资料。所有患者已接受根治性手术(乳腺癌改良根治术或保乳手术)治疗。
二、方 法
1.組织学判定
所有入组病例均采用手术切除标本,经过甲醛固定、石蜡包埋、切片及HE染色处理。病理玻片由2位专科医师共同阅片,采用《WHO 2020乳腺肿瘤病理分类标准》,判定pure-DCIS及mi-DCIS病例,以及雌激素受体(ER)、孕激素受体(PR)、HER-2、Ki-67等免疫组织化学(组化)指标读取(mi-DCIS组中,以上数据仅评判总体平均值)[7]。同时采集肿瘤大小、病理分级、有无坏死、有无粉刺样变、有无淋巴结转移等资料。其中ER、PR > 1%定义为阳性,HER-2免疫组化结果(+++)或免疫组化结果(++)、荧光原位杂交结果阳性定义为阳性,否则为阴性。根据《中国临床肿瘤学会乳腺癌诊疗指南2019》,Ki-67 > 30%被定义为高表达[8]。
2.TILs分布情况判定
TILs的分布情况由2位病理科专科医师判定,根据 《WHO 2020乳腺肿瘤病理分类标准》分别判断pure-DCIS与mi-DCIS组TILs的分布状态,记录包含200、400倍高倍镜下热点区域及平均TILs百分比。另外,对于mi-DCIS组,为了观察mi-DCIS组微浸润灶与总体TILs的一致性,进一步分别采集原位癌区域TILs与微浸润灶区域TILs分布的百分比作对比(因微浸润灶病灶较小,热点区域判定可能存在明显误差,故此部分研究只对比微浸润灶与总体TILs的平均值)。
三、统计学处理
应用SPSS 22.0对数据进行分析,分类资料用例(%)表示,其中无序分类资料组间比较采用χ2检验,等级资料组间比较采用Mann-Whitney U秩和检验。非正态分布的连续型变量用中位数(下四分位数、上四分位数)表示,组间比较采用Mann-Whitney U秩和检验,mi-DCIS组原位癌区域与微浸润灶区域TILs百分比的比较采用Wilcoxon符号秩和检验。 P < 0.05为差异有统计学意义。
结果
一、2组基本临床及病理资料对比
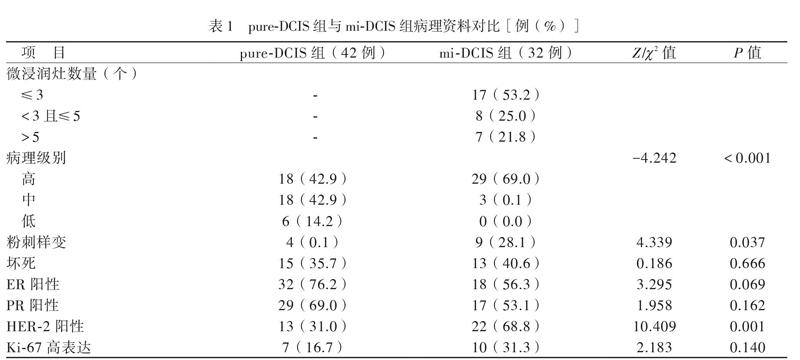
符合入组标准的DCIS患者共74例,其中pure-DCIS组42例,mi-DCIS组32例。所有患者均为女性,年龄24 ~ 84岁,中位年龄为48岁。pure-DCIS组和mi-DCIS组各有5例患者小于35岁,2组年龄比较差异无统计学意义(P = 0.643)。pure-DCIS组和mi-DCIS组分别有16例、12例患者为多灶性病例,2组多灶性情况比较差异无统计学意义(P = 0.958)。2组病理级别、粉刺样变、HER-2阳性比例比较差异均有统计学意义(P均< 0.05或0.001);坏死、ER阳性、PR阳性以及Ki-67高表达比例比较差异均无统计学意义(P均> 0.05),见表1。
二、pure-DCIS组与mi-DCIS组TILs分布情况对比
pure-DCIS组及mi-DCIS组各病例中有不同程度的TILs分布,见图1。400倍高倍镜下,无论是热点区域还是平均值,mi-DCIS组TILs百分比均高于pure-DCIS组,两者比较差异均有统计学意义(P均< 0.05);200倍高倍镜下也有一致的结果,见表2。
三、mi-DCIS病例中微浸润灶TILs分布情况。
实验中发现,对于mi-DCIS组病例,因微浸润灶普遍较小,故原位癌区域TILs分布情况与总体基本一致。pure-DCIS组中,400倍高倍镜下,微浸润灶处平均TILs为15.00(5.00,50.00)%,高于总体TILs百分比[8.00(5.00,15.00)%],差异有统计学意义(Z = -2.844,P = 0.004)。200倍高倍镜下,微浸润灶处平均TILs为12.00(5.00,23.75)%,与总体[5.00(5.00,12.00)%]比较差异无统计学意义(Z = -1.917,P = 0.055)。
讨论
近年来,随着关于肿瘤微环境研究的深入,肿瘤免疫微环境成为乳腺癌研究的热点话题。在浸润性癌中,高TILs百分比已被认为是三阴性及HER-2阳性乳腺癌预后良好的指标,提示TILs可能存在抗肿瘤作用[9]。但针对原位癌,TILs的保护作用则仍富有争议。Pruneri等[10]发表的一项纳入1488例患者的回顾性分析表明,TILs分布情况与DCIS预后无关。甚至有研究表明,DCIS中TILs比例增高,与预后不良因素有关。2019年Darvishian等[11]研究发现,在DCIS中TILs比例> 30%的病例中年轻患者、大肿瘤、高级别肿瘤、粉刺样变及坏死等的比例明显较高。这似乎意味着与浸润性癌不同,高TILs比例在DCIS中并不是预后良好的因素,其向浸润性癌发展的可能性更高。对于mi-DCIS的分析可能能回答此项矛盾,并对肿瘤免疫微环境的作用解读富有重要意义。但目前针对mi-DCIS中TILs分布情况的研究仍较缺乏。本研究结果表明相较于pure-DCIS,mi-DCIS中TILs的分布密度明显增高;mi-DCIS中,微浸润灶处TILs的分布情况较整体有上升的趋势。
作为DCIS中的一种特殊类型,微浸润被认为是pure-DCIS向浸润性癌过度的过程[11]。既往报道表明,mi-DCIS病例的复发率明显高于pure-DCIS病例,且在mi-DCIS往往有更高比例的ER阴性、HER-2阳性患者,其淋巴结转移的发生率也更高[12]。在与pure-DCIS组对比中,本研究发现mi-DCIS组中高级别DCIS、粉刺样变、HER-2阳性等预后危险因素确实高于pure-DCIS组,而与之对应的TILs比例亦显著增高。这与此前另外一篇报道的结果类似[6]。同时,本研究还深入对比了微浸润灶处TILs的分布情况与整体的差异,结果表明,高倍镜下微浸润灶TILs百分比明显上升,在低倍镜下也有上升的趋势。表明mi-DCIS免疫微环境的确与pure-DCIS存在差异。针对这种趋势,笔者推断可能存在以下两个方面的原因:一是TILs在腫瘤浸润的过程中扮演了促进作用。既往研究表明,除了具有杀肿瘤作用的CD8+ T淋巴细胞,自然杀伤细胞等成分外,TILs中还存在具有免疫抑制细胞,包括调节性T淋巴细胞、M2型巨噬细胞等,能分泌免疫抑制因子,提高肿瘤的浸润及原处转移能力,能在DCIS向浸润性癌发展的过程中起促进作用;另一种解释是DCIS浸润的过程中,激活了免疫,促进了TILs的聚集[13]。本研究结果与既往研究结果类似,高TILs的DCIS中ER阳性、HER-2阳性的病例比例更高,而此类肿瘤,也具有更强的免疫原性,其在浸润的过程中,促进了TILs的聚集[7, 14]。虽然以上推断仍需进一步实验证实,但仍说明对mi-DCIS中免疫微环境的进一步研究,对了解乳腺癌的浸润过程、免疫反应等具有较大的意义。
肿瘤免疫微环境在肿瘤的发生发展中具有复杂而重要的意义,为肿瘤的免疫治疗提供了新的思路与靶点。本研究发现肿瘤微浸润这一种特殊状态下TILs的变化,也为抑制肿瘤治疗的研究提供了新的思路——深入研究不同肿瘤状态下肿瘤免疫微环境的变化,可能为利用免疫治疗抑制肿瘤浸润性提供新的研究方向。
综上所述,mi-DCIS中TILs的分布密度较pure-DCIS中明显增高,且微浸润灶处TILs的分布密度更高,说明mi-DCIS中肿瘤免疫微环境具有特殊性,值得进一步深入研究。
参 考 文 献
[1] 张丽,刘芳芳,付丽.肿瘤间质浸润淋巴细胞在乳腺癌中的意义及评价方法.中华病理学杂志,2016,45(4):282-284.
[2] 白素杭,杨晓悦,张楠,张富涵,沈宗毅,杨娜,张文赛,喻长远,杨昭.肿瘤浸润淋巴细胞在实体肿瘤中作用的研究进展.生物工程学报,2019,35(12):2308-2325.
[3] 唐录英,金亦,刘勇,冯智英,邵春奎,任泽舫. 人类表皮生长因子、p53、雌激素受体及孕激素受体在不同临床期别乳腺浸润性导管癌组织中的表达. 中山大学学报(医学版), 2009, 30(4): 454-457.
[4] Thompson E, Taube JM, Elwood H, Sharma R, Meeker A, Warzecha HN, Argani P, Cimino-Mathews A, Emens LA. The immune microenvironment of breast ductal carcinoma in situ. Mod Pathol,2016,29(3):249-258.
[5] Farolfi A, Petracci E, Serra L, Ravaioli A, Bravaccini S, Ravaioli S, Tumedei MM, Ulivi P, Canale M, Puccetti M, Falcini F, Folli S, Curcio A, Rocca A. Tumor-infiltrating lymphocytes (TILs) and risk of a second breast event after a ductal carcinoma in situ. Front Oncol,2020,10:1486.
[6] Beguinot M, Dauplat MM, Kwiatkowski F, Lebouedec G, Tixier L, Pomel C, Penault-Llorca F, Radosevic-Robin N. Analysis of tumour-infiltrating lymphocytes reveals two new biologically different subgroups of breast ductal carcinoma in situ. BMC Cancer,2018,18(1):129.
[7] Tan PH, Ellis L, Allison K,Brogi E,Fox SB ,Lakhani S,Lazar AJ,Morris EA,Sahin A,Salgado R. The 2019 WHO classification of tumours of the breast. Histopathology, 2020, Feb 13 [Online ahead of print]
[8] 中国临床肿瘤学会工作指南委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2019. 北京:人民卫生出版社,2019.
[9] 李智勇,白雪.三阴性乳腺癌分子分型的研究进展.新医学,2018,49(2):77-81.
[10] Pruneri G, Lazzeroni M, Bagnardi V, Tiburzio GB, Rotmensz N, DeCensi A, Guerrieri-Gonzaga A, Vingiani A, Curigliano G, Zurrida S, Bassi F, Salgado R, Van den Eynden G, Loi S, Denkert C, Bonanni B, Viale G. The prevalence and clinical relevance of tumor-infiltrating lymphocytes (TILs) in ductal carcinoma in situ of the breast. Ann Oncol,2017,28(2):321-328.
[11] Darvishian F, Ozerdem U, Adams S, Chun J, Pirraglia E, Kaplowitz E, Guth A, Axelrod D, Shapiro R, Price A, Troxel A, Schnabel F, Roses D. Tumor-infiltrating lymphocytes in a contemporary cohort of women with ductal carcinoma in situ (DCIS). Ann Surg Oncol,2019,26(10):3337-3343.
[12] Coronella JA, Telleman P, Kingsbury GA, Truong TD, Hays S, Junghans RP. Evidence for an antigen-driven humoral immune response in medullary ductal breast cancer. Cancer Res,2001,61(21):7889-7899.
[13] Sadeghalvad M, Mohammadi-Motlagh HR, Rezaei N. Immune microenvironment in different molecular subtypes of ductal breast carcinoma. Breast Cancer Res Treat, 2020. doi: 10.1007/s10549-020-05954-2. Epub ahead of print.
[14] Zhang G, Li C, Tian G, Cheng X, Li Y, Ma L. Comparison of breast ductal carcinoma in situ and ductal carcinoma in situ with microinvasion, and analysis of axillary lymph node metastasis. Medicine (Baltimore),2020,99(52):e23593.
(收稿日期:2020-12-20)
(本文編辑:杨江瑜)

