PS植入路径上不同动物椎骨近红外特性差异研究*
刘洋洋, 孟 琳, 钱志余, 李韪韬
(1.南京航空航天大学 生物医学工程系,江苏 南京 210016;2.南京工程学院 信息与通信工程,江苏 南京 210003)
0 引 言
椎弓根螺钉(pedicle screw,PS)内固定是治疗脊柱不稳定的常用方法,PS的准确植入对于手术的成功非常重要[1]。目前检测PS位置是否准确的技术为术后CT扫描,但这种方法不适用于手术过程中的实时监测[2]。X光实时成像系统可以实现术中实时监测,但限制是辐射剂量较高,需要多次扫描[3]。有学者研究一种能实时检测不同组织的电导率测量装置,测试效果好但是难以确定PS在椎体中的准确位置[4]。因此,准确方便的PS实时监测技术仍需要探索。
在之前的研究中,实现了光纤手钻探针的设计,开发出基于近红外光谱技术的组织光谱测量系统[5]。基于该系统采集到的光谱,通过计算光谱的峰值和斜率,找到了沿PS植入路径探索猪椎骨不同组织的方法[6]。然而,这些组织识别方法仍存在一些问题需要解决,例如方法稳定性较差,难以实现两种椎骨组织的完全区分。
考虑到方法的普适性,本文研究并比较了三种不同动物模型的光反射光谱,包括新鲜的猪椎骨、牛椎骨和羊椎骨。其中,猪的椎骨与人类相似,而牛和羊的椎骨成分相似,这些模型的选取有利于提高方法的稳定性[7,8]。
本文的目标是通过分析不同动物的光谱特征,开发一种更加准确的方法来区分PS植入路径上的测试点位置。具体地,首先提取特定波段的近红外光谱斜率进行计算比较,然后结合前期研究计算不同的特征识别因子[6],最后将不同的识别因子进行比较,确定最优的特征识别因子为后续PS植入模型提供支撑。实验结果表明最优识别因子针对猪、牛、羊的不同椎骨组织分类效果良好,该结论为临床手术中植钉准确率的提高提供了新方向。
1 实验方法
1.1 近红外光谱测试系统
光谱测量的实验装置如图1所示,该系统由计算机卤钨光源(HL2000-HP-FHSA,Ocean Optics,Inc.,Dunedin,FL)、光纤探针和光谱仪(USB2000,Ocean Optics,Inc.,Dunedin,FL)组成[5]。自制的光纤手钻探头包含两个直径为200 μm的光纤,分别用于光传输和采集。控制器用于调节光强度。使用LabVIEW和MATLAB(Math Works,Natick,MA)编写软件分析光学反射光谱。
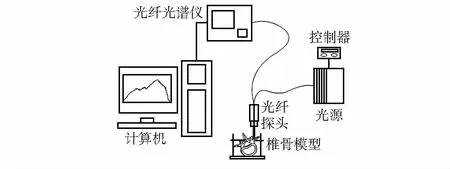
图1 测试系统示意
1.2 近红外光谱采集实验
人的椎骨与猪的相似,尤其是在T6和T10之间[7,8],因而实验中选择了这段猪椎骨。猪椎骨实验中选用10块新鲜成年猪椎骨作为实验对象,成年猪的质量约为38~45 kg。采用医用手术刀剥离骨膜外的所有软组织,并用生理盐水清洗干净,放在实验台准备实验。首先,将猪椎骨标本从轴面切成两半。在猪椎体表面用箭头线标出了PS的植入路径(图2),路径长度为22~35 mm,沿着轨迹绘制了9个采样点,如图2所示,两个采样点之间的距离为5 mm。然后对每个采样点进行光谱采集,每一点测试并存储30个光谱。积分时间为100 ms,每条反射光谱的像素点数为2 048。最后,使用编写的软件基于光谱计算出不同的识别因子。
在牛椎骨实验中,仍选取10块新鲜的椎骨,成年牛的质量约为300~350 kg,实验过程与猪椎骨实验相似。由于牛椎骨尺寸较大,选择了9个采样点后点之间的距离为8 mm。羊椎骨实验采用10块新鲜的椎骨,成年羊的质量约为70~80 kg,由于羊椎骨的尺寸小于猪或牛椎体,其采样点之间的距离最小。其他实验步骤与猪脊椎实验相似。实验数据采用t检验进行统计分析,选择95 %的置信水平来确定两组间差异的显著性,P值大于0.05表示无显著性差异。
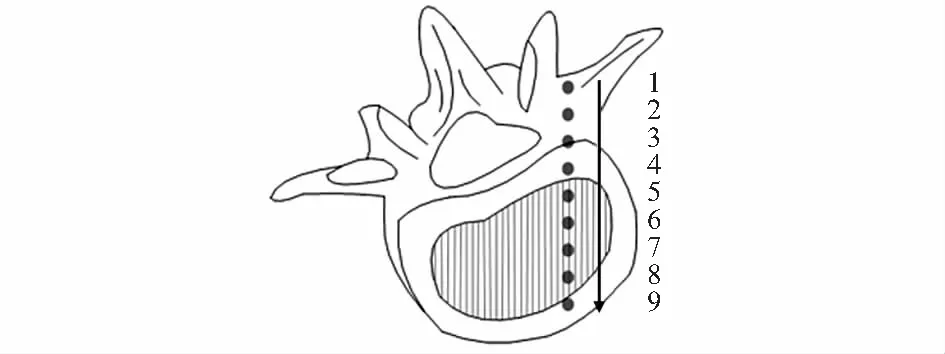
图2 椎骨实验中椎骨规划路径
1.3 猪、牛、羊椎骨组织识别因子研究
1)面积因子、峰值因子、特定斜率因子
图3为动物的典型椎骨组织近红外光谱,不同的动物椎骨组织具有不同的近红外光谱数值,考虑从近红外光谱的面积、峰值、特定波段的斜率等方面区别不同组织,根据前期研究这些因子都可以通过光谱曲线计算出来的,包括峰值(最大值),面积值和斜率值(600~650 nm)随深度变化的曲线[6]。
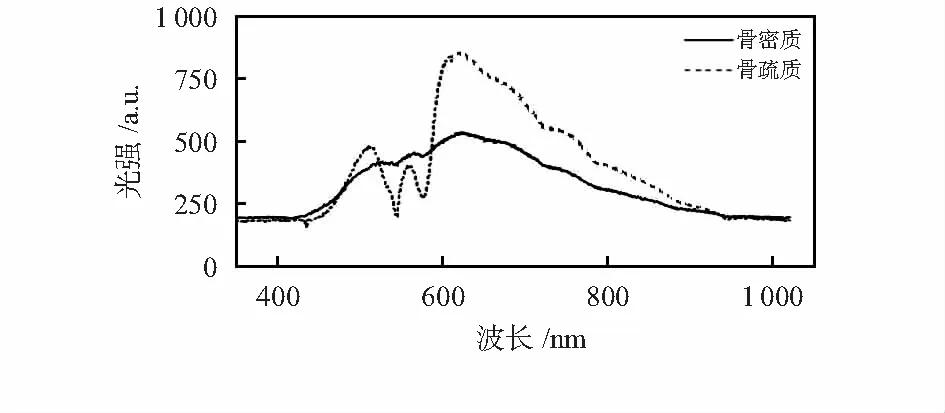
图3 典型椎骨组织近红外光谱
2)优化斜率因子
研究发现,当波长为460~590 nm时,骨密质和骨疏质的原始光谱具有明显区别的。两个峰分别稳定在约510 nm(λ1) 和 550 nm(λ3),这两个峰之间的谷值为542 nm(λ2),与HBO2的吸收特性相符合。将两个峰之间的差异模式定义斜率因子slope,如式(1)~式(3)所示。分别计算slope1,slope2,slope,选择差异最大的因子作为优化斜率因子
(1)
(2)
slope=slope2-slope1
(3)
2 实验结果与讨论
2.1 猪、牛、羊椎骨组织光谱特性分析
实验中,获取了新鲜的猪、牛、羊椎骨的近红外光谱,图4显示了不同椎骨表面标记线上9个采样点的近红外光谱,每个频谱曲线表示一个采样点的数据,图4(a)表示猪椎骨实验测试结果,(b)表示牛椎骨实验测试结果,(c)表示羊椎骨实验测试结果,其中点1和点9在骨密质中和从点2到点8在骨疏质中。结果表明,通过路径上9个点的不同光谱曲线形状可以基本区别两种不同的组织,如图4所示,在骨密质中的点1和点9的值区别于骨疏质中的点2到点8。

图4 不同椎骨近红外光谱
然而,图4(a)中,点1和点9的值与点2到点8的值区分较为明显,而在图4(b)和(c),点1和点9的值与点2到点8的值的区分性较差,可能单从光谱面积、峰值上不能明显区分不同动物的不同椎骨组织光谱。考虑到猪椎骨实验结果中骨密质的波形和骨疏质的波形较为统一,而牛椎骨实验结果和羊椎骨实验结果中,骨密质波形和骨疏质的波形变动较大,推测要提取与结构差异相关的特征因子(例如与近红外吸收特性相关的波段斜率因子),才能够区分PS植入路径上不同动物的椎骨组织。导致这种现象可能是在三种动物中猪椎骨的结构最为致密,而羊椎骨的结构中具有较大的空洞,牛椎骨具有很大的体积并且结构相当不均匀,因而提取的特征识别因子不应受到动物本身椎骨差异的影响。
2.2 面积因子、峰值因子、特定斜率因子计算结果
根据前期研究计算不同动物的面积因子、峰值因子、特定斜率因子,如表1所示。从表中发现,基于同一动物的不同椎骨组织具有区分性,但是不能够完全区分,骨疏质与骨密质的识别因子具有一定重叠性。这种现象可能导致监测过程中不同的采样点不能够明显区分。

表1 不同动物椎骨的面积因子、峰值因子、特定斜率因子
2.3 优化斜率因子计算结果
为了找到区分不同光谱的敏感参数,对初始光谱进行了分析,以猪脊椎实验的结果为例。在图4(a)中,在480~580 nm范围内有两个峰,这两个峰在骨疏质的光谱中几乎处于相同的位置,这与骨密质的光谱非常不同。猪椎骨的斜率因子可以从方程(3)中推导出来,如图5所示所有椎骨中每个测量点的slope1均为正,而骨疏质每个测量点的slope2均为负值,骨密质的slope2均为正值,由此发现9个测量点的slope均为负值,从图中发现,slope的组织区分敏感性要优于slope1和slope2,定义为Tslope。继续研究其它两种动物,是否存在这种规律。
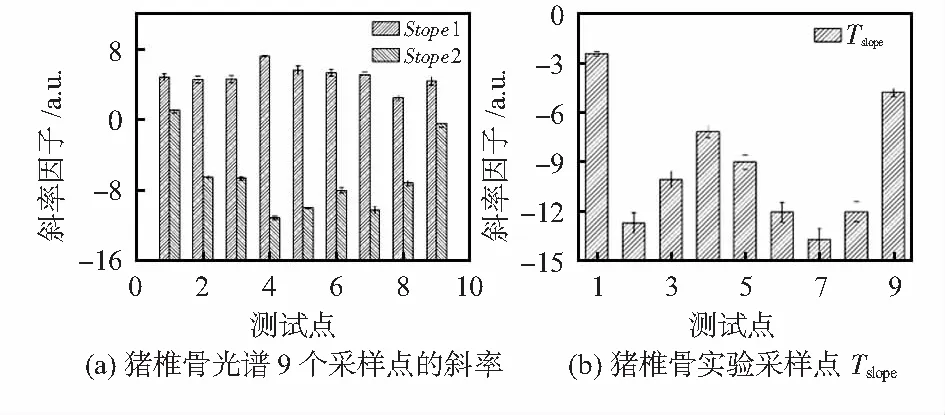
图5 猪椎骨的光谱斜率
用同样的方法计算了牛骨和羊骨的光谱斜率。计算并比较slope1和slope2,如图6(a)和(c)所示。图6(b)为牛椎骨slope,图6(d)为羊椎骨slope。同样,骨疏质各测量点的slope2对于牛椎骨和羊椎骨均为负值。骨疏质和骨密质的slope(slope2-slope1)均为负值,基于slope能明显区分两种不同组织。
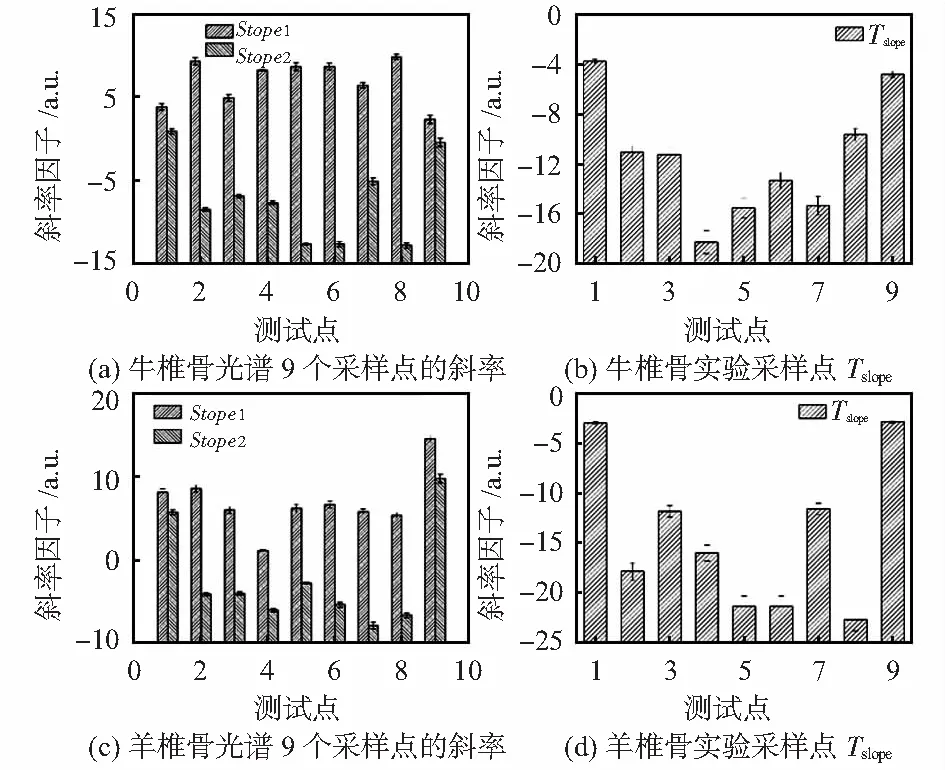
图6 牛、羊椎骨的光谱斜率
2.4 最优识别因子计算
从上述的研究成果中发现:面积因子、峰值因子、特定斜率因子和优化斜率因子能够对单一动物的不同椎骨组织进行区分,但本文旨在寻找能够应用PS植入路径上的椎骨区分因子并求取最优识别因子,归一化计算结果如图7所示,研究结果表明优化斜率因子对于猪、牛、羊的不同椎骨组织都具有较好的区分性。
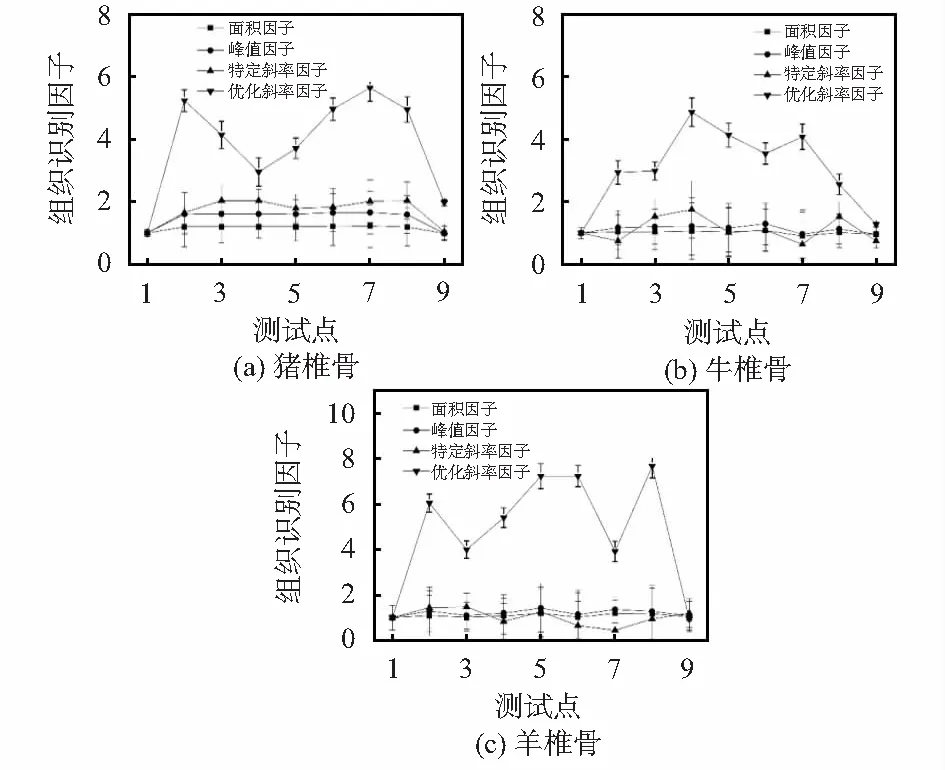
图7 不同动物椎骨采样点的组织识别因子计算
3 结 论
开发新的实时术中PS监测方法是一个热点[9],本文基于近红外光谱技术,沿着PS植入路径上对不同动物(猪、牛、羊)椎骨组织进行了光谱采集。本研究计算四种识别因子,其中面积因子、峰值因子、特定斜率因子可以从均值上区分不同椎骨组织,但基于PS植入路径上的各点的区分性较差。而优化斜率因子不仅实现猪的不同椎骨的区分,也能实现牛椎骨、羊椎骨在PS植入路径上的组织区分,并且具有较大的差异性,并建立了PS植入采样点的识别模型。通过比较不同识别因子的区分稳定性和准确性,证明了优化斜率因子可作为最佳识别因子。研究结果对开发具有自主知识产权的高科技医疗器械具有重要意义。

