通过定向进化技术提高角蛋白酶的热稳定性研究
傅 岩 张铁鹰* 孙英霞 李松育
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.山西农业大学动物科学学院,太原 030801)
角蛋白结构稳定、疏水性极强[1-2],动物内源蛋白酶难以将其有效降解[3]。家禽屠宰副产物羽毛中粗蛋白质含量在90%以上,若能高效利用可有助于缓解我国蛋白质饲料资源供需矛盾。传统物理、化学方法处理角蛋白存在诸多不足,产品氨基酸营养品质差,且易产生环境污染[4-5]。目前,已经发掘出多种角蛋白降解菌,包括细菌[6-9]、真菌[10-12]、放线菌等[13-14],这些菌株均可分泌能特异性降解角蛋白的蛋白酶——角蛋白酶。角蛋白酶可水解不溶性角蛋白[15-16],是处理羽毛等角蛋白资源的较优的生物制品[5,17],可用于处理羽毛,提高其营养价值[18-19],或直接用作饲料添加剂[20]。
角蛋白热稳定性强,可耐受饲料制粒温度,在高温条件下可提高其酶促反应速率。本实验室前期研究发现,地衣芽孢杆菌CP-16角蛋白酶的热稳定性不佳[15]。因此,改善角蛋白酶热稳定性,对提高其酶解羽毛角蛋白效率和在畜禽饲粮中应用具有重要意义。目前有关角蛋白酶结构与功能的研究报道较少,大多设计均参考同源性较高的其他类型蛋白酶[21]。易错PCR无需了解蛋白酶结构功能关系,可快速建立突变体文库,实现角蛋白酶分子改良[22-23]。因此,本研究拟通过易错PCR构建角蛋白酶突变体文库,以期获得活力高、耐温性好的角蛋白酶突变体,提高其在饲料工业中的适用性。
1 材料与方法
1.1 主要试剂、质粒和培养基

筛选培养基:脱脂奶粉20 g/L,琼脂粉15 g/L,高压灭菌15 min后,加入卡那霉素至终浓度50 μg/mL,制作平板,冷却备用。
发酵培养基:LB液体培养基(50 μg/mL卡那霉素)。
1.2 角蛋白酶突变文库的构建
以含角蛋白酶基因的重组质粒pWB980-K-His为模板,使用特异基因的上游、下游引物对角蛋白酶基因进行易错PCR扩增,使用引物对载体pWB980-K-His进行线性化扩增。

表1 引物序列
参考Zhang等[24]的方法,将纯化后的线性化载体和角蛋白酶基因片段进行延长重叠延伸PCR(POE-PCR),以实现质粒多聚化。PCR产物转入枯草芽孢杆菌(Bacillussubtilis)SCK6感受态细胞,稀释涂布于牛奶筛选平板。
1.3 突变体初筛与复筛
为同时获得活性高、热稳定性好的突变体,挑选水解圈与菌落直径比值大于野生型的阳性转化子,摇瓶发酵,检测粗酶液角蛋白酶活性和热稳定性,进行复筛。以100目脱脂羽毛粉(0.5%)为底物,测定经70 ℃热处理5 min后的粗酶液残留酶活性(以未经处理的粗酶液酶活性为100%)。角蛋白酶活性测定参考王德山[15]的方法。
1.4 野生型和突变型角蛋白酶的纯化
以复筛后的正向突变菌株为出发菌,制备粗酶液,经超滤浓缩、镍柱纯化获得目的蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)验证纯化后酶蛋白纯度及分子质量。
1.5 野生型和突变型角蛋白酶的酶学性质研究
真实底物羽毛粉为不溶底物,为保证数据的精准性,酶学性质测定均使用可溶性蛋白-酪蛋白为底物[15],所有处理均设置3个重复。
分别于不同pH(7.0、8.0、8.5、9.0、9.5、10.0、11.0、12.0、13.0)缓冲液体系,55 ℃,测定野生型和突变型角蛋白酶活性,确定适宜pH。以最高酶活性为100%,绘制酶活性随pH变化曲线。所用缓冲体系:Tris-HCL缓冲体系(200 mmol/L,pH 7.0~9.0),硼砂-氢氧化钠缓冲体系(100 mmol/L,pH 9.5~12.0),氯化钾-氢氧化钠缓冲体系(pH 13.0)。
在适宜pH和不同反应温度(40、45、50、55、60、65、70、75 ℃)条件下,测定野生型和突变型角蛋白酶活性,确定适宜反应温度,最高的酶活性定义为100%,绘制相对酶活性随反应温度变化曲线。
纯酶液分别在55、65、75、85 ℃下热处理5 min,适宜条件下测定酶活性,以未经处理的酶活性为100%,计算不同温度处理后的酶活性残留率。
配制不同浓度(0.5、0.8、1.0、1.3、1.5、2.0、2.5、5.0、8.0、10.0、12.0 mg/mL)酪蛋白底物溶液,适宜条件下反应10 min,测定酶活性。利用双倒数法作图,计算动力学参数。
1.6 野生型和突变型角蛋白酶晶体结构模型构建与分析
运用SWISS-MODEL[24]和Discovery Studio Visualizer 4.0对野生型和突变型角蛋白酶晶体进行同源建模及三维结构分析。
2 结 果
2.1 突变型角蛋白酶初筛与复筛
经易错PCR成功构建出角蛋白酶突变体文库(图1),在牛奶平板挑选水解圈与菌落直径比值不小于野生型的转化子共564株进行摇瓶发酵,测定角蛋白酶的热处理后残留酶活性,获得3株正向突变体。由表2可知,角蛋白酶突变体A307V/S346T、R70G、N245K热处理后残留酶活性分别为72.12%、86.12%、74.82%,均高于野生型角蛋白酶(50.32%)。

图1 阳性转化子在牛奶平板上产生的水解圈
2.2 野生型和突变型角蛋白酶纯化后酶蛋白SDS-PAGE分析
野生型和突变型角蛋白酶纯化后酶蛋白的SDS-PAGE分析结果见图2,目的蛋白条带分子质量与预期一致,单一、无杂带,可用于下一步分析。
2.3 野生型和突变型角蛋白酶酶学性质分析
经不同pH条件下蛋白酶活性测定分析,野生型角蛋白酶和角蛋白酶突变体A307V/S346T适宜pH为10,角蛋白酶突变体R70G、N245K适宜pH为11(图3)。这说明突变位点影响了其适宜pH。
不同温度条件下,角蛋白酶突变体A307V/S346T、R70G、N245K适宜反应温度相较野生型发生偏移(图4);同时,角蛋白酶突变体A307V/S346T、R70G、N245K的热稳定性也相应提升(表3)。这说明突变位点均影响了其适宜反应温度和热稳定性。

表2 野生型与突变型角蛋白酶发酵液酶活性及热处理后残留酶活性

M:中分子质量蛋白 marker;1:野生型 wild-type;2:突变体A307V/S346T mutant A307V/S346T;3:突变体R70G mutant R70G;4:突变体N245K mutant N245K。

图3 野生型与突变型角蛋白酶适宜pH

图4 野生型与突变型角蛋白酶适宜反应温度
2.4 野生型和突变型角蛋白酶动力学参数
采用双倒数法作图计算角蛋白酶动力学参数,与野生型角蛋白酶相比,角蛋白酶突变体A307V/S346T、R70G、N245K对底物的亲和力与催化效率均有所提升(表4)。
2.5 野生型和突变型角蛋白酶晶体结构模型构建及分析
角蛋白酶突变体A307V/S346T、N245K的突变位点位于成熟肽区域,直接以成熟肽氨基酸序列建模,以地衣芽孢杆菌的枯草菌溶素(PDB蛋白质数据库ID:3unxA)为模板得到野生型角蛋白酶和角蛋白酶突变体A307V/S346T、N245K晶体的三维结构模型图(图5)。角蛋白酶突变体R70G的突变位点位于前导肽区域,用前导肽与成熟肽氨基酸序列建模,以枯草蛋白酶E(PDB蛋白质数据库 ID:3whi.1.A)为模板进行同源建模得到野生型角蛋白酶和角蛋白酶突变型R70G前导肽的三维结构模型图(图6)。角蛋白酶突变体A307V/S346T、N245K、R70G突变位点分析如图7所示。据结构模型显示,3种突变型角蛋白酶突变前后的蛋白质结构均无明显变化。

表3 野生型与突变型角蛋白酶5 min热处理后残留酶活性

表4 野生型与突变型角蛋白酶动力学参数
3 讨 论
本试验利用易错PCR方法,对角蛋白酶进行定向进化,获得了3株耐温性较好的角蛋白酶突变体A307V/S346T,R70G、N245K,反映出易错PCR在酶分子改造方面具有较好的便捷性。初筛所选转化子水解圈均不小于野生型,但角蛋白酶突变体A307V/S346T、R70G的粗酶液角蛋白酶活性为野生型角蛋白酶的89%左右,仅角蛋白酶突变体N245K的发酵液酶活性相对野生型角蛋白酶提升了19.43%,这说明水解圈与发酵酶活性水平间存在不一致性,复筛十分必要。

图5 野生型角蛋白酶(a)和角蛋白酶突变体A307V/S346T(b)、N245K(c)晶体的三维结构模拟示意图

图6 野生型角蛋白酶(a)和角蛋白酶突变体R70G(b)前导肽的三级结构模拟示意图
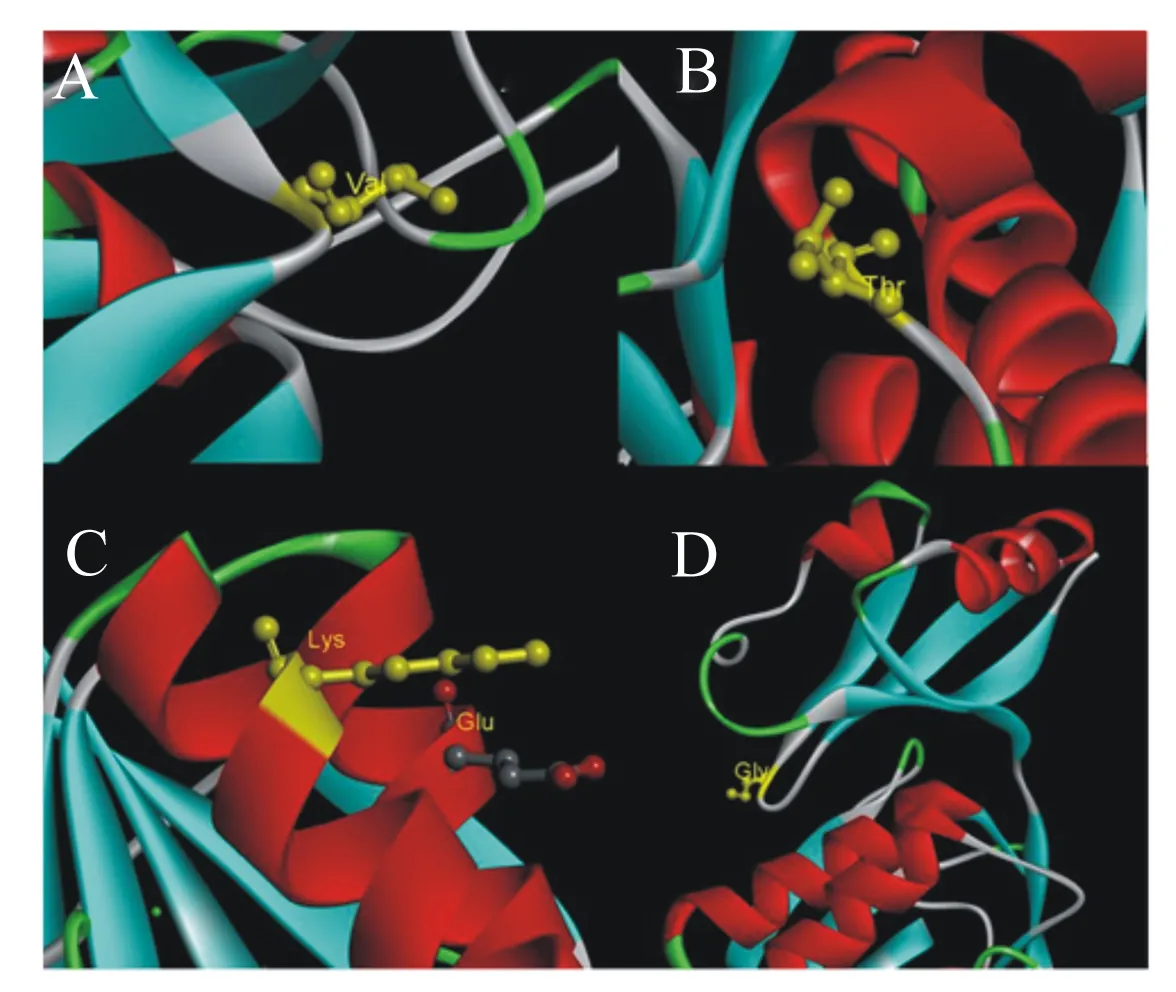
Val:缬氨酸 valine;Thr:苏氨酸 threonine;Lys:赖氨酸 lysine;Glu:谷氨酸 glutamate;Gly:甘氨酸 glycine。
野生型角蛋白酶与3个突变型角蛋白酶在pH 8~12的缓冲体系中酶活性变化趋势平稳。角蛋白酶突变体R70G、N245K的适宜pH后移至11,在pH 12表现出比野生型更高的相对活性,在碱性pH宽泛性增加,利于在碱性条件下快速处理羽毛角蛋白,在洗涤与纺织业也有较好利用前景。但在畜禽小肠pH(6.0~7.0)条件下,野生型和突变型角蛋白酶活性均大幅降低,影响其作用发挥,后续研究需进一步通过定向进化、C端截短、结构域重组等分子改造手段提高其pH稳定性[21-22]。
根据纯化酶蛋白热处理后酶活性残留情况可见,部分突变型角蛋白酶出现75 ℃组活性高于65 ℃组的现象,这可能与在特定条件下出现蛋白酶自溶现象有关[25-26]。与此同时还发现,纯酶热稳定性明显低于粗酶液,可能是粗酶液中细菌代谢产生的蛋白与角蛋白酶结合暂时形成酶-底物复合物[27],构象相对稳定。以上现象产生的原因与机制尚需进一步深入研究。
本研究共获得4个角蛋白酶突变位点。角蛋白酶突变体A307V/S346T的307位的丙氨酸(Ala)位于2个β折叠之间的loop区域,Ala的构象不稳定,被替换为缬氨酸(Val)后,构象的稳定性和氨基酸的疏水性均有所增强。疏水作用是蛋白质折叠主要驱动力[28-29],有利于蛋白质三级结构稳定。Val疏水性增强有助于反应区疏水环境的形成,降低结合状态的自由能,有利于底物与酶的结合,促进催化反应进行,这可能是角蛋白酶突变体A307V/S346T在适宜反应温度与热稳定性提升的同时,还保留了较高活性的主要原因。而346位氨基酸丝氨酸(Ser)与苏氨酸(Thr)的结构功能均较为接近,可能不是影响酶学性质改变的主要突变因素。角蛋白酶突变体N245K的245位氨基酸天冬酰胺(Asn)位于α螺旋,Asn在高温下易发生脱酰胺作用,不利于蛋白质的热稳定性,嗜热蛋白中一般含有较少的Asn和谷氨酰胺[30-32]。同时,已有研究揭示增加蛋白质表面负电荷氨基酸可提高酶稳定性[33],Asn被替换为赖氨酸(Lys)后可能更有利于α螺旋的稳定。Lys在蛋白表面引入负电荷可能通过静电作用力,形成离子键,稳定了蛋白质结构。角蛋白酶突变体R70G的70位氨基酸位于酶前导肽2个β折叠间的loop上,由精氨酸(Arg)变为结构最为简单的甘氨酸(Gly),侧链仅有1个氢原子,空间位阻小。空间位阻的改变可能对前导肽结构起优化作用,并进一步影响成熟肽空间结构,从而提升了突变体的热稳定性。已有研究探明前导肽与脂肪酶的热稳定性相关[34],但在角蛋白酶的研究中多将前导肽与酶活性进行关联分析,前导肽与蛋白酶稳定性间的关系尚无相关报道,该研究结果或许可为今后耐热蛋白酶理性设计提供新的思路。
4 结 论
本试验通过易错PCR成功对地衣芽胞杆菌CP-16来源的角蛋白酶进行了定向进化,筛选到热稳定性提升的角蛋白酶突变体,拓展了角蛋白酶的适用性,并分析了其热稳性提高的分子基础,为耐热蛋白酶理性设计提供新思路。

