GKN2在胃癌细胞增殖、转移中的作用及机制
廖雪洪,林贤东,潘 超,叶韵斌,陈 刚,林洁琼,胡 丹,夏 言,郑雄伟
胃癌是最常见的恶性消化道肿瘤,其发病率和病死率均较高[1]。胃癌属于上皮来源肿瘤,由胃上皮细胞及祖细胞不断克隆增殖形成[2-3]。幽门螺杆菌(helicobacter pylori,HP)、EBV等外界因素引起胃黏膜屏障破坏导致的胃炎,已被证实是最常见“肠型”胃癌的危险因子[4]。目前,胃炎向胃癌进展的机制尚未清楚。胃动蛋白家族(gastrokines, GKN)是一类特异性表达于正常胃黏膜上皮的分泌小蛋白,具有促进胃黏膜上皮细胞分裂增殖和移行、保护胃黏膜和促进受损黏膜修复的功能[5]。胃动蛋白2(gastrokine 2, GKN2)作为GKN的重要成员之一,是胃黏液层的组成成分之一,其与TFF1在胃黏膜表面形成一个异源二聚体复合物,保护胃黏膜和促进受损黏膜修复[5]。近期研究显示,GKN2在清除HP和抑制胃癌细胞生长中起重要作用。本实验重点探讨GKN2对胃癌细胞生物学功能的影响及可能机制,为临床与病理医师提供参考。
1 材料与方法
1.1 材料与试剂收集2016年福建医科大学附属肿瘤医院存档的8例胃癌及癌旁组织。胃癌细胞株AGS、SGC-7901、MKN45、BGC-823、NCI-N87、MKN28均购自上海细胞库。F12 HAM'S培养基、RPMI培养基(厦门Hyclone公司);北美胎牛血清(美国GIBCO公司);胰蛋白酶(美国Life公司);RNA提取试剂盒(美国Promega公司);逆转录试剂盒(日本Takara公司);FastStart Universal SYBR Green Master(美国Roche公司);实时无标记细胞功能分析检测板(E-plate16)(福州世豪公司)。
1.2 慢病毒表达系统LVCON238作为阴性对照病毒,过表达慢病毒载体GV358(图1),AgeI/AgeI酶切,购自上海吉凯基因公司。
1.3 细胞培养及慢病毒感染胃癌细胞株AGS、SGC-7901采用F12培养基,MKN45、MKN28、BGC-823、NCI-N87采用RPMI 1640培养基培养,经37 ℃ 5%CO2培养,2~3天/次。将细胞消化接种于24孔板中,阴性对照组加入LVCON238病毒液2 μL、F12培养液250 μL、增强液250 μL、5 μg polybrene混匀培养;GKN2过表达组加入LV-GKN2病毒液25 μL、F12培养液250 μL、增强液250 μL、5 μg polybrene混匀培养。嘌呤霉素待阳性克隆形成,扩大培养,建立稳转细胞系,分别命名为阴性对照组:AGS-CON、SGC-7901-CON,GKN2过表达组:AGS-GKN2、SGC-7901-GKN2,荧光显微镜下观察细胞荧光蛋白(green fluorescent protein, GFP)的表达,qRT-PCR及Western blot法验证GKN2的表达情况。

图1 过表达慢病毒载体图谱
1.4 方法
1.4.1qRT-PCR 收集稳转细胞株,按照Trizol法提取细胞总RNA。取1 μg总RNA用RevertAid First Strand cDNA Sythesis Kit按照试剂盒说明书逆转录为cDNA。取1 μL的cDNA用Lightcycler 480 SYBR Green I Master按照试剂盒说明书进行qRT-PCR,扩增程序:95 ℃ 10 min,95 ℃ 60 s,55 ℃ 30 s,72 ℃ 30 s,合计40个循环;GAPDH作为内参基因。GKN2正向引物:5′-GCCTGATGTACTCAGTCAACC-3′;反向引物:5′-TAGTTCTCCACCGTGTCTCC-3′。GAPDH正向引物:5′-CCAGAACATCATCCCTGCCT-3′,GAPDH反向引物:5′-CCTGCTTCACCACCTTCT TG-3′,mRNA的相对定量采用2-ΔΔCt法。
1.4.2Western blot法 将细胞冰上裂解,超声离心后取上清,BCA法测定蛋白浓度,并进行聚丙烯酰胺凝胶电泳,湿法转印至硝酸纤维素膜上。3%BSA封闭1 h后分别加入稀释好的一抗4 ℃过夜,TBST洗涤3次,加入二抗封闭120 min,TBST洗涤3次后ECL发光试剂盒显色,凝胶成像系统照相,分析灰度值。
1.4.3实时无标记细胞分析技术 使用RTCA S16系统进行检测,在E-Plate 16的孔中加入50 μL培养基,检测基线,而后加入100 μL混合均匀的细胞悬液,置于超净台中室温放置30 min,最后放入培养箱中的RTCA S16 Station,开始进行细胞增殖的实时动态检测。
1.4.4克隆形成实验 将对数生长期细胞消化后,各取2 000个胃癌细胞接种到6孔板中,10~15天后,吸弃培养液,PBS洗涤,甲醇固定30 min,0.1%结晶紫染色10~20 min,PBS洗涤,计算克隆数。
1.4.5划痕实验 胰酶消化,接种到装有划痕愈合小室Culture-Insertu-Dish培养小盘,待长满后弃原培养液,拔掉划痕愈合小室,PBS浸洗,加入培养液,拍照;37 ℃ 5%CO2培养48 h后,显微镜下观察创伤愈合情况并拍照。
1.4.6Transwell法检测细胞迁移、侵袭 在Transwell下室膜上涂抹10 μL纤连蛋白,37 ℃培养4 h。胰酶消化细胞,取100 μL细胞悬液(每毫升4×105个,无血清)加至Transwell小室的上室中,下室加入600 μL含30%胎牛血清的F12培养基,各设3个复孔。37 ℃ 5%CO2孵育24 h后取出Transwell下室,用棉签轻轻擦去膜上面未迁移的细胞,PBS浸洗,滤膜甲醇固定30 min,晾干后,0.1%结晶紫染液染色,拍照。进行侵袭实验时,将上室用Matrigel预涂,其他步骤同迁移测定实验。

2 结果
2.1 胃癌、癌旁组织和细胞株中GKN2的表达Western blot法检测结果显示,GKN2在癌旁组织中高表达,在胃癌组织中的表达明显下调甚至缺失。同时利用Western blot、qRT-PCR检测胃癌细胞株AGS、SGC-7901、NCI-N87、MKN28、BGC-823、MKN45及正常胃黏膜细胞株GES-1中GKN2蛋白及mRNA表达量。本组结果显示,GKN2呈高表达,而胃癌细胞株AGS、SGC-7901、NCI-N87、MKN28、BGC-823、MKN45中GKN2呈低表达或表达丢失,与GKN2在胃癌组织中的表达一致(图2、3)。
2.2 GKN2过表达胃癌细胞株的构建及验证选取AGS和SGC-7901作为实验细胞株,分别以LV-GKN2和空载质粒LVCON238慢病毒感染细胞株构建GKN2过表达组AGS-GKN2和SGC-7901-GKN2及对照组AGS-CON和SGC-7901-CON,筛选,荧光显微镜下观察3周后,肉眼观察荧光转染率达90%以上,利用Western blot法和qRT-PCR检测GKN2在各细胞株中的表达,验证了GKN2过表达组的表达量明显增加,稳转细胞株建立(图4、5)。

图2 A.Western blot法检测胃癌组织及正常胃黏膜组织中GKN2的表达量;B. Western blot法检测正常胃黏膜细胞GES-1和各胃癌细胞株中GKN2的表达量:T.胃癌组织;N.正常胃黏膜组织

图3 qRT-PCR检测正常胃黏膜细胞和各胃癌细胞株中GKN2 mRNA的表达量

图4 AGS稳转细胞株建立:A.qRT-PCR检测稳转细胞株GKN2 mRNA的表达;B.Western blot法检测稳转细胞株GKN2蛋白表达量,AGS-GKN2组比AGS-CON组GKN2明显过表达;C.荧光显微镜下观察AGS-CON、AGS-GKN2组荧光蛋白表达,慢病毒转染成功率在90%以上

图5 SGC-7901稳转细胞株建立:A.qRT-PCR检测稳转细胞株GKN2 mRNA表达量,SGC-7901-GKN2组比SGC-7901-CON组GKN2明显过表达;B. Western blot法检测稳转细胞株GKN2 蛋白表达量,SGC-7901-GKN2组比SGC-7901-CON组的GKN2明显过表达;C.荧光显微镜下观察SGC-7901-CON、SGC-7901-GKN2组荧光蛋白表达,慢病毒转染成功率在90%以上
2.3 GKN2过表达对胃癌细胞增殖能力的影响建立稳转细胞株后,采用RTCA系统实时检测GKN2过表达组及对照组的细胞增殖,结果显示,在AGS和SGC-7901细胞系中GKN2过表达显著抑制胃癌细胞的增殖活性(P<0.05,图6)。此外,平板克隆形成实验表明,与对照组相比,GKN2过表达后AGS和SGC-7901细胞克隆形成数显著降低(P<0.05,图7)。
2.4 GKN2对胃癌细胞转移能力的影响Transwell迁移实验结果显示,AGS细胞穿过聚碳酸酯多孔滤膜的AGS-CON和AGS-GKN2细胞数量分别为501.33±45.59和187.33±31.23,差异有统计学意义(P<0.05)。SGC-7901细胞穿过聚碳酸酯多孔滤膜的SGC-7901-CON和SGC-7901-GKN2细胞数量分别为587±28.80和85±12.20,差异有统计学意义(P<0.05,图8A)。
本实验在滤膜上室侧铺上基质胶,细胞先分泌基质金属蛋白酶(matrix metalloproteinase, MMP)将基质胶降解,才能通过滤膜进入下室。实验进行48 h后在显微镜下拍照,进入下室的细胞量多则可反映肿瘤细胞的侵袭能力强。AGS细胞穿过基质胶的AGS-CON和AGS-GKN2细胞数量分别为83.67±21.89、39.00±12.20,差异有统计学意义(P<0.05)。SGC-7901细胞穿过基质胶的AGS-CON和AGS-GKN2细胞数量分别为560±28.18,75.33±16.75,差异有统计学意义(P<0.05,图8B)。

图6 RTCA系统显示GKN2过表达对胃癌细胞增殖活性的影响:A.AGS细胞株;B.SGC-7901细胞株
本组采用划痕实验检测GKN2对胃癌细胞创伤愈合能力的影响,结果显示,48 h后GKN2过表达组的划痕愈合距离明显大于对照组(P<0.05,图8C),提示过表达GKN2明显抑制胃癌细胞的转移能力。
2.5 GKN2过表达对胃癌细胞增殖及转移相关分子水平的影响Western blot法检测结果显示,GKN2过表达明显抑制胃癌细胞中增殖相关蛋白PCNA、Survivin、BCL-2的表达水平(P<0.05)。转移相关分子研究结果显示,GKN2过表达后,胃癌细胞中的Timp2表达水平升高,MMP-7和MMP-9表达水平降低,差异有统计学意义(P<0.05,图9)。
2.6 GKN2过表达对PI3K/AKT/PTEN/mTOR通路激活水平的影响信号通路磷酸化水平反映通路被激活情况,磷酸化水平越高通路激活越明显。PI3K/AKT/PTEN/mTOR通路是一条公认的与肿瘤相关的通路。胃癌细胞株中GKN2过表达可下调磷酸化PI3K、磷酸化AKT、mTOR的表达水平,上调PTEN表达水平(图10);提示GKN2可能通过抑制PI3K/AKT/PTEN/mTOR通路的激活水平,进而发挥抑制胃癌细胞恶性生物学行为。

图7 平板克隆实验显示GKN2过表达组的克隆形成数及克隆细胞群均少于对照组:A.AGS细胞株;B.SGC-7901细胞株
3 讨论
GKN作为肿瘤抑制因子,在结构上具有高度保守性,在动态平衡和抑制胃肿瘤中发挥作用。GKN2作为GKN家族的重要成员,参与调控消化道上皮的增生从而维护黏膜的完整,在消化道上皮的稳态中发挥重要作用[5-7]。
GKN2基因位于染色体2p13,含有5个外显子可以编码相对分子质量为1.83×104的蛋白。GKN2是胃分泌的特异性蛋白,并带有BRICHOS结构域,其已被证实与肿瘤相关[5-6]。据文献报道,在

图8 GKN2过表达对胃癌细胞转移活性的影响:A.Transwell迁移实验示GKN2过表达组纵向迁移细胞数明显低于对照组;B.Transwell侵袭实验示GKN2过表达组纵向侵袭细胞数明显低于对照组;C.划痕实验示GKN2过表达组横向迁移能力明显低于对照组正常人胃黏膜中GKN2呈高表达,但在HP感染直到胃部肿瘤形成的过程中GKN2表达下降,根除HP后GKN2表达明显上调。GKN2是胃黏液层的组成之一,与TFF1在胃黏膜表面形成异源二聚体复合物,保护胃黏膜和促进受损黏膜修复[5]。本实验证实GKN2在胃癌组织和细胞株中表达明显下调甚至缺失。上述结果表明,GKN2在维护胃黏膜的完整性和抑制肿瘤中起重要作用。

图9 GKN2过表达下调胃癌细胞增殖及转移相关蛋白的表达
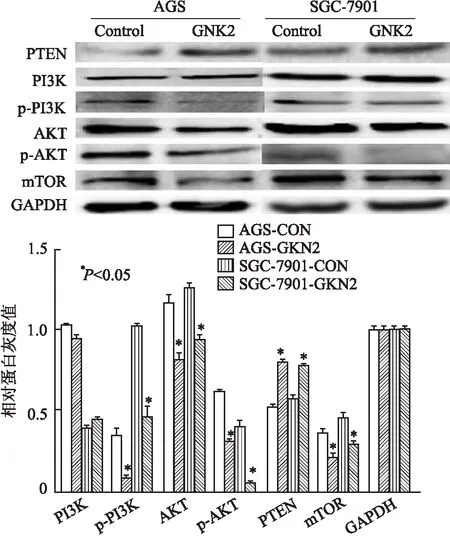
图10 GKN2下调PI3K/AKT/PTEN/mTOR通路的激活水平
文献报道GKN2在胃癌细胞系中表达均下调或不表达。本实验将GKN2高表达病毒载体转染到人胃癌细胞株AGS、SGC-7901中,结果显示,GKN2过表达抑制胃癌细胞的增殖和侵袭能力。目前已经证实GKN1可以抑制胃癌细胞的增值、迁移和侵袭[8],GKN2是否也有相同的作用呢?本实验发现GKN2过表达对胃癌细胞增殖、迁移和侵袭有显著阻滞作用,提示GKN2与GKN1一样具有抑制胃癌细胞增值、迁移与侵袭作用。有研究表明,GKN2可能抑制超氧化物酶,导致活性氧水平升高和促进活性氧诱导的线粒体膜电位受损引起胃癌细胞凋亡,且可通过与HSP70的结合抑制NF-κB和激活JNK信号通路,从而导致胃癌细胞凋亡,抑制胃癌细胞的增殖[9]。GKN2和TFF1形成的二聚体通过增强Caspase-3/Caspase-7的活性促进细胞死亡[10]。GKN2通过下调GSK3β蛋白表达,下调Snail的表达,从而抑制胃癌细胞的上皮-间质转化。根据以上研究结果,GKN2在胃癌增殖和侵袭转移中发挥重要作用,是胃癌重要的抑制基因。
PI3K/AKT/PTEN/mTOR通路是一条经典的促进肿瘤进展的通路,在胃癌中常常过度激活,在胃癌发生、发展中起重要作用[11]。PTEN是PI3K/AKT/PTEN/mTOR通路的负调控分子,可催化PI3K脱磷酸化,当其缺失时磷酸化的PI3K增加,PI3K/AKT/PTEN/mTOR通路进一步激活。mTOR是细胞生长和增殖的关键调节分子[12],有研究表明,mTOR及其磷酸化形式在胃癌组织中过表达,其阳性率与淋巴结是否转移及患者预后明显相关,是独立的预后因子[13]。研究发现,GKN2过表达后可以下调磷酸化PI3K、磷酸化AKT、mTOR的表达,上调抑制因子PTEN的表达,抑制通路的过度激活。因此,本实验推测GKN2可能通过下调经典通路PI3K/AKT/PTEN/mTOR的过度激活水平,抑制胃癌细胞的增殖、侵袭、转移等生物学功能。
综上所述,GKN2在胃癌的发生、发展中起重要作用,可能是具有潜力的肿瘤抑制基因,诠释GKN2的作用机制将有助于进一步阐明胃癌的发病机制,为胃癌治疗的分子靶点提供理论依据。

