人参茎叶总皂苷的人肠内细菌生物转化△
马丽媛,王洪平,杨秀伟
北京大学 药学院 天然药物学系/天然药物及仿生药物国家重点实验室,北京 100191
传统中药人参Ginseng Radix et Rhizoma系五加科多年生草本植物人参PanaxginsengC.A.Mey.的干燥根和根茎,其主要成分为人参皂苷(ginsenoside)[1],具有延缓衰老、抗疲劳、保护肝脏和心血管系统、抗应激、抗诱变、抗癌、抗糖尿病、抗氧化、抗炎等药理作用[2]。研究表明,人参茎叶总皂苷[3-7]与人参根和根茎总皂苷[1,8]具有类似的达玛烷型三萜皂苷组成,因此,人参茎叶总皂苷有广阔的开发利用前景。在长期的临床实践中,中药形成了以口服为主的给药途径,其化学成分吸收进入系统循环之前往往要在肠道菌群的作用下活性化,才能更好地发挥作用,这一机制的阐明为基于中药化学成分体内生物转化寻找新药先导化合物开辟了新途径[9]。人参茎叶皂苷经甘蔗镰孢Fusariumsacchari转化后可生成稀有抗肿瘤活性皂苷[10];经塔宾曲霉菌Aspergillustubingensis转化可生成稀有人参皂苷Rh4(ginsenoside Rh4)及其苷元[11]。本实验采用液相色谱-电喷雾离子源-四极杆-飞行时间质谱法(LC-ESI-Q-TOF-MS)研究人参茎叶总皂苷的人肠道细菌生物转化,为源于人参茎叶皂苷的现代中药定向研究提供理论和实验依据。
1 材料
1.1 仪器
1290型超高效液相色谱仪(配有1290系列二元泵、在线脱气机、自动进样阀和柱温箱)、Q-TOF 6540型质谱仪[配有安捷伦AJS电喷雾离子源(ESI)、Agilent MassHunter工作站]、Agilent ZORBAX RRHD Eclipse Plus C18型色谱柱(100 mm×3 mm,1.8 μm,配有Phenomenex Security GuardTMULTRA保护柱)均购于安捷伦公司;Mettler XS105DU型十万分之一电子天平(瑞士Mettler-Toledo公司);Advantage A10型制水机(美国Millipore公司);KQ5200型超声波清洗仪(功率:200 W,频率:40 kHz,昆山市超声仪器有限公司);质谱级乙腈、甲醇和甲酸购于美国Fisher科技公司。
1.2 试药
人参茎叶采自吉林省集安人参种植场,由吉林省中医中药研究院中药研究所李龙云研究员鉴定为五加科人参PanaxginsengC.A.Mey.的茎叶。
人源肠内菌丛培养基、胰蛋白胨、朊胨、消化血清粉、酵母浸膏、牛肉膏、牛肝浸出粉均购于北京市海淀区微生物培养基制品厂;硫代乙醇酸钠(广西新港化工厂);L-半胱氨酸盐酸盐(第二军医大学政祥医用科学实业服务部);可溶性淀粉(成都宏博有限公司);磷酸二氢钾、氯化钠、葡萄糖购于北京化工厂。
对照品人参皂苷Rh20(G-Rh20)[5]、G-Rf2、G-Re[7]、3β,6α,12β,25-四羟基-达玛-20(22)E-烯-6-O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃葡萄糖苷(THDRG)[6]、G-Rh14[4]、G-Rd[7]、G-Rh15[4]、G-F2[7]、G-Rh4和G-Rg5[6]均由本课题组从人参茎叶总皂苷中分离鉴定;20(S)-G-Rg2、20(R)-G-Rg2、20(S)-G-Rh1、20(S)-25-hydroxy-protopanaxatriol[20(S)-25-OH-PPT]、20(R)-G-Rh1、20(R)-25-hydroxy-protopanaxatriol[20(R)-25-OH-PPT]、G-F1、G-Rh19、20(R)-G-Rh19、G-Rg6、20(22)E-G-F4、G-Rk3、20(S)-G-Rg3、20(R)-G-Rg3、G-Rh16、20(S)-PPT、20(R)-PPT、G-Rk1、20(S)-G-Rh2、20(R)-G-Rh2、异G-Rh3(Iso-G-Rh3,98)[12]和3β,12β,24S-三羟基-达玛-20(22)E,25-二烯-3-O-β-D-吡喃葡萄糖苷(ginsenoslaloside-I,THDG)[13]从人参茎叶总皂苷的NaOH水解产物中分离鉴定;20(S)-25-OH-原人参二醇[20(S)-25-OH-PPD][14]从人参茎叶总皂苷的硫酸水解产物中分离鉴定;G-Rg1、G-Rf、三七皂苷-R2(NG-R2)、G-Rb1、G-Rc和G-Rb2从人参根和根茎[15]或红参[16]中分离鉴定;G-CK从人参果中分离得到[17]。以上各对照品纯度经液相色谱-质谱法(LC-MS)测定均大于98%。
2 方法
2.1 人参茎叶总皂苷的制备
人参茎叶粗粉及总皂苷按照专利方法制备[18]。取干燥的人参茎叶粗粉(15 kg),用水煎煮3次,加水量依次为原料的20、15、10倍量,分别提取3、2、1.5 h。合并煎煮液,滤过,减压浓缩,加入 3倍量95%乙醇水溶液,沉淀杂质,上清液用活性炭脱色,回收乙醇,得提取物(2.625 kg)。将提取物于10倍量水中溶解,加入氯化钠使其达到饱和后进行盐析,静止过夜,滤得沉淀,即为人参茎叶总皂苷(210 g)。
2.2 厌氧培养基(GAM)和人肠内菌丛的制备
2.2.1GAM配制 准确称取胰蛋白胨10 g、朊胨10 g、消化血清粉13.5 g、酵母浸膏5 g、牛肉膏2.2 g、牛肝浸出粉1.2 g、葡萄糖3 g、磷酸二氢钾2.5 g、氯化钠3 g、可溶性淀粉5 g、L-半胱氨酸盐酸盐0.3 g和硫代乙醇酸钠0.3 g,加入适量蒸馏水,用恒温磁力搅拌器使其充分溶解并定容至1000 mL,用1 mol·L-1NaOH水溶液调pH为7.1~7.2,即为GAM。
2.2.2人肠内菌丛的制备 人肠内菌丛制备按标准操作规程[19]进行。取10号自封袋,充满氮气,置换自封袋内的气体,挤压出气体后再通入氮气。如此重复2次,再次充满氮气,将健康志愿者一次排出的所有粪便装入自封袋,封口并用手挤压自封袋使粪便均质化。通过厌氧箱的置换仓将粪便转移至厌氧无菌操作条件下,取粪便3~5 g,放入到200 mL加热沸腾并立即冷却的GAM中(250 mL具塞锥形瓶),通入氮气去除空气,加塞封口。置厌氧培养箱中,37 ℃下培养24 h;从250 mL具塞锥形瓶中取出菌液1 mL,加至已装有灭菌GAM的具塞锥形瓶中,37 ℃活化培养24 h,取出,置于4 ℃冰箱中保存,即为人肠内菌混合菌丛。
2.3 人参茎叶总皂苷的人肠内细菌生物转化及其产物萃取
准确称取人参茎叶总皂苷80 mg,用二甲基亚砜400 μL充分溶解。在厌氧培养箱内,向3只(标记为1~3号瓶)100 mL具塞锥形瓶内分别加入GAM 40 mL,向1、2号瓶内各加入菌液1 mL,再向1、3号瓶内加入人参茎叶总皂苷溶液200 μL。1~3号瓶分别标记实验组、空白组和对照组。瓶口用封口膜密封,转移至摇床,在37 ℃、100 r·min-1条件下培养48 h。上述实验平行进行3次。培养结束后,加入乙酸乙酯灭活,用等体积乙酸乙酯萃取3次,再用等体积正丁醇萃取2次,合并萃取液,减压浓缩,得到转化产物萃取样品。
2.4 供试品溶液制备
取2.1项下人参茎叶总皂苷1 mg,用甲醇1 mL充分溶解;取2.3项下每个处理转化产物萃取样品,分别用甲醇5 mL充分溶解。各待测样品分析前在10 000×g离心10 min。用0.22 μm微孔滤膜滤过,作为供试品溶液。
2.5 对照品溶液制备
精密称取各对照品适量,用甲醇溶解,配制成对照品储备液。分别精密吸取各对照品储备液适量,配制成各对照品质量浓度为50~200 ng·mL-1的混合对照品溶液。
2.6 分析条件
2.6.1HPLC条件 Agilent 1290型液相色谱仪,流动相为水(A)-乙腈(B),梯度洗脱(0~2 min,80%~70%A;2~18 min,70%~10%A),检测波长为203 nm,柱温为45 ℃,进样量为1 μL,体积流量为0.8 mL·min-1,分流比为1∶1。
2.6.2MS条件 AJS ESI源,负离子模式;干燥气温度为300 ℃;干燥气体积流量为5 L·min-1;雾化气压力为241.33 kPa;鞘气温度为400 ℃;鞘气体积流量为12 L·min-1;毛细管电压为3500 V;喷嘴电压为1500 V;毛细管出口电压为280 V。
2.7 分析物数据库的建立和数据处理
2.7.1分析物数据库的建立 依据中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)、天然产物词典(dictionary of natural product,http://www.chemnetbase.com)数据库和文献检索人参茎叶的化学成分,并结合ChemSpider、PubChem、ChemBook数据库化合物信息,建立人参茎叶的化学成分信息库,包括化合物的名称、分子式、相对分子质量和CAS号等。
2.7.2数据处理 将LC-ESI-Q-TOF-MS采集的原始数据导入分析软件进行碎片和相对分子质量匹配,根据高分辨质谱信息对其分子式进行推导,偏差不得大于5×10-6,推导可能的裂解碎片,最终确定分析物。
3 结果与分析
3.1 对照品的结构表征
对照品溶液在负离子模式下的LC-ESI-Q-TOF-MS总离子流图见图1,化合物信息见表1,部分化合物结构见图2。

图1 对照品溶液总离子流图
40个对照品可分为PPD型和原人参三醇(PPT)型。其中,属于PPT型的有化合物1、5、7、9、20、23、24、27、33、35、36、38、41、45、50、59、63、65~67、73、76、80、82和83;属于PPD型的有化合物30、34、39、51、74、77、78、88、89、91~95和98。这2个类型化合物的苷元具有特征性的质谱碎片,易于识别[20]。在负离子检测模式下,明显可见分子结构中丢失葡萄糖基(mz162)、鼠李糖基(mz146)、阿拉伯糖基或木糖基(mz132)的碎片及mz475.3为PPT的碎片等。
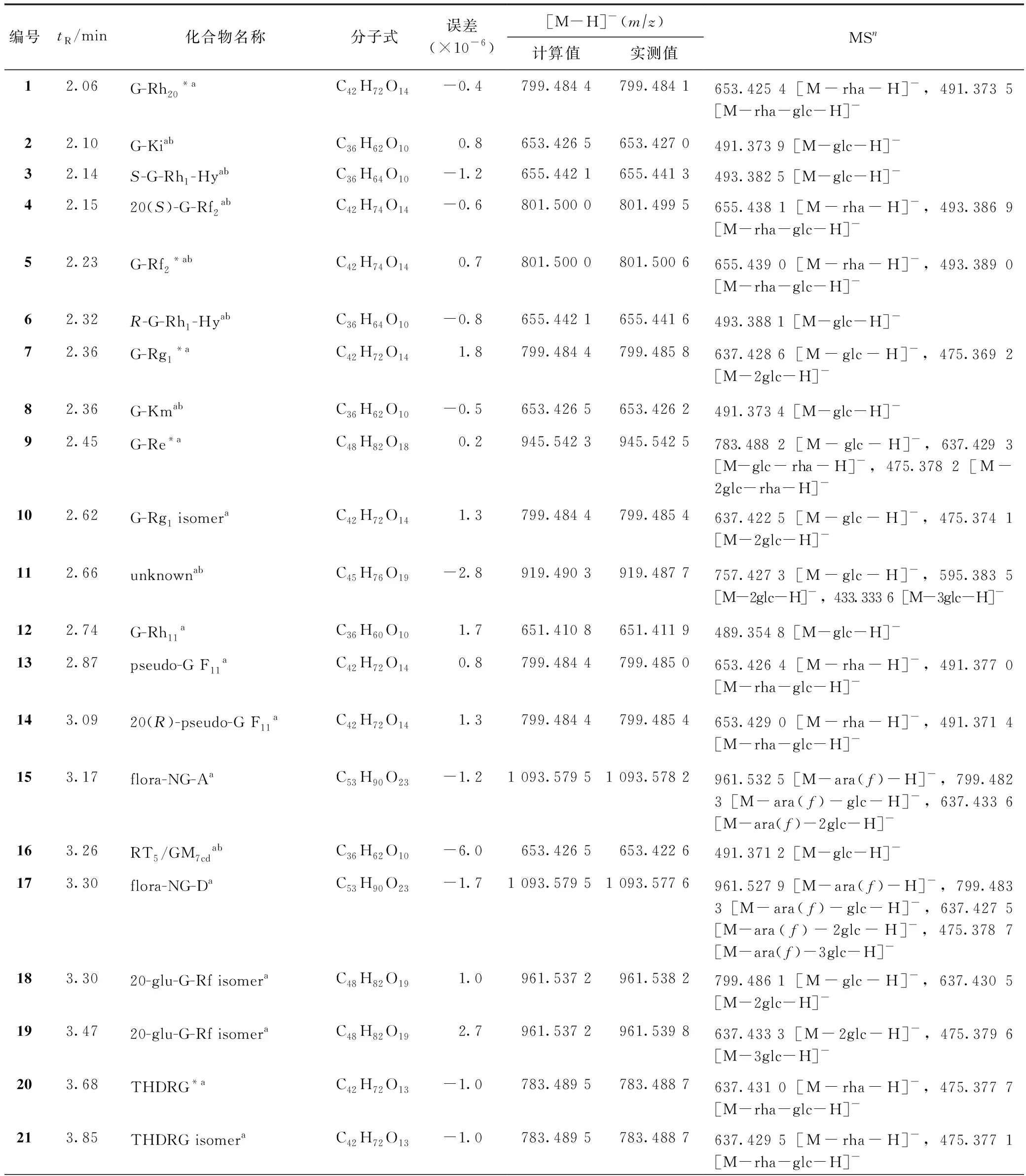
表1 LC-MS负离子模式各分析物的质谱数据
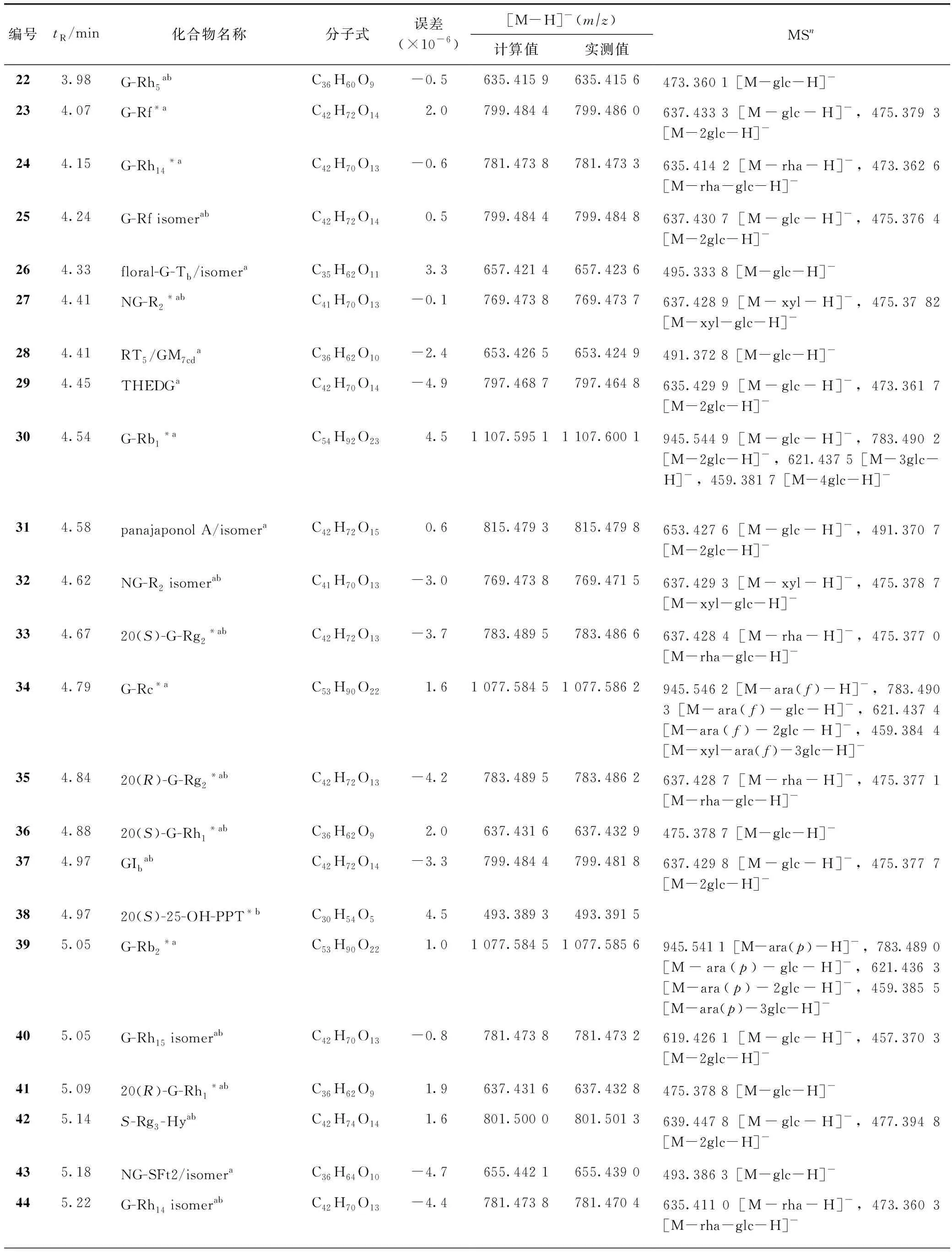
续表1

续表1

续表1

续表1

图2 人参达玛烷型三萜对照品及其人参茎叶中部分达玛烷型三萜类的化学结构
3.2 人参茎叶总皂苷化学结构的表征
负离子模式下人参茎叶总皂苷总离子流图见图3。通过与对照品比对和数据解析,共确定83个化合物,定性结果见表1。没有检测到人参根或红参中存在的齐墩果酸型人参皂苷,但检测到人参根中不存在的奥柯梯隆(ocotillol)型皂苷,如拟人参皂苷F11(pseudo-G F11,13)[21-23]和20(R)-拟人参皂苷F11[20(R)-pseudo-G F11,14][23]。与人参根中的皂苷相比[20,24],人参茎叶总皂苷中含有更多低极性的人参皂苷和/或人参达玛烷型三萜,如20(S)-G-Rh1(36)、20(R)-G-Rh1(41)、G-F1(50)、20(S)-G-Rg3(77)、20(R)-G-Rg3(78)、20(S)-G-Rh2(94)和20(R)-G-Rh2(95)。此外,人参茎叶总皂苷中还含有大量的异构体,如相对分子质量为782的化合物24、40、44、59、71、75和79,相对分子质量为784的化合物20、21、33、64、74、77和78,相对分子质量为800的化合物1、7、10、13、14、25、37、46、52和55等。因此,人参茎叶皂苷复杂体系中含有更多低极性人参皂苷和/或人参达玛烷型三萜,或稀有人参皂苷(rare ginsenoside),更易于吸收进入体循环。
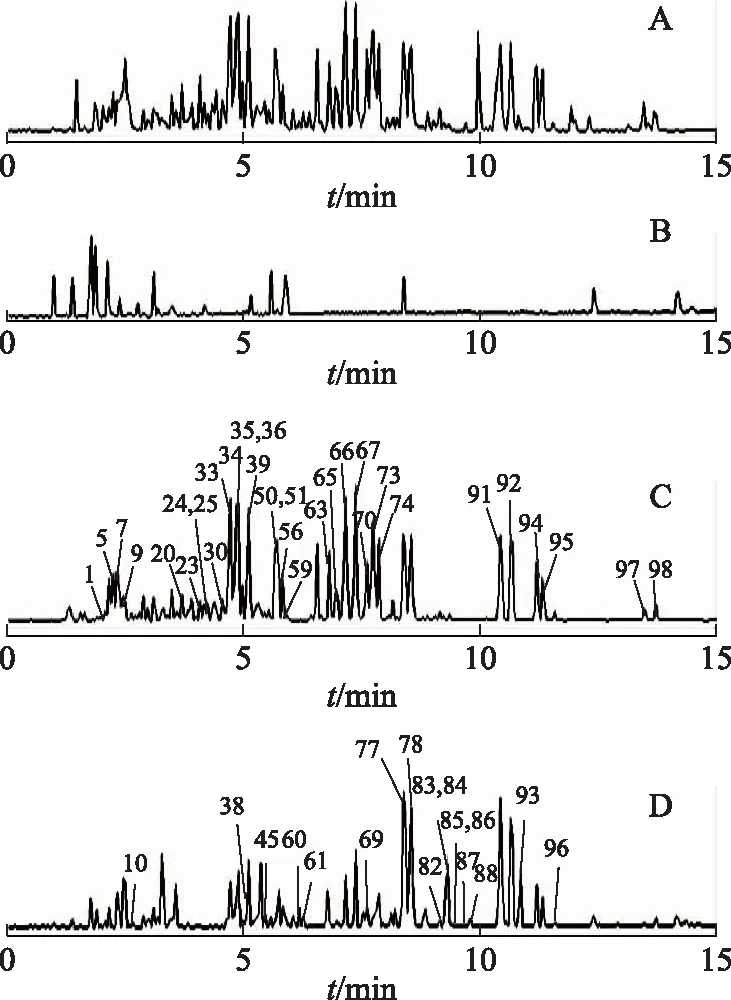
注:A.人参茎叶总皂苷+培养基;B.培养基+人肠内菌液;C.人参茎叶总皂苷甲醇溶液;D.人参茎叶总皂苷的人肠内菌转化产物。图3 人参茎叶总皂苷及其人肠内细菌转化产物LC-ESI-Q-TOF-MS总离子流图
3.3 人参茎叶总皂苷的人肠内菌转化产物分析
按2.6项下条件对人参茎叶总皂苷的人肠内菌转化产物进行分析,负离子模式下的总离子流色谱图见图3。通过与对照品比对和数据解析,共确定67个化合物,定性结果见表1。检出了在人参茎叶总皂苷组分中没有检出的15个化合物,分别为20(S)-25-OH-PPT(38)、20(R)-25-OH-PPT(45)[25]、G-O(60)[26-28]、绞股蓝皂苷Ⅸ(61)、绞股蓝皂苷ⅩⅦ(69)[28]、25-OH-G-Rh2(70)[29]、20(22)E-G-Rg9(71)[30]、G-Rs3(84)、20(R)-G-Rs3(86)[31]、G-Mc(85)、G-Y(87)[32]、G-Mx(90)[28]、20(S)-25-OH-PPD(92)[25]、G-CK(93)、G-CK异构体(96)[33]。这些化合物可能是由人参茎叶中的某些人参皂苷经人肠内细菌作用转化而来。通过对比分析人参茎叶总皂苷及其人肠内细菌转化产物,发现PPD型皂苷主要有2条生物转化途径,其中最主要的途径为G-CK(93)的转化途径。在人参茎叶总皂苷的提取离子流图(EIC)中未见G-CK(mz621.5)的峰,但在转化后的产物中出现,且信号较强(图4)。转化后的产物中亦明显可见绞股蓝皂苷ⅩⅦ(69,mz945.5)的峰(图4)。同时结合绞股蓝皂苷ⅩⅦ(69)、G-Mc(85)、G-Y(87)和G-Mx(90)的分子结构,初步推测了PPD型皂苷转化为G-CK的途径(图5)。

注:A.G-CK;B.绞股蓝皂苷ⅩⅦ。图4 人参茎叶总皂苷及其人肠内细菌转化产物中G-CK及绞股蓝皂苷ⅩⅦ离子色谱图
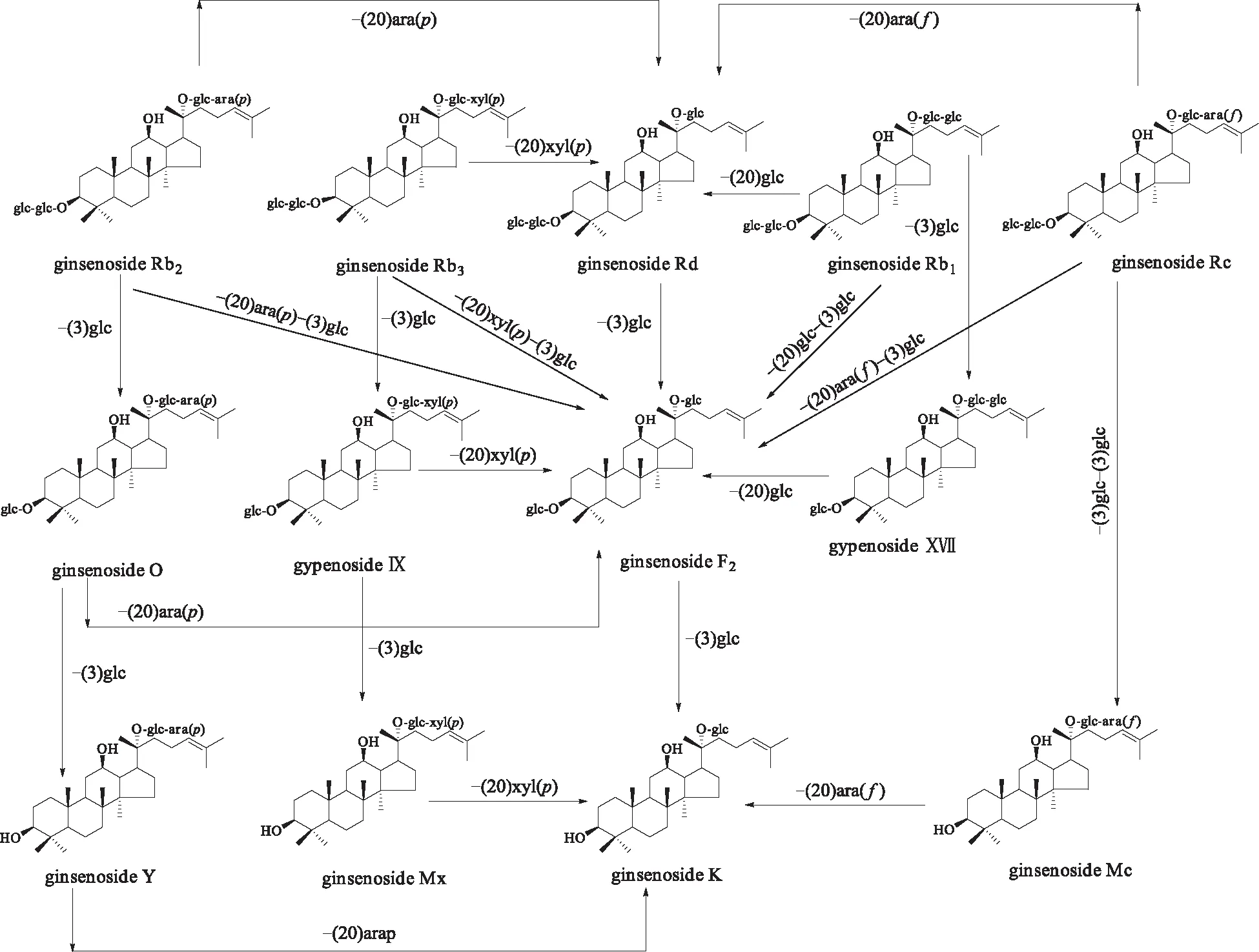
图5 人肠道细菌作用下PPD型皂苷转化为G-CK的途径
此外,在EIC中,发现转化后的产物中G-Rg3、G-Rk1和G-Rg5的含量也显著升高(图6)。因此,推测PPD型皂苷的另外一条转化途径是通过转变为G-Rg3来进行的,其可能的转化途径见图7。

注:A.G-Rg3;B.G-Rk1和G-Rg5。图6 人参茎叶总皂苷及其人肠内细菌转化产物中G-Rg3、G-Rk1和G-Rg5离子色谱图

图7 人肠道细菌作用下PPD型皂苷转化为G-Rg3的途径
人参PPT型皂苷的人肠内细菌转化途径则较为简单,G-Rh1(mz637.5)、G-Rk3、G-Rh4(mz619.5)以及PPT(mz475.5)的含量均较转化前有了显著的提高(图8),推测其可能的转化途径见图9。
人参皂苷C-17侧链的C-24和C-25双键发生水合反应可生成25-OH化合物。对于侧链饱和的化合物,通过对各产物峰的指认,发现该类型化合物最终产物为20(S/R)-25-OH-PPT或20(S/R)-25-OH-PPD,其可能的转化途径见图10。
人参皂苷C-17侧链含有2个双键的化合物在人肠内细菌转化产物中也被检测到,如20(22)E-G-Rg9(71)。在水参加工为红参过程中,已知G-Rf可转化为20(22)E-G-Rg9、20(22)Z-G-Rg9、20(22)E-25-OH-G-Rg9等,后者脱水又产生20(22)E-G-Rg9,为这类化合物的产生途径提供了有益参考。如G-Rb1首先失去C-20糖链,转化为G-Rg3,后者C20-OH与C21脱水转化为C-17侧链含有2个双键的G-Rk1,或C20-OH与C22脱水转化为C-17侧链含有2个双键的G-Rg5(图7)[2]。

注:A.G-Rh1;B.G-Rk3和G-Rh4;C.PPT。图8 人参茎叶总皂苷及其人肠内细菌转化产物中G-Rh1、G-Rk3、G-Rh4和PPT离子色谱图
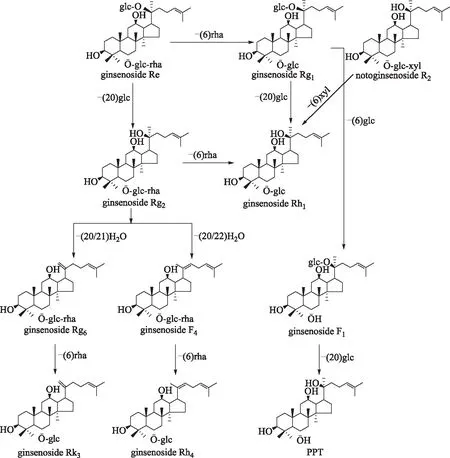
图9 人肠道细菌作用下人参皂苷的PPT转化途径

图10 人参茎叶侧链饱和型达玛烷三萜的人肠内细菌转化途径
20(S)-G-Rs3(84)和20(R)-G-Rs3(86)两者均属于大极性化合物,由于其含量甚微,因此在人参茎叶总皂苷中没有检测到。而在转化产物中,随着原型化合物的减少,可能含量相对提高,因此在产物中检测到了这些化合物的存在。某些人参达玛烷型三萜即在人参茎叶总皂苷中存在,在其人肠内细菌转化产物中亦存在,这与其没有转化完全和不同化合物之间的相互转化有关[1]。人参茎叶生长在地上部分,与空气接触更充分,氧化态成分比地下部分更丰富、更具多样性,与人参(地下部分)[20,24]经炮制而成的红参[34]类似的成分较多,稀有人参皂苷较多,相对更易吸收,生物活性更突出。
4 讨论
4.1 分离条件的优化
首先,优化了色谱分离条件,流动相包括乙腈-水、甲醇-水、乙腈-水(含0.1%甲酸)、甲醇-水(含0.1%甲酸),以获得良好的分离度和电离效率,结果显示,乙腈优于甲醇,流动相中加入少量的甲酸虽能调节分离度,但对于低极性的人参皂苷电离效率降低。因此,本研究最终选择乙腈-水作为流动相。在正、负离子化模式上,发现负离子化模式灵敏度更高、质谱更清晰、背景噪音更低。因此,本研究最终选择负离子化模式。对于碰撞能量,发现单糖苷和二糖苷在45 V效果好,三糖苷及其以上糖苷在60 V效果好。因此,本研究对每个样品选择45、60 V 2种碰撞能量。
4.2 人参皂苷结构的肠内菌生物转化使活性成分浓度增高
图3D与图3C比较表明,人肠内细菌对人参茎叶皂苷的转化使其复杂性简单化,使某些成分浓度升高,达到必要的有效浓度,发挥生物学作用。如G-Rb1首先失去C-20糖链末端葡萄糖基,转化为G-Rd,再依次失去C-3糖链的2个葡萄糖基,分别转化为G-F2和G-CK(G-Rb1→G-Rd→G-F2→G-CK)。G-CK显示出良好的生物学活性[2];G-Rb1→G-Rd→G-Rg3→G-Rk1或G-Rg5的转化具有同样的意义;此外,G-Rh1、G-Rh4、G-Rk3、PPT随着温孵培养时间的延长,含量也有增高的趋势。
值得注意的是,25-OH-PPT或25-OH-PPD衍生物是有发展潜力的抗肿瘤化合物[35-37]。人肠内细菌对人参茎叶皂苷的这种转化,无疑增加了人参茎叶皂苷的开发利用价值。

