SPE-UPLC-MS/MS法测定茶叶中的5-羟甲基糠醛
欧阳丽,王朝霞,汪辉,何海琴,胡晓博,袁圆
长沙市食品药品检验所,国家酒类产品质量监督检验中心(长沙 410013)
5-HMF具有细胞毒性,对上呼吸道、眼睛、皮肤、黏膜等具有刺激作用,过量摄入会降低细胞酶活性、损害肝功能甚至致癌[1-2]。研究表明,食品中的5-HMF主要由2种化学反应产生:一种是己糖的酸催化反应,即葡萄糖、果糖等单糖在酸性条件下脱水;另一种是美拉德反应,蛋白质、氨基酸中的游离氨基与单糖中羰基之间发生缩合反应[3-5]。多价金属阳离子(如Ca2+、Mg2+)在美拉德反应中起催化作用,能促进5-HMF生成[3]。茶叶富含蛋白质、氨基酸、肽、糖类、矿物质等成分,加工过程中存在热处理环节(如杀青、萎凋、干燥等),极可能产生5-HMF。为使茶叶外观更紧结、更有光泽,增甜增重,以次充好,许多不良商家在茶叶加工过程中非法添加蔗糖[6-8]。蔗糖也是产生5-HMF的底物之一[3,9]。
茶叶饮品被誉为世界三大饮料之一,具有抗衰老、抗肿瘤、降血糖等功效[10]。饮茶在中国不仅是一种生活习惯,更是一种源远流长的文化传统。中国是茶叶生产大国,同时也是茶叶的消耗大国,控制和检测茶叶中5-HMF含量具有重要意义。5-HMF的检测方法主要有高效液相色谱(HPLC)法[11-13]、气相色谱(GC)法[14-15]、气相色谱-质谱(GC-MS)法[16-17]、高效液相色谱-串联质谱(HPLC-MS/MS)法[18-24]等。由于复杂的基质效应,HPLC与GC易产生假阳性,灵敏度不高,特异性不强,较难满足茶叶中5-HMF的测定;GC-MS虽然具有较高的选择性、灵敏度与准确度,但分析时间长,分析效率不高;HPLC-MS/MS特别是UPLC-MS/MS具有分析速度快、特异性强、灵敏度高、准确等特点,在分析检测方面具有明显优势。
试验根据5-HMF的理化性质,采用纯水提取,HLB固相萃取小柱净化,甲醇洗脱,氮吹浓缩至近干,流动相复溶后,采用UPLC-MS/MS对茶叶中的5-HMF进行分析检测,建立一种测定茶叶中5-HMF方法,为茶叶中5-HMF含量的监控提供技术支撑与方法储备,为消费者购买茶叶提供安全保障基础。
1 材料与方法
1.1 试剂与材料
5-HMF标准品(纯度>99%,北京镇翔科技有限公司);甲醇、乙腈(色谱纯,德国默克公司);甲酸(HPLC级,天津市化学试剂研究所有限公司);氨水(色谱纯,上海市生化科技股份有限公司);茶叶为抽检样品。
1.2 仪器与设备
Acquity UPLC®H-Class/Xevo®TQ-S Micro超高效液相色谱-四极杆串联质谱仪,配有电喷雾离子源(ESI)(美国Waters公司);SK-1型快速混匀器(江苏金坛医疗仪器厂);CT14D-高速离心机(上海天美生化仪器设备工程有限公司);Visiprep-DL 24固相萃取真空装置(Sigma-Aldrich公司);AS3120超声波清洗器(天津奥特赛恩斯仪器有限公司);MV5全自动高通量平行浓缩仪(Labtech公司);超纯水仪(法国默克密理博公司);Oasis prime HLB固相萃取柱(60 mg,3 mL,美国Waters公司);C18固相萃取柱(60 mg,3 mL,迪马科技有限公司);MCX固相萃取柱(60 mg,3 mL,美国Waters公司)。
1.3 方法
1.3.1 色谱条件
色谱柱采用Agilent Zorbax SB-C18(2.1 mm×150mm,1.8 μm);流动相采用0.1%甲酸水溶液-甲醇(90∶10,V/V)等度洗脱;柱温40 ℃;流速0.3 mL/min;进样量10 μL。
1.3.2 质谱条件
离子源ESI,正离子模式;毛细管电压3.0 kV;源温度120 ℃;锥孔气流量60 L/h;脱溶剂气温度350℃;脱溶剂气流量700 L/h;数据采集方式为多反应监测(MRM),监测参数如表1所示。

表1 多反应监测参数
1.4 标准溶液的配制
精确称取10 mg 5-HMF至100 mL容量瓶中,用甲醇溶解并定容至刻度,配制成100 μg/mL标准储备液,于-18 ℃避光保存;准确移取1.0 mL标准储备液于100 mL容量瓶中,用甲醇稀释并定容至刻度,配制成质量浓度1 μg/mL标准中间溶液,用流动相逐级稀释,配制成质量浓度为2,5,10,50,100,200和500 μg/L的标准系列工作溶液,供超高效液相色谱-串联质谱仪测定。
1.5 样品制备
称取0.5 g粉碎混匀后的茶叶样品于100 mL锥形瓶中,加入50 mL水常温超声提取12 min,以10 000 r/min离心5 min,准确移取5.0 mL过Oasis prime HLB固相萃取柱(预先经3 mL甲醇、3 mL水活化),加2 mL 5%氨水溶液淋洗,待淋洗液完全流出后,用4 mL水洗至中性,用真空泵抽干固相萃取柱,用8 mL甲醇洗脱。整个固相萃取过程流速均为1~2滴/s。洗脱液于45 ℃氮吹浓缩至近干,加入1.0 mL流动相溶解残渣,涡旋混匀,溶液以0.2 μm有机滤膜过滤,供测定。
2 结果与分析
2.1 质谱条件的优化
5-HMF液质检测时常选用大气压化学电离源(APCI)[25]或电喷雾电离源(ESI源)[18-24]。一级质谱扫描(MS1 Scan)时,ESI源的响应值优于APCI源,且正离子模式(ESI+)比负离子模式(ESI-)响应高出约2个数量级,因此选用ESI+作为质谱的电离方式。ESI+电离时,5-HMF与流动相中甲酸提供的H+结合,形成母离子[M+H]+,质荷比为127,优化样品锥孔电压(Cone电压)使其响应最强;二级质谱扫描时,[M+H]+离子在碰撞气与碰撞能的作用下,得到其碎片离子(子离子),如图1所示,其中质荷比为109,81和53的碎片离子丰度最高,根据文献[18, 26]报导,5-HMF的ESI+裂解机理为母离子[M+H]+先失去1分子水形成[M+H-H2O]+(质荷比109),脱去1个羰基产生碎片[M+H-H2O-CO]+(质荷比81),C—O键断裂,开环,得到质荷比53的碎片离子[M+H-H2O-2CO]+。试验选择丰度最高的碎片109作为定量离子,碎片81与53作为定性离子,优化3个碎片离子的碰撞能,使其响应值最高。

图1 5-HMF的二级质谱图
2.2 色谱柱的选择
试验选择XBridge BEH Amide柱(2.1 mm×150 mm,5 μm)、Venusil Hilic柱(2.1 mm×150 mm,5 μm)和Agilent SB-C18柱(2.1 mm×150 mm,1.8 μm)3种不同性能的色谱柱对5-HMF进行分离分析。这3种色谱柱各具特点,其中,XBridge BEH Amide柱拥有化学稳定、三键键合的酰胺基键合相,性能卓越且分离对象的极性范围广;Venusil HILIC柱具有强极性固定相,常用于改善强极性化合物在反相色谱中的保留行为;Agilent SB-C18柱分离性能优越,化学稳定性好。试验结果发现,使用XBridge BEH Amide柱与Venusil Hilic柱时,5-HMF的色谱峰峰型不对称,响应低;使用Agilent SB-C18色谱柱能获得比其他两者高出约1个数量级的响应值,且峰型对称,故试验选择Agilent SB-C18柱作为分离用色谱柱。
2.3 色谱分离的优化
甲酸或乙酸常被添加到流动相中以提高ESI+电离模式下目标物的离子化效率,试验采用0.1%甲酸水溶液-甲醇作为流动相。流动相流速0.3 mL/min,柱温35 ℃,优化流动相比例以获得目标峰理想的分离度与分离效果。不同流动相比例下5-HMF的总离子流图如图2所示。V(0.1%甲酸水溶液)∶V(甲醇)=80∶20时,5-HMF的保留时间约2 min,出峰太早不利于与干扰组分分离,逐渐升高水相的比例,5-HMF的保留时间不断后移,同时色谱峰变宽;甲酸水溶液升高到90%时,5-HMF峰型对称,分离效果好;甲酸水溶液升高到95%时,色谱峰峰型对称性变差,拖尾较明显,且水相比例过高易引起C18色谱柱固定相塌陷,导致柱效迅速下降,甚至缩短其使用寿命。因此,试验中流动相比例为V(0.1%甲酸水溶液)∶V(甲醇)=90∶10,此条件下5-HMF标准溶液(100 μg/L)的提取离子色谱图如图3所示。
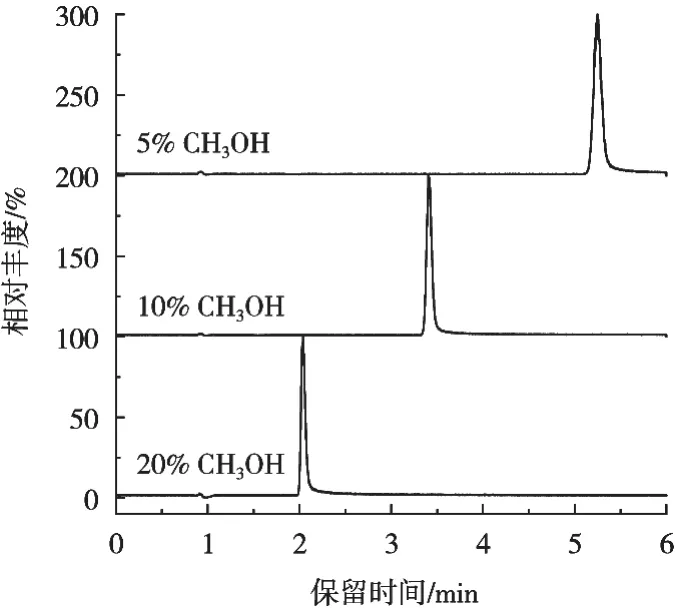
图2 不同流动相比例下5-HMF的总离子流图(标准溶液质量浓度100 μg/L)

图3 标准溶液的提取离子色谱图(100 μg/L)
2.4 前处理条件的选择
HMF易溶于水、甲醇、丙酮、乙酸乙酯等溶剂。为减少茶叶中脂溶性成分的溶出,试验采用纯水作为提取溶剂,常温下超声提取。考察不同提取时间对同一阳性茶叶样品中5-HMF的提取效果的影响,结果如图4所示。随着超声时间延长,样品中5-HMF不断溶出,12 min后基本平衡,为避免提取液中色素等杂质的含量过高,将样品的超声提取时间定为12 min。
茶叶基质较复杂,水溶性物质主要有茶多酚、生物碱、氨基酸、糖类、芬香物质等。近年来,不法商家为了追求茶叶的色泽亮丽,可能将茶叶人为染色[27],使茶叶水提取液中基质更加复杂。消除基质效应最关键的方法是样品前处理时选择有效的净化方式,最大限度去除干扰组分。为准确检测5-HMF含量,减少基质效应,常用的净化方法主要有固相萃取[18-19]及QuEChERS分散净化技术[24]。QuEChERS法更适于用乙腈等作为提取溶剂,但茶叶用有机溶剂提取,杂质溶出较多,净化难度增加。因5-HMF易溶于水,试验选择水作为提取溶剂。C18柱、阳离子交换柱与HLB柱是常用于净化复杂基质中5-HMF的固相萃取柱。比较C18(60 mg,3 mL)、MCX(60 mg,3 mL)、HLB(60 mg,3 mL)3种小柱的净化效果。结果表明,C18小柱净化效果不佳,洗脱液颜色较深,且5-HMF损失较严重,这可能是因为以非极性吸附剂为填料的C18小柱对5-HMF的保留能力较弱;MCX(60 mg,3 mL)与HLB(60 mg,3 mL)经3 mL甲醇、3 mL水活化后,取5 mL提取液上样、4 mL水淋洗、甲醇洗脱,2种柱子的洗脱液颜色均较深;将淋洗液改为5%氨水溶液,2种小柱中保留的色素不断被洗脱,氨水溶液增加至2 mL后,流出液颜色变浅,加水淋洗至流出液呈中性,用甲醇洗脱,得到接近无色透明的洗脱液。计算5-HMF的回收率,HLB柱优于MCX柱。
因此选择HLB柱作为样品净化的固相萃取柱,5%氨水作为淋洗液,甲醇作为洗脱液。适当增加洗脱液体积,5-HMF回收率不断增大;洗脱液体积增加至8 mL,5-HMF回收率在90%以上,进一步增大洗脱液体积,回收率没有明显改善。因此试验将洗脱液体积定为8 mL。洗脱液在45 ℃氮吹浓缩至近干,用1.0 mL流动相溶解残渣,涡旋混匀,以0.2 μm有机滤膜过滤,超高效液相色谱-串联质谱分析。

图4 超声时间对5-HMF提取的影响
2.5 基质效应
化学分析中,样品中被分析物以外的组分对分析物的分析过程有干扰并影响分析结果的准确性,这种影响和干扰称为基质效应(ME)。在液相色谱-串联质谱分析中的基质效应表现为:样品中的干扰组分同待测物一同流出色谱柱,在离子源气化发生库伦爆炸变成小液滴直至产生气体离子的过程中,这些干扰物质会同待测物离子竞争液滴表面,从而导致待测物的离子化效率降低或者增强,引起响应降低或增高,最终影响分析结果的准确性。一般情况下,基质效应值在85%~115%不存在明显基质效应[28]。采用相对响应值法评价5-HMF的基质效应,根据样品基质溶液中5-HMF的响应强度与相同浓度标准溶液中5-HMF响应强度的百分比值评价基质效应。取3份空白样品,各0.5 g(检测结果为阴性的绿茶和黑茶),按照1.5的方法进行前处理,洗脱液于45 ℃氮吹浓缩至近干,分别加入1.4中质量浓度10,50和100 μg/L的标准溶液1.0mL溶解残渣,涡旋混匀,制成样品基质配标溶液,每个浓度重复6次(n=6)。基质配标溶液与标准溶液同时进行UPLC-MS/MS分析,通过记录5-HMF的峰面积,计算样品基质的基质效应,结果如表2所示。茶叶中的基质效应值在88.2%~105.2%,基质效应不明显,可忽略基质效应对测定结果的影响。
2.6 方法学评价
2.6.1 方法的线性与检出限
按照1.4的方法配制标准系列溶液,以浓度为横坐标,峰面积为纵坐标绘制标准曲线,其线性方程为y=5 255x+25 911,r2>0.998,表明5-HMF在2~500μg/L浓度范围内具有良好的线性。以信噪比(S/N)为3计算方法检出限(LOD),以信噪比(S/N)为10计算方法定量限(LOQ),方法中5-HMF的LOD与LOQ分别为0.012和0.04 mg/kg,检测灵敏度较高。
2.6.2 加标回收率与精密度
茶的种类虽然数不胜数,但按制作工艺中是否进行发酵可分为发酵茶与不发酵茶两大类,其中绿茶为典型的不发酵茶,黑茶为发酵茶。试验选取1个绿茶、1个黑茶(检测结果均为阴性)为样本进行加标回收试验。2个样本中的加标量均为0.5,1.0和5.0mg/kg这3个水平,每个水平平行6次(n=6),进行加标回收与精密度试验,结果见表3。5-HMF回收率在81.1%~93.9%,日内精密度(δRSD)在1.65%~ 5.82%。取加标量1.0 mg/kg绿茶、黑茶样品,连续测定3 d,分别评价其日间精密度,计算结果分别为5.01%和6.24%,符合相关标准要求[29],结果表明试验方法能准确检定茶叶中5-HMF。

表2 茶叶的基质效应(n=6)

表3 加标回收率与精密度
2.6.3 重复性试验
取一阳性茶叶样品,平行称取6份,按1.5的方法进行前处理,在1.3的仪器条件下进行测定,结果分别为0.56,0.57,0.56,0.52,0.54和0.57 mg/kg,其δRSD为3.41%,可见方法具有良好重复性。
2.7 实际样品的测定
采用此次试验优化的方法对抽检的42批次茶叶样品进行5-HMF含量检测,其中34批次样品检出5-HMF。34批次茶叶样品包括不发酵茶与发酵茶,茶叶中5-HMF的含量大部分分布在0.1~1.0 mg/kg范围内;少部分茶叶中5-HMF含量超过1.0 mg/kg;极个别茶叶中5-HMF超过7.0 mg/kg,包括1个乌龙茶与红茶样品。检测结果表明茶叶在加工储存过程中很可能产生5-HMF,检测和控制其含量具有重要意义。
3 结论
通过对提取时间、质谱参数、色谱分离条件和固相萃取前处理条件的优化,建立一种茶叶中5-HMF含量的固相萃取-超高效液相色谱-串联质谱检测方法。方法在2~500 μg/L质量浓度范围内线性良好(r2>0.998);灵敏度高,取样量0.5 g时,方法检出限为0.012 mg/kg;准确度高,样品中加标回收率在81.1%~93.9%。采用所建立的方法对茶叶样品进行测定,多种茶叶中检出5-HMF,其生成机理还需深入探讨。

