中华绒螯蟹水通道蛋白1基因的克隆、表达及RNA干扰研究
杨志刚,张 龙,陈春宇,成永旭,夏冬梅
(1.上海海洋大学 农业部淡水水产种质资源重点实验室,上海 201306;2.上海海洋大学 农业部鱼类营养与环境生态研究中心,上海 201306;3.福建省水产功能性饲料与养殖环境调控重点实验室,福建 漳州 363000)
水通道蛋白是一类跨膜蛋白,允许水和甘油等小的不带电荷的溶质穿过脂质双层细胞膜[1-4].迄今为止,已经鉴定出13个哺乳动物水通道蛋白(Aquaporins, AQPs)成员(AQP0~AQP12),其中AQP0~AQP10功能已得到验证[5-6].AQP家族根据其渗透性特征可分为3组,即经典的水选择性水通道蛋白(AQP0,AQP1,AQP2,AQP4,AQP5)和甘油转运水通道蛋白(AQP3,AQP7,AQP9,AQP10)以及尚未阐明其功能的水通道蛋白(AQP11和AQP12)[3,7-9].目前,对于水生动物水通道蛋白的研究主要集中在鱼类中[10-12],对甲壳类动物的研究较少[4,13-14].
中华绒螯蟹(Eriocheirsinensis,Es)在我国长江中下游的河流和湖泊中广泛分布,是一种具有养殖前景的经济甲壳动物.本文成功从中华绒螯蟹鳃组织中克隆获得了EsAQP1的全长互补DNA(cDNA),通过荧光定量PCR(qPCR)分析EsAQP1在不同组织中的表达模式,并分析了其序列特征和系统进化关系,通过测定盐度胁迫和dsRNA作用下中华绒螯蟹蛋白Na+-K+-Cl-协同转运蛋白(NKCC)基因和钠钾泵(Na+/K+-ATPase)基因的表达,进一步探讨了EsAQP1在渗透压调节方面的功能,可为研究甲壳动物水通道蛋白与渗透压调节机制之间的关系积累基础资料.
1 材料与方法
1.1 动物
从上海海洋大学崇明基地捕捉实验用的中华绒螯蟹,体质量(6.50±1.21)g,暂养一周,水温21~25℃.水体pH7.5~8.0,持续充氧,每天换1/3养殖水,于每天18∶00定时投喂商品饲料.随机挑选健康的中华绒螯蟹分为3组:低盐度组(12‰)、高盐度组(24‰)、对照组(0‰),每个组设6个重复,每个重复60只.利用淡水、卤水配制实验设置的盐度,每天更换一半养殖水量,同时进行盐度校准.分别于0,3,6,12,24,48,72和96h,每组随机选取6只健康个体,置冰上麻醉采样,解剖取其鳃和肠组织,用于RNA提取.同样每组另外取6只健康个体,冰上麻醉后解剖,分别取其脑、胸神经、肝胰腺、肌肉、肠、心脏、脑、血、胃和鳃组织.提取的所有组织均迅速用液氮速冻,并保存在-80℃冰箱,用于荧光定量测定.
1.2 EsAQP1基因全长cDNA的克隆及鉴定
使用RNAiso(TaKaRa,日本)提取中华绒螯蟹后鳃的总RNA,并通过逆转录获得其第1链cDNA(PrimeScriptTMⅡ试剂盒TaKaRa,日本),将特异性引物AQP-F1和AQP-R1(表1)分别与通用引物UPM配对,分别进行3’-RACE和5’-RACE扩增.实验所有引物合成及测序均由生工生物(上海)股份有限公司完成.
1.3 序列分析
利用BLASTn和BLASTx(http://blast.nlm.nih.gov/Blast.cgi)鉴定相关生物中的同源序列并验证其相似性.采用ORF Finder程序(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)预测氨基酸序列和EsAQP1核苷酸序列的开放阅读框(Open Reading Frame, ORF).利用ExPASy软件来预测AQP1蛋白的等电点、分子量和氨基酸功能域.利用DNAMAN和MEGA 5.0软件,与三疣梭子蟹(Portunustrituberculatus)、罗氏沼虾(Macrobrachiumrosenbergii)、斑节对虾(Penaeusmonodon)、可口美青蟹(Callinectessapidus)、美洲鲎(Limuluspolyphemus)、温室拟肥腹蛛(Parasteatodatepidariorum)等物种的序列进行多重比较并构建进化树.
1.4 AQP1-mRNA组织定量分析
通过qRT-PCR分析AQP1mRNA在不同组织中的表达.以中华绒螯蟹18S-RNA基因作为内参基因,使用PrimeScriptTM RT Master Mix(Perfect Time)将各组织的总RNA样品反转录为cDNA第1链.并针对AQP1和18S-RNA设计实时特异性引物(表1).10μL qRT-PCR反应包含5μL ChamQ Universal SYBR qPCR Master Mix(Vazyme),3.6μL ddH2O级水,1.0μL稀释的cDNA模板(两倍稀释)和0.2μL(10μmol/L)正/反引物.在ABIPRISM®7500仪器(美国Applide Biosystems)中进行qRT-PCR,运行程序为95℃30s,95℃ 5s,60℃ 34s,40个循环;溶解曲线分析程序为:95℃ 15s,60℃ 1min,95℃ 15s.通过2-ΔΔCt法用Excel软件分析EsAQP1的相对表达量.

表1 实验所用引物及其序列
1.5 EsAQP1基因干扰实验
1.5.1 双链RNA(dsRNA)合成
使用基因特异性引物AQP1-R1,AQP1-F1,AQP1-R2,AQP1-F2,AQP1-R3,AQP1-F3,AQP1-R4和AQP1-F4进行dsRNA制备DNA模板5’端(表2).作为对照,选取模板需带有绿色荧光蛋白(GFP)载体,引物扩增GFP dsRNA需具有T7启动子序列,如表2所示.PCR产物通过TIANprep Mini Plasmid Kit(天根生化科技,中国)纯化并用作模板.用T7高效转录试剂盒(TransGen Biotech,中国)合成AQP1(dsRNA 1,2,3,4,5)和GFPdsRNA.合成的dsRNA利用琼脂糖电泳验证,再利用紫外分光光度计测定其浓度.

表2 干扰实验用引物
1.5.2 基因沉默和荧光定量分析
实验用中华绒螯蟹放在室内循环水系统中养殖一周后,取出置于冰上麻醉10min,然后用70%的乙醇浸泡中华绒螯蟹消毒10min,再取其鳃组织,体外培养并用3种不同的方式处理:(1)加入1μL GFP dsRNA;(2)加入1μL AQP1 dsRNA-1;(3)空白对照组.鳃组织在26℃培养1,2,4和8h后分别提取其总RNA,利用荧光定量检测NKCC和Na+/K+-ATP基因的相对表达水平.
1.6 数据分析
数据统计分析采用SPSS 24.0进行单因素方差分析(Analysis of Variance, ANOVA),并进行Duncan’s多重比较分析各组间的差异性,P<0.05为差异显著水平.
2 结 果
2.1 EsAQP1 cDNA克隆和序列分析
EsAQP1的cDNA全长为1646bp,开放阅读框(ORF)为1119bp,编码373个氨基酸,基因序列中存在199bp的5’-非翻译区(UTR)和325bp的3’-UTR.推导的水通道蛋白的分子量(MW)和等电点(pI)为39.367kDa和5.1.氨基酸组成分析表明,EsAQP1编码的多肽链具有22个带正电荷氨基酸残基(Arg和Lys),32个带负电荷氨基酸残基(Asp和Glu),并且不稳定性系数为29.04.疏水性为0.168,属于稳定蛋白.ExPASy软件分析显示,EsAQP1蛋白包含6个跨膜结构域(分别位于21~48、54~76、97~119、139~160、172~193和213~233)和2个NPA(Asn-Pro-Ala)域和一个片段MIP家族(HINPAVT)的保守序列(图1,第96页).
2.2 同源性和进化树分析
使用DNAMAN软件对EsAQP1的氨基酸序列和具有较高同源性的其他物种进行多重比对(图2,第97页).中华绒螯蟹与三疣梭子蟹(Portunustrituberculatus)相似性为74.42%,同源性最高,与可口美青蟹(Callinectessapidus)、美洲鲎(Limuluspolyphemus)、罗氏沼虾(Macrobrachiumrosenbergii)、温室希蛛(Parasteatodatepidariorum)和斑节对虾(Penaeusmonodon)同源性分别为71.30%、57.38%、63.98%、52.29%和63.46%.EsAQP1氨基酸序列具有AQP1家族成员的所有典型保守特征,包括6个跨膜结构域,两个NPA(Asn-Pro-Ala)结构域和两个保守序列HINPAVT和PLAIGL.
使用MEGA5.0软件采用邻接法(Neighbor-Joining, NJ)构建了AQP1的系统进化树,发现AQP1序列属于不同的谱系.EsAQP1的序列首先与三疣梭子蟹、可口美青蟹、斑节对虾等甲壳类动物的AQP1序列聚类,然后与其他无脊椎动物聚类,最后与脊椎动物聚为一支(图3,第97页).

图3 AQP1氨基酸序列的NJ系统进化树
2.3 EsAQP1 mRNA在不同组织中的表达
中华绒螯蟹EsAQP1基因在其脑、胸神经节、肝胰腺、肌肉、鳃、肠、心脏、胃和血细胞中均有表达(图4).其中EsAQP1基因在肠道和鳃组织中的mRNA转录水平显著高于其他组织(P<0.05),其次是胸神经节和脑稍低,在肝胰腺和血细胞中mRNA转录水平最低.

图4 中华绒螯蟹不同组织中AQP1的mRNA转录分析
2.4 盐胁迫对EsAQP1表达的影响
不同盐度胁迫后,中华绒螯蟹肠组织AQP1基因表达模式的变化如图5(a)所示.相比于对照组,高盐度胁迫0~3h中,EsAQP1基因的mRNA转录水平显著降低,在6h达到最低值;接着在12h开始上调并达到最高,然后于48h显著下调,并在随后的时间保持较低的转录水平量(P<0.05)(图5(a)).在低盐度胁迫0~3h中,AQP1基因的mRNA转录水平显著下调,在6h达到最低值;接着在6~24h中开始上调并在24h达到最高,24~48h下调,48~72h上调,72~96h下调(P<0.05).
不同盐度胁迫后,中华绒螯蟹鳃组织AQP1基因表达模式的变化如图5(b)所示.相比对照组,在0~3h中,高盐度胁迫组中EsAQP1基因的mRNA转录水平显著下调,并在3~12h这个时间段保持较低的转录水平,经过24h后,转录水平开始上调,随后一直保持缓慢上升的转录水平(P<0.05).在低盐度胁迫中,0~6h,其mRNA转录水平显著下调,随后于12h开始缓慢上调(P<0.05).

图5 EsAQP1基因在盐度胁迫下的相对表达量
2.5 沉默EsAQP1对NKCC和Na+/K+-ATP的影响
根据已知序列分别合成了AQP1dsRNA-1、AQP1dsRNA-2、AQP1dsRNA-3、AQP1 dsRNA-4和AQP1dsRNA-5基因片段,结果发现均能有效干扰AQP1基因的表达.由于AQP1dsRNA-1靠近5’端且避开所有保守序列区,所以选择基因片段,同时为了保证较高的干扰效率,经筛选后确定AQP1dsRNA-1的用量为1μL.接着将1μLAQP1dsRNA-1加入培养基中1h,2h,4h和8h后,通过实时荧光定量PCR分析了鳃组织中渗透压调节基因的表达.与对照组相比,鳃组织培养2h后NKCC基因表达显著上调,并在4h达到最大值,然后下降(P<0.05,图6(a)).利用实时荧光定量PCR来检测干扰后不同时间点鳃组织中Na+/K+-ATP基因的表达情况.相比于对照组,Na+/K+-ATP基因的相对表达在干扰2h后显著增加(P<0.05),并在8h达到最大值(P<0.05,图6(b)).
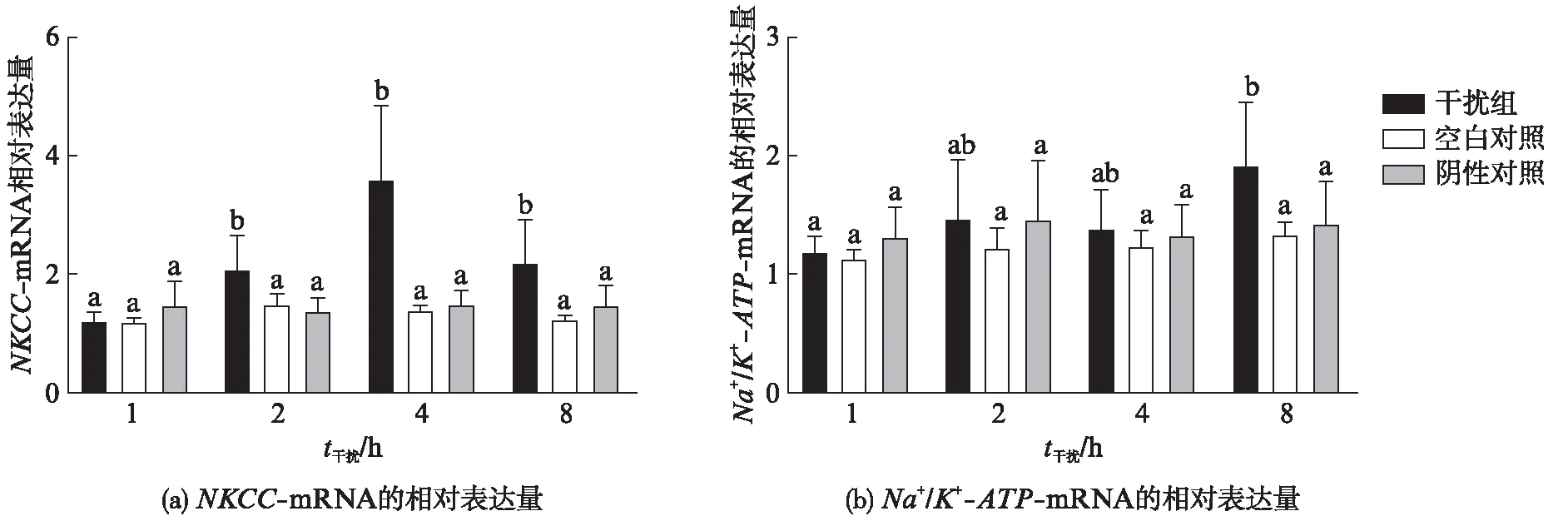
图6 AQP1干扰片段对NKCC-mRNA以及Na+/K+-ATP-mRNA表达量的影响
3 讨 论
AQP广泛分布在动植物细胞膜中,具有水转运、细胞渗透调节、渗透胁迫响应和选择性离子渗透等功能[17-19].在脊椎动物中,已经克隆了较多AQPs基因并进行了有关功能验证[20-21].但是在无脊椎动物,尤其是在甲壳类动物中的有关研究却十分有限.在本研究中,从中华绒螯蟹鳃组织中克隆获得EsAQP1基因,并探讨了其组织表达分布以及盐胁迫对其表达的影响.生物信息学分析显示,EsAQP1具有典型的AQPs家族结构,具有6个跨膜结构域,两个NPA(Asn-Pro-Ala)域和一个区段MIP家族的保守序列(HINPAVT).推导的373个氨基酸多肽序列和结构在甲壳类动物中相对保守,氨基酸序列比对表明EsAQP1与三疣梭子蟹、可口美青蟹、美洲鲎、罗氏沼虾、温室希蛛和斑节对虾的AQP1具有50%~75%的序列相似性[4,13,22].
鳃组织是生物进行离子和气体交换以及渗透压调节等过程的重要组织器官.已有研究表明中华绒螯蟹在生长发育、繁殖以及迁徙过程中会通过鳃组织调节机体渗透压来保证机体内环境的稳定.本研究结果显示:中华绒螯蟹EsAQP1基因在鳃中表达量显著高于其他组织,说明中华绒螯蟹鳃组织在渗透压调节中发挥重要作用.此外,EsAQP1基因在肠组织中的表达水平也显著高于其他组织,说明中华绒螯蟹肠道也是渗透压调节的重要场所.
王渝等[4]研究发现:在低盐度胁迫下三疣梭子蟹鳃组织中AQP1的表达呈现先下降再上升的趋势,其在3~12h内表达量保持较低水平,随后于24~48h开始上调,这说明水通道蛋白基因在渗透压调节过程可能发挥重要的作用.An等[10]研究发现AQP1基因在黑鲷(Acanthopagrusschlegeli)体内的表达在淡水和海水中呈现相反的趋势:在淡化过程中,鳃和肠中的表达量最高,肾脏中表达量较低;在海水中,肾脏中表达量远远高于鳃和肠.在大西洋鲑(Atlanticsalmon)[11]、鳉鱼(Fundulusheteroclitu)[23]、日本鳗鲡(Anguillajaponica)[24]等鱼中也获得相似的结果,在外界盐度升高时AQP1表达量下降以保证机体渗透压的平衡[25].当外界盐度下降,AQP1表达量增加排出多余水分,保证机体渗透压稳定[11],本实验的结果也说明了这一点.
研究表明RNA干扰已经成功应用于斑节对虾、斑马鱼和大鼠等动物体内.特定的干扰片段在干扰过程中起主要作用,目前使用的干扰片段可通过体外转录或化学合成等方式获得[26].RNA干扰技术因为其高效性和高特异性在基因功能的探索、疾病治疗等生物领域应用广泛[27].而在甲壳类动物中,在基因功能的检测上也常用到RNA干扰技术[28].
NKCC是一种电中性离子跨膜转运蛋白,在脊椎动物和无脊椎动物中均分布十分广泛.NKCC以1Na+∶1K+∶2Cl-的比例对离子进行跨膜转运,在维持细胞离子平衡、渗透压调节以及机体形态等方面发挥重要作用.钠钾泵(Na+/K+-ATP)是一种广泛存在于细胞膜上的嵌入式跨膜蛋白,其转运模式是通过酶和ATP分子相结合,这种结合使酶的结构改变,从而导致膜内结合3个Na+和膜外结合2个K+,这种结构的改变会使ATP水解释放能量给酶,酶具有能量后,可使K+进到膜内,而Na+排出膜外.这种转运模式在机体免疫、能量代谢、渗透压调节、细胞离子平衡等很多方面发挥重要作用[29].研究发现在拟穴青蟹、日本囊对虾、三疣梭子蟹等甲壳类动物中NKCC和Na+/K+-ATP基因在盐度胁迫下被激活,促进机体向外分泌离子,维持机体渗透压平衡,保证机体内环境稳定.本研究通过实时荧光定量检测干扰后不同时间点鳃组织中NKCC基因和Na+/K+-ATP基因的表达情况,发现这两个基因的相对表达量在干扰后均显著增加.这表明通过干扰AQP1基因的表达,降低了鳃中细胞内外水的转运工作,导致细胞内外存在渗透压差,促使鳃中NKCC和Na+/K+-ATP基因上调,使机体向胞外排出多余离子而发挥其功能.本研究通过对EsAQP1基因的干扰初步探讨了其功能,发现其可能在中华绒螯蟹的渗透压调节系统中起重要作用.

